用瞬时引物编辑方法治疗小鼠代谢性肝病
研究概述
2025年5月20日,苏黎世大学Gerald Schwank教授团队在Nature Biomedical Engineering期刊发表标题为“Treatment of a metabolic liver disease in mice with a transient prime editing approach”的研究论文,该研究主要开发了一种基于瞬时Prime编辑技术的基因治疗策略,通过脂质纳米颗粒(LNP)递送Prime编辑器mRNA和gRNA,成功纠正了苯丙酮尿症(PKU)小鼠模型中的致病突变,并显著降低了血液中苯丙氨酸水平,为遗传性肝脏疾病的治疗提供了新的高效平台。

导读
本研究使用了Pah enu2小鼠模型,该模型携带一个点突变(c.835T>C;p.F263S),该突变破坏了PAH的功能,并导致Phe水平从60 µmol l−1升高到1,500 µmol l−1。Richards等人曾尝试利用CRISPR-Cas9核酸酶和规律间隔短回文重复序列(CRISPR)来纠正这种代谢性肝脏疾病,但由于肝脏中同源定向修复(HDR)的频率较低,只有1%的肝细胞被纠正,高苯丙氨酸血症也未能得到解决。为了避免HDR的需求,作者和其他研究者之前曾使用碱基编辑来修复致病的PKU突变,并实现了降低Phe水平的治疗效果。然而,尽管碱基编辑在PKU患者的临床应用中具有潜力,但该技术主要限于修复转换点突变,排除了其他类型突变的患者。
与碱基编辑类似,Prime编辑技术可以在不需要HDR的情况下精确修复突变。Prime编辑器(PE)由H840A SpCas9切口酶(nCas9)与改造的莫洛尼氏小鼠白血病病毒(M-MLV)逆转录酶融合而成(此后称为PE2)。该复合体由Prime编辑引导RNA(pegRNA)引导至目标位点,pegRNA包含逆转录酶模板(RTT)和与引导RNA骨架3′端融合的引物结合位点。nCas9介导的非靶标DNA链切口和引物结合位点的杂交使得逆转录酶能够以RTT序列为模板延长3′ DNA末端。成功将生成的3′片段整合到目标位点中即可实现预期的编辑。因此,Prime编辑能够引入理论上任何小型遗传变化。
近期多项研究已证明Prime编辑在肝脏中的体内概念验证。然而,在使用RNA–LNP传递PE和pegRNA的瞬时Prime编辑方法中,编辑效率仍然较低(即使重新给药,Pcsk9位点的编辑效率仍低于8%)。尽管在通过病毒载体传递PE的研究中实现了更高的编辑效率,但PE的永久表达可能会给临床应用带来挑战,因为它增加了意外引入非靶标突变的可能性,并可能触发T细胞介导的清除持续表达基因编辑器的编辑细胞。
在本研究中,作者开发了肝脏瞬时Prime编辑策略,通过LNP封装的mRNA传递PE。使用腺相关病毒(AAV)表达pegRNA时,作者在Dnmt1位点实现了高达47.4%的编辑效率,在Pah enu2位点实现了20.7%的编辑效率。当以合成的化学修饰RNA形式共传递pegRNA时,编辑效率分别达到了35.9%和8.0%。两种传递方法均成功将Phe水平降低至360 µmol l−1的治疗阈值以下,展示了mRNA–LNP介导的Prime编辑方法在纠正遗传性肝脏疾病中的潜力。
正文
在早期研究中,作者尝试利用AAV介导的intein分裂PE2和靶向Pah enu2的pegRNA来纠正Pah enu2小鼠模型中的致病突变,但校正率低于1%,且仅在使用腺病毒载体以临床上不可行的剂量时才取得成功。因此,作者尝试通过改进Prime编辑技术来提高校正率。
作者将PE2替换为PEmax,并在pegRNA的3′端加入伪结结构以防止外切酶降解,同时在PAM的GG序列中引入沉默突变以防止编辑后的位点被重新靶向。这些改进显著提高了校正率,并将插入-缺失(indel)率降低到背景水平(图1a-c)。
随后,作者利用AAV载体将优化后的PE组分(PEmax + tevopreQ1-mPKU-SM)传递到Pah enu2小鼠体内。由于PE的大小超出了AAV的包装能力,作者采用intein分裂系统将Cas9分割开来,并从两个独立的AAV中表达PE。
重组AAV2基因组被包装进肝脏趋向性的AAV9衣壳中,并通过尾静脉以每公斤1×10¹⁴vg的剂量系统性地注射到小鼠体内(图1e)。7周后,通过下一代测序(NGS)分析分离的肝细胞,发现Pah enu2突变的校正率达到4.6%,血液中苯丙氨酸(Phe)水平从超过1,500 µmol l⁻¹降低到623.7 µmol l⁻¹(图1f和图1g)。编辑主要局限于肝细胞,且未在非靶标位点检测到意外编辑。
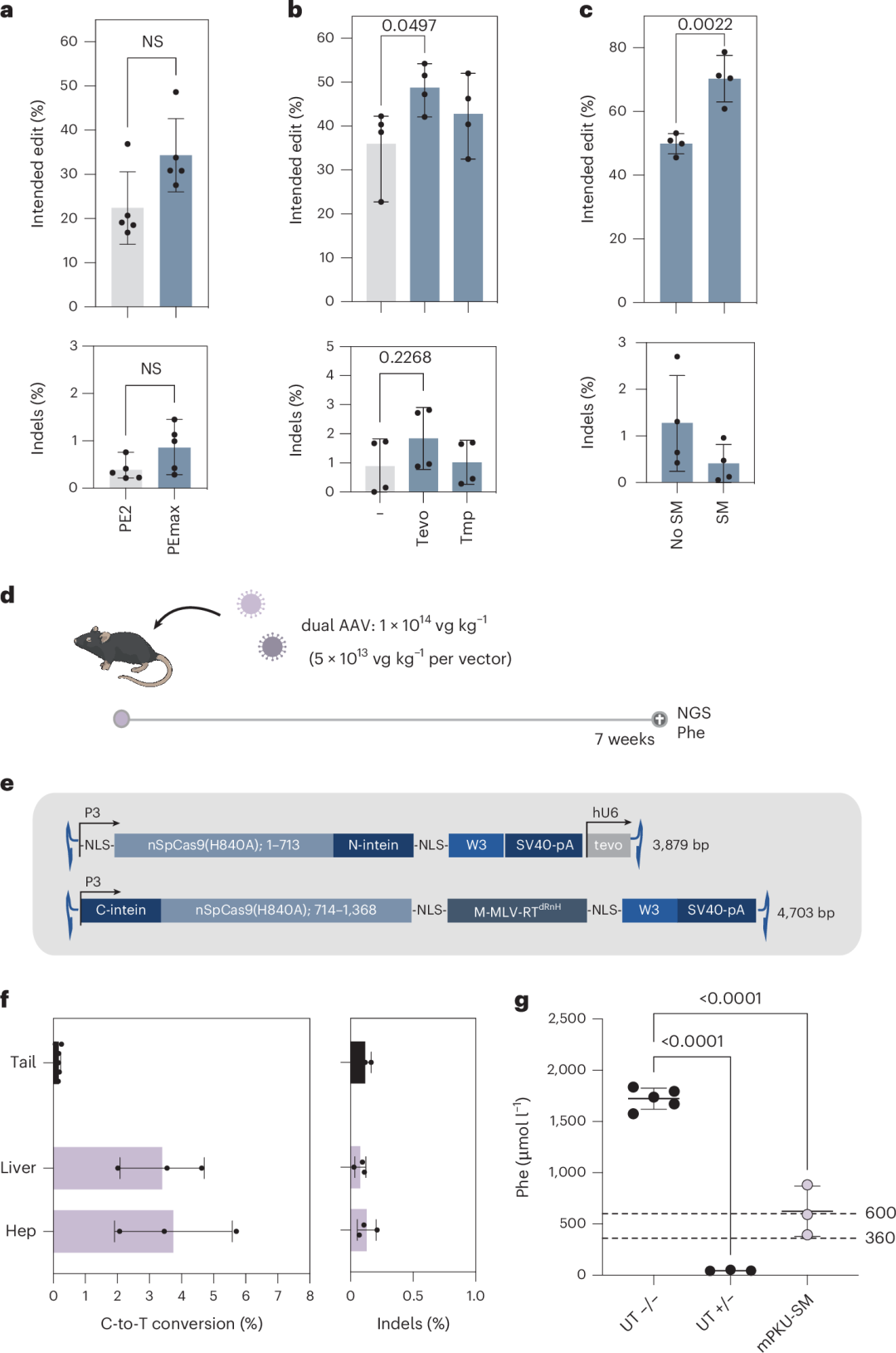
图1. 使用AAV介导的intein分裂PEmax进行Pahenu2小鼠的体内校正。
2. 使用LNP介导的RNA递送进行肝脏Prime编辑
尽管优化后的AAV载体和Prime编辑组分显著提高了Pah enu2的校正率,但仍未能将苯丙氨酸(Phe)水平降低至治疗阈值以下。此外,高剂量AAV(1×10¹⁴ vg kg⁻¹)可能引发严重免疫反应,且长期表达PE可能导致非靶标突变积累或免疫反应。
为了探索更安全的递送方式,作者尝试了LNP介导的mRNA和pegRNA递送。研究发现,在系统性注射2 mg kg⁻¹的mRNA–LNP后,PE mRNA和蛋白水平分别在6小时和24小时达到峰值,45小时后不再可检测(图2a)。作者合成了靶向Pah enu2位点和Dnmt1位点的pegRNA,并通过化学修饰保护其免受外切酶和内切酶降解。在HEK细胞中共电转染PEmax mRNA和pegRNA后,Pah enu2位点和Dnmt1位点的编辑效率分别为25%和37%(图2b)。
然而,在小鼠中采用重复给药方案(先注射PEmax mRNA,14小时后注射pegRNA)时,编辑效率仍然较低:Dnmt1位点为1.4%,Pahenu2位点为0.4%(图2c和图2d)。进一步实验表明,同时注射mRNA–LNP和pegRNA–LNP的小鼠编辑效率最高(单剂量后3.5%,5天后重新给药后达到10.5%;图2e和图2f)。但即使在5天间隔内重新给药三次,编辑效率仍仅为0.1%。这表明,尽管LNP介导的RNA递送具有潜力,但当前的给药方案仍需优化以提高编辑效率。

图2. 使用RNA-LNP递送的体内引物编辑
3. 使用PEmax mRNA–LNP进行Pahenu2小鼠的体内校正
作者推测,RNA–LNP方法中Prime编辑效率可能受限于pegRNA的低丰度和快速降解。因此,作者尝试了一种替代策略:仅通过mRNA–LNP瞬时传递PE,而pegRNA则通过AAV传递。
PKU小鼠首先接受2.5×10¹³ vg kg⁻¹的scAAV2/9处理,编码tevopreQ1-mPKU-SM pegRNA,随后接受3 mg kg⁻¹的PE2或PEmax mRNA–LNP治疗(图3a)。结果显示,在Dnmt1位点,PE2的编辑率为17.7%,PEmax的编辑率达到了26.2%(图3b和图3c),而在Pahenu2位点,编辑率较低(PE2为1.1%,PEmax为1.0%)。即使在PE传递后4个月,编辑率也未下降,表明编辑效果持久。
此外,降低scAAV2/9剂量至1×10¹² vg kg⁻¹或mRNA–LNP剂量至2 mg kg⁻¹时,编辑效率也未显著下降(图3d和图3e)。作者还尝试通过共传递VPX mRNA来提高脱氧核糖核苷三磷酸水平,但未观察到编辑效率的提升(图3e)。
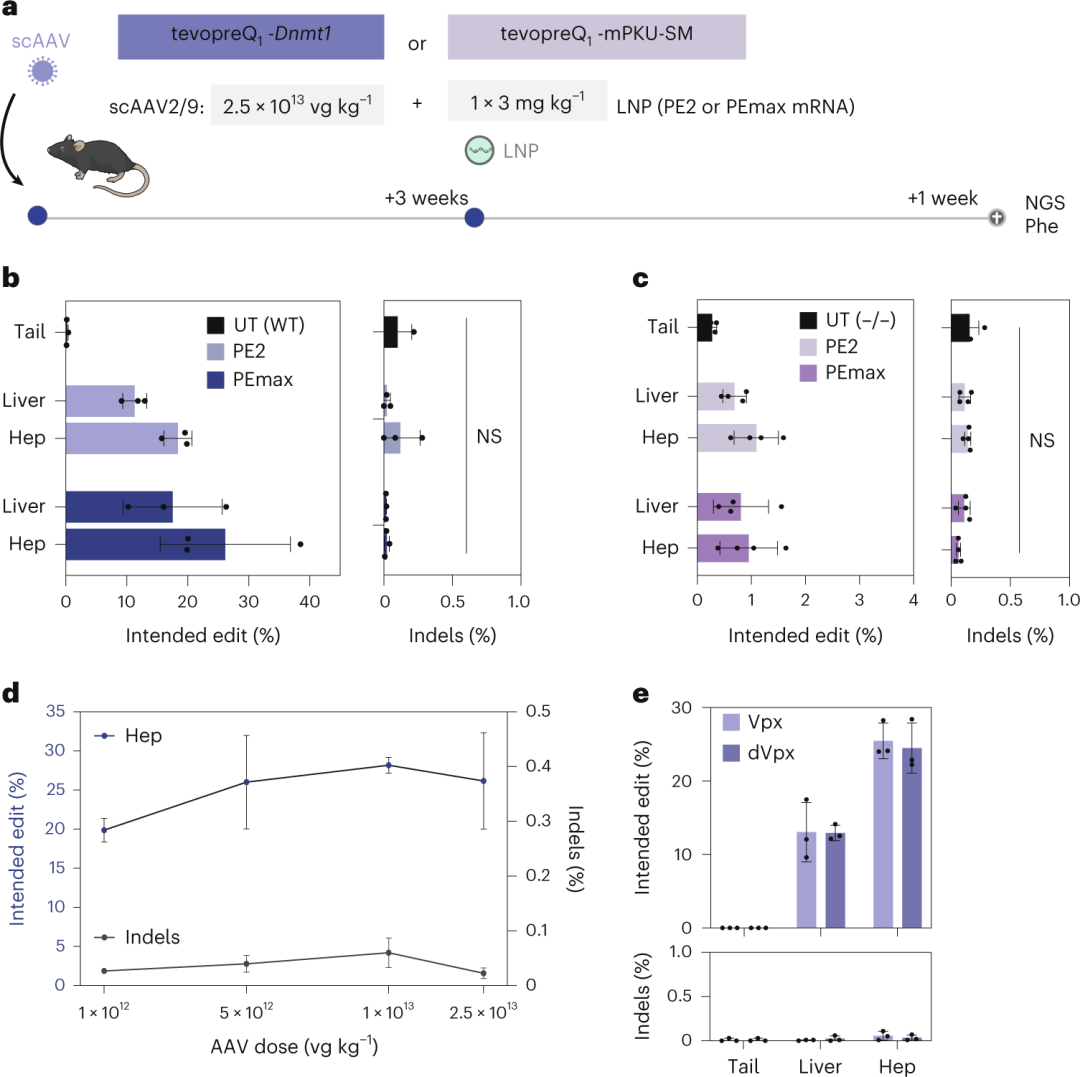
图3. 使用 pegRNA-AAV 和 PE mRNA-LNP 进行体内引物编辑
为了进一步提高Pah enu2位点的编辑率,作者对经过pegRNA-AAV预处理的PKU小鼠进行了三次2 mg kg⁻¹ mRNA–LNP的重新给药(图4a)。
结果显示,PE2的编辑率最高达到6.2%(平均2.9%),PEmax的编辑率最高达到8.7%(平均4.3%;图4b),成功将血液中Phe水平降低到600 µmol l⁻¹以下,并显著提高了肝脏中PAH酶的活性(图4c–e)。这表明,通过优化给药方案,Prime编辑在体内校正Pahenu2突变方面具有显著潜力。
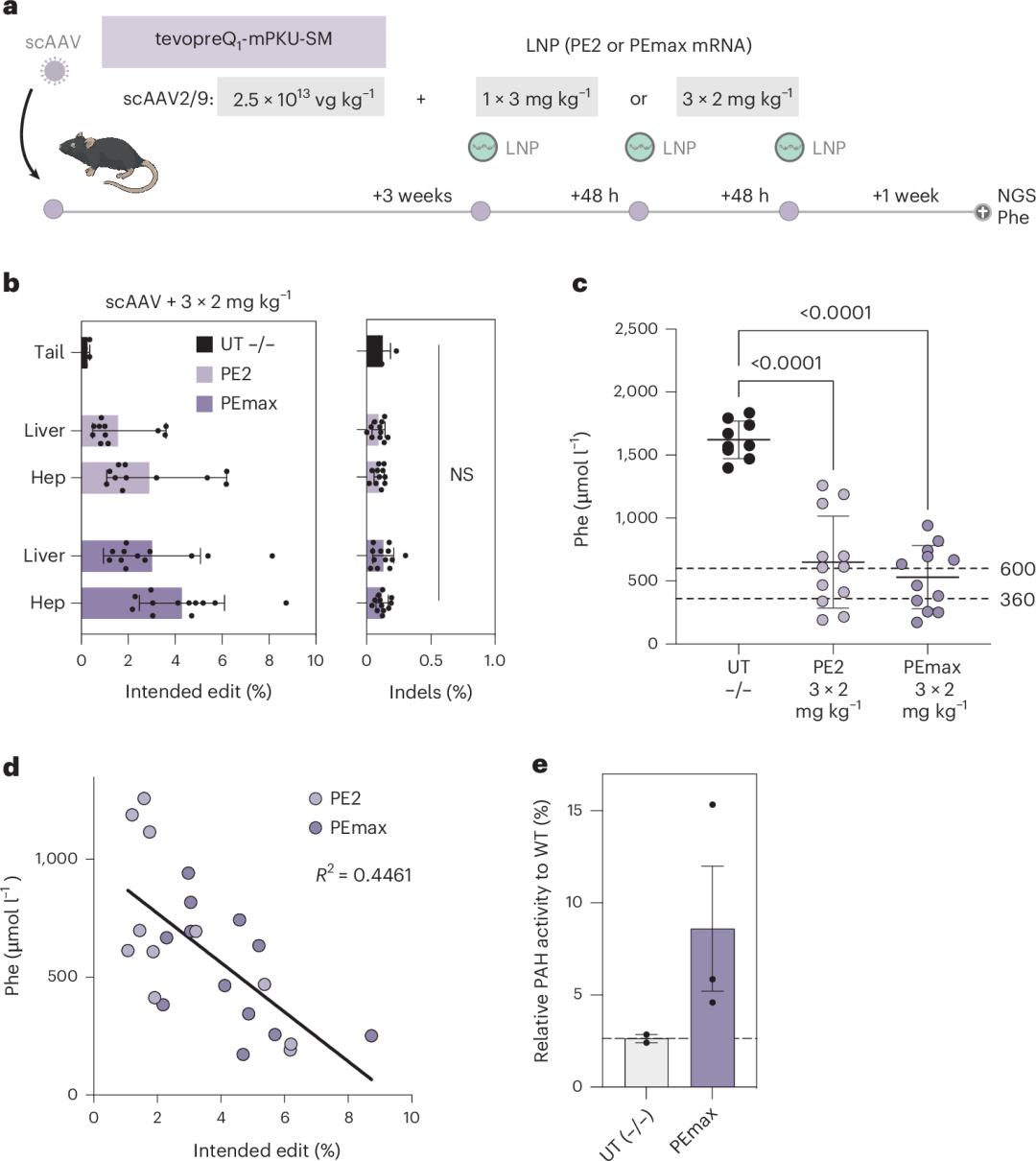
图4. 使用pegRNA-AAV和PEmax mRNA–LNP对Pahenu2小鼠进行体内校正
4. 使用PE7 mRNA–LNP进行Pahenu2小鼠的体内校正
为了将苯丙氨酸(Phe)水平降低至儿童和孕妇的安全阈值(360 µmol l⁻¹)以下,作者尝试通过设计新的pegRNA和使用新型PE7编辑器来提高Pahenu2等位基因的校正效率。尽管新的pegRNA在体外和体内实验中并未显著提高编辑效率,但PE7的使用显著提升了编辑效率。
在使用2.5×10¹³ vg kg⁻¹的scAAV2/9预处理后,PE7在Dnmt1位点实现了47.4%的编辑效率(图5a),在Pahenu2位点实现了20.7%的编辑效率(图5b),成功将Phe水平降低至360 µmol l⁻¹以下(图5c)。
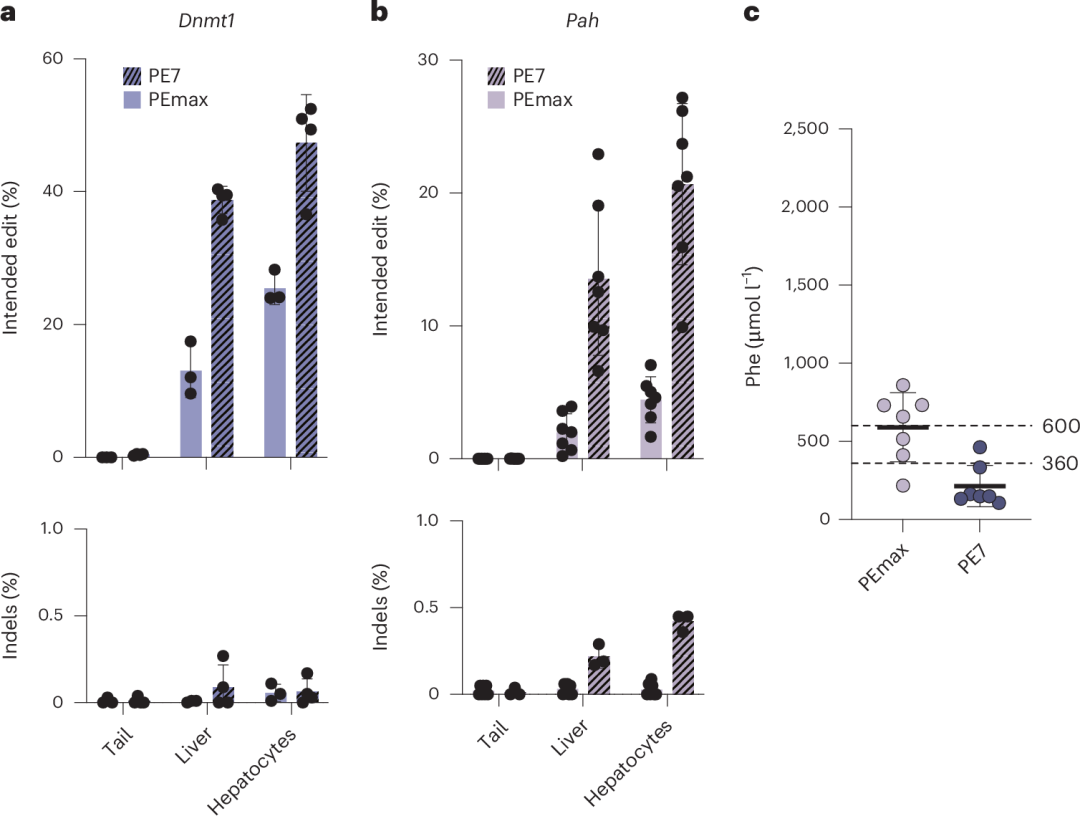
图5. 使用pegRNA-AAV和PE7 mRNA–LNP在Dnmt1位点进行体内Prime编辑及校正Pahenu2小鼠
进一步评估PE7在全RNA–LNP递送系统中的效果时,PE7 mRNA与合成的La可结合pegRNA联合使用。在Dnmt1位点,使用2 mg kg⁻¹ PE7 mRNA–LNP和2 mg kg⁻¹ pegRNA–LNP(两次给药,间隔5天)实现了35.9%的编辑效率(图6a),比PEmax的全RNA–LNP递送系统提高了3.4倍(图2f)。在Pah enu2位点,使用2 mg kg⁻¹ PE7 mRNA–LNP和2 mg kg⁻¹ pegRNA–LNP(三次给药,间隔5天)实现了8.0%的校正效率(图6b),显著高于PEmax的0.5%(图2d和图2f),并将Phe水平降低至342 µmol l⁻¹。
此外,作者还测试了PE7对其他11种常见PKU突变的编辑效率,发现其中8种突变的编辑效率高于Pah enu2突变(图6d),表明PE7 mRNA–LNP在PKU治疗中具有广阔的应用前景。
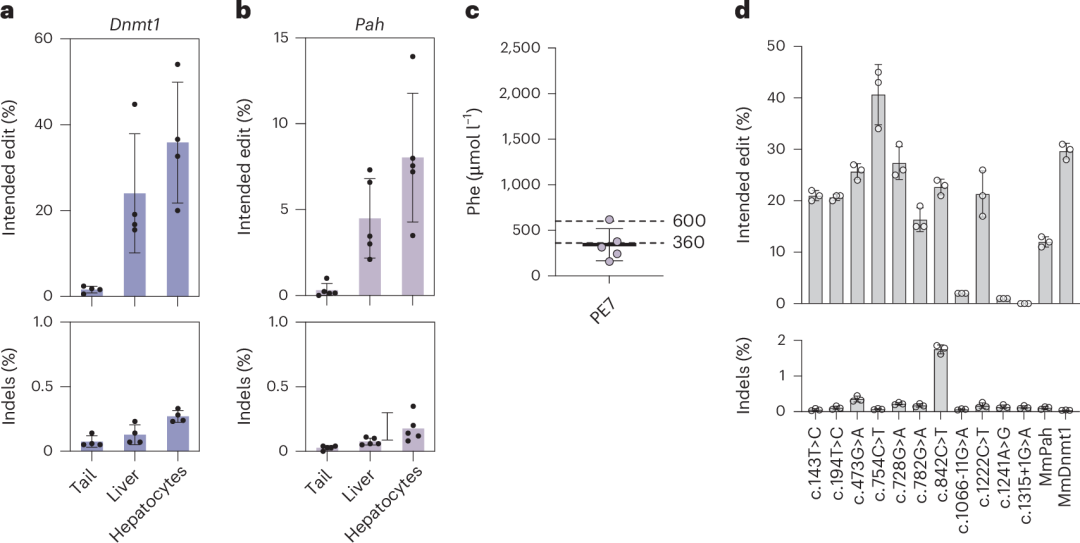
图6. 使用全RNA–LNP递送在Dnmt1位点进行体内Prime编辑及校正Pahenu2小鼠
5. Prime编辑未引起非靶标编辑或肝脏损伤
作者通过从不同器官分离DNA并利用NGS分析,评估了双AAV–LNP和全RNA–LNP方法的Prime编辑是否局限于肝脏。结果显示,在Pah enu2靶向或Dnmt1靶向的小鼠中,其他组织未观察到显著编辑(图7a、d)。进一步对两种pegRNA的前五个非靶标结合位点进行靶向扩增子测序,也未发现超出背景水平的编辑(图7b、c、e、f),表明Prime编辑具有较高的靶标特异性。
作者还检查了mRNA–LNP、pegRNA–LNP或pegRNA-AAV的递送是否引发肝脏毒性或免疫反应。结果显示,给予2 mg kg⁻¹的PE mRNA–LNP或pegRNA–LNP后6小时,ALT水平轻度升高,但在45小时或1周后恢复至基线(图7g、h)。促炎细胞因子(如MCP1和IFNγ)也仅出现短暂增加,随后恢复正常(图7i–l)。
此外,以2.5×10¹³ vg kg⁻¹剂量给予编码pegRNA的scAAV2/9时,未观察到ALT、AST或促炎细胞因子的显著增加(图7g–l)。组织学检查也未发现经处理小鼠肝脏有明显坏死迹象。这些结果表明,Prime编辑在体内应用中具有良好的安全性和耐受性。

图7. 评估接受pegRNA-AAV和mRNA–LNP治疗的小鼠的非靶标效应和肝脏毒性
结论
早期研究表明,通过病毒载体介导的Prime编辑器(PE)传递,可以在体内校正PKU小鼠模型。然而,编辑工具的长期表达给这些方法的临床应用带来了限制。碱基编辑技术虽然通常比Prime编辑更高效,但大多数致病性PKU突变无法通过当前的碱基编辑器进行靶向,因为这些突变不是转换点突变,或者在编辑窗口内存在额外的目标碱基,可能导致不良的旁观者突变。另一种可能的替代方法是使用AAV载体进行经典的基因添加疗法,将功能性Pah基因传递到肝细胞中。尽管这种方法在PKU小鼠中显著降低了苯丙氨酸(Phe)水平,但由于AAV载体的游离性质以及肝细胞在组织稳态和再生过程中的分裂,该方法可能无法提供永久性治愈。
在本研究中,作者开发了两种短暂的体内Prime编辑方法来纠正小鼠的PKU。最初,作者通过LNP将合成的pegRNA与PEmax mRNA一起传递到肝脏。在Dnmt1位点,这种方法在单剂量或两剂量的RNA–LNP后,分别在肝细胞中实现了3.5%和10.5%的编辑效率。然而,在Pahenu2位点,编辑效率显著较低(<0.5%),无法将Phe降低到治疗水平。
因此,作者测试了一种双AAV–LNP方法,即pegRNA通过AAV永久表达,而PE则通过mRNA–LNP短暂传递。这种方法显著提高了编辑效率,在Dnmt1位点单剂量mRNA–LNP后实现了26.2%的编辑,在Pah enu2位点三剂量mRNA–LNP后实现了4.3%的编辑。尽管Pah enu2位点的编辑率足以将Phe水平降低到成人治疗阈值(600 µmol l⁻¹)以下,但仍未达到儿童治疗阈值(360 µmol l⁻¹)。
这促使作者测试了新型PE7 PE变体,该变体将小RNA结合核酸酶保护因子La与逆转录酶融合,以进一步提高编辑率。使用PE7 mRNA–LNP的双AAV–LNP方法在Dnmt1位点单剂量后实现了47.4%的编辑,在Pah enu2位点三剂量后实现了20.7%的校正,足以将Phe水平降低到360 µmol l⁻¹以下。
在PEmax的全LNP方法中,作者使用了已经通过化学修饰在5′和3′端保护免受核酸酶降解的pegRNA。然而,这些修饰并不一定完全有效,Yan等人推测,除了保护免受核酸酶降解外,La还可以增强pegRNA的核保留,并促进pegRNA在Cas9上的装载。因此,作者测试了当PE7 mRNA与La可及的合成pegRNA共传递时,是否也能提高Prime编辑效率。值得注意的是,这种策略在Dnmt1位点两剂量RNA–LNP后实现了35.9%的编辑,在Pah enu2位点三剂量RNA–LNP后实现了8.0%的编辑,并将Phe水平降低到360 µmol l⁻¹以下。
总之,本研究提出了两种不同的肝脏短暂Prime编辑策略。在第一种方法中,pegRNA通过AAV永久表达,而PE通过mRNA–LNP短暂传递。在第二种方法中,pegRNA和PE mRNA都通过LNP短暂传递。尽管双AAV–LNP方法需要患者暴露于两种不同的传递载体,但在使用等量的mRNA–LNP时,它实现了显著更高的编辑效率。在Pah enu2 PKU小鼠模型中,全LNP方法中使用PE7实现了足够的校正效率,将Phe水平降低到治疗阈值以下,且在K562报告细胞系中比较Prime编辑效率表明,这种方法也可能对其他人类致病性PKU突变有效。鉴于这些结果,双AAV–LNP方法可能不是PKU的最佳选择。然而,对于需要更高编辑效率的遗传性疾病,双AAV–LNP方法可能是一个可行的替代方案。未来的研究将对确定这种双载体策略是否必要,或者全LNP方法是否可以进一步优化以提高编辑效率至关重要,从而扩大其对更广泛遗传性疾病的治疗潜力。
关于派真
作为一家专注于AAV 技术十余年,深耕基因治疗领域的CRO&CDMO,派真生物可提供从载体设计、构建到 AAV、慢病毒和 mRNA 服务的一站式解决方案。凭借深厚的技术实力、卓越的运营管理和高标准的服务交付,我们为全球客户提供一站式CMC解决方案,包括从早期概念验证、成药性评估到IIT、IND及BLA的各个阶段。
凭借我们独立知识产权的π-alphaTM 293 细胞AAV高产技术平台,我们能将AAV产量提高多至10倍,每批次产量可达1×10¹⁷vg,以满足多样化的商业化和临床项目需求。此外,我们定制化的mRNA和脂质纳米颗粒(LNP)产品及服务覆盖药物和疫苗开发的各个阶段,从研发到符合GMP的生产,提供端到端的一站式解决方案。