CAR-T细胞疗法作为一种革命性的治疗方式,已在多种血液系统肿瘤和实体瘤治疗中展现出显著疗效。然而,传统的CAR-T制备方法存在一些局限性:
- 随机整合风险:目前批准的产品都依赖逆转录病毒或慢病毒的半随机整合,可能导致插入性突变和继发性恶性肿瘤的风险;
- 功能不均一:随机整合位点导致CAR表达水平不一致,影响治疗效果;
- T细胞耗竭:传统方法制备的CAR-T细胞更容易出现耗竭标志物。
为了解决这些问题,科学家们开发了T细胞受体α链恒定区(T cell receptor alpha constant, TRAC)位点定向整合技术:利用CRISPR-Cas9在TRAC位点产生双链断裂,使用AAV载体或裸单链DNA(ssDNA)递送的CAR作为同源修复模板,实现CAR基因在TRAC位点的精准敲入。这种方法的优势在于:
- 表达均一:所有修饰细胞的CAR表达都由相同的内源性TCR启动子驱动;
- 功能增强:生成的CAR-T细胞功能更加均一;
- 耗竭减少:与传统逆转录病毒方法相比,T细胞耗竭标志物显著降低。
虽然TRAC位点定向整合技术前景广阔,但大部分研究都使用了AAV6载体来递送CAR。关键问题是:AAV6真的是T细胞基因编辑的最佳选择吗?
近期,来自澳大利亚悉尼大学的研究团队在《Molecular Therapy》杂志上发表了一项研究结果,通过开发TRAC-HR定向进化平台,成功筛选出两种新型AAV衣壳变体(AAV-T1和AAV-T2),它们在原代T细胞中的靶向基因编辑效率比传统AAV6高5倍,感染的T细胞在脑肿瘤细胞系中表现出更高的细胞毒性。

一、TRAC-HR平台
什么是TRAC-HR?
简单来说,TRAC-HR是一种革命性的AAV载体筛选系统,专为挑选能高效进行基因编辑的AAV载体而设计。它的名称中,”TRAC”指T细胞受体α恒定区基因座,”HR”则代表同源重组修复(Homologous Recombination)。
想象一下,传统筛选方法就像在大海中漫无目的地捞鱼,而TRAC-HR则是在海中精准投放了智能捕鱼网,专门捕获最优质的”鱼”——那些不仅能进入细胞,还能有效支持CRISPR-Cas9基因编辑的AAV变体。
TRAC-HR的工作原理是什么?
TRAC-HR的工作原理可以概括成精准筛选的“三步法“。
第一步:预选优质“选手“。面对数百万种可能的AAV变体(想象成数百万名应聘者),首先使用”功能转导(FT)平台”进行初筛,淘汰无法转导T细胞的变体。这一步就像简历筛选,迅速将候选人从数百万减少到数万,剔除那些完全无法转导目标细胞的变体。
第二步:精准评估实战能力。这一步是TRAC-HR平台的核心创新点,将初筛的优质“选手”转入TRAC-HR平台,进一步筛选支持基因编辑的变体。它不仅看AAV能否进入细胞,还要看它能否支持CRISPR-Cas9介导的基因敲入——这就像不仅测评应聘者能否到达工作地点,更要测试他们是否能完成核心任务。
第三步:多重验证,锁定精英。最后阶段,研究人员将表现最佳的变体进行高通量验证,并在多个供体的T细胞中测试,确保选出的AAV变体具有广泛适用性。
二、AAV-T1/T2的诞生过程
01 预筛选:先确定潜力骨架,再进行深度优化
传统AAV筛选往往从随机文库开始,但TRAC-HR平台采用了更加务实的方法:先找出有潜力的”种子选手”,再进行深度优化。研究人员首先对62种已知的AAV血清型进行了转导效率测试,筛选出在T细胞中转导效率较高的血清型,将可能的骨架从62种减少到AAV2、AAV6和AAV4这3种。
派真生物可提供上百种AAV血清型和变体,助力潜力骨架筛选。
02 双轨并行的文库设计策略
基于预筛选结果,研究人员设计了两种互补性的文库类型:
1)肽展示文库:局部优化策略
选择了预筛选中表现最佳的AAV2和AAV6作为骨架,在衣壳蛋白表面特定位点插入随机7肽序列,同时对7肽的编码序列进行了优化,使用了NNK7和VNS7两种简并密码子设计,避免了单一模板可能带来的偏倚,生成了约10⁹个不同的变体。这种设计的优势在于:保留原有骨架优势,通过表面修饰提高靶向性和功能。
2) DNA重排文库:全局优化策略
利用预筛选中表现优异的AAV4和AAV6,将两种血清型的衣壳基因片段进行DNA家族重组,生成约10⁶个嵌合变体。这种设计的优势在于:通过结构域交换创造全新特性,实现跨越式创新。
派真生物可提供随机多肽插入、DNA重排等多种文库设计服务。
03 筛选过程和结果
第一轮,通过使用FT平台进行初筛,将AAV2肽展示文库从约500万种变体缩减至1.1-1.5万种,AAV6肽展示文库缩减至2–2.5万种。
第二轮,将从mRNA中回收的衣壳基因分别克隆至TRAC-HR平台和FT平台,在三份不同供体来源的T细胞中进行并行筛选。
第三轮,分别合成AAV2与AAV6文库中第二轮FT和HR筛选排名前200的变体,共400种变体,在四份不同供体来源的T细胞中进行筛选,进一步评估两种筛选方法是否富集到相同的新型AAV变体(图1)。

图1.TRAC-HR筛选平台与筛选流程示意图。(a)第一轮筛选:在FT平台(3名T细胞供体)中进行;第二轮筛选:同时在FT平台和HR平台中进行(3名T细胞供体)。(b)最后一轮筛选及不同筛选方法严格性的同步验证:根据AAV2和AAV6肽库在FT-RNA与HR筛选中的NGS结果,合成并构建了一个包含200个最优AAV2变体与200个最优AAV6变体的混合文库(均来自FT-RNA和HR筛选),并将该文库分别克隆到FT和HR两个平台中进行验证。
FT平台的RNA回收数据显示,基于AAV2与AAV6的文库表现相当,其中新型载体AAV6.P20表现最强。相反,在HDR筛选中,基于AAV6的文库显著优于基于AAV2的文库,表现最佳的新型变体为AAV6.P05。这一结果表明:擅长基因表达的AAV变体与擅长基因编辑的AAV变体并不完全一致,表达优秀≠编辑优秀。
04 新进化和理性设计衣壳的功能验证
验证对象:AAV2肽插入文库中的9个衣壳+ AAV6肽插入文库中的14个衣壳+重组文库中的16个变体,此外,研究团队还利用已发表的衣壳基因信息,采用理性设计策略生成了具有嵌合VP1/2和包含VR-VIII肽插入位点的AAV6-VP3的新型衣壳变体。在对这些新型变体进行初步测试后,研究团队最终选择了23个最有前景的候选变体,其中包括4个AAV6肽变体、4个AAV4/6嵌合体、8个带肽插入的嵌合体,以及7个带肽插入和三重突变的嵌合体。
验证方法:首轮验证采用了条形码技术,同时评估了上述AAV变体在三个关键层面的表现。
- 细胞进入能力:多数新型变体表现优于或等同于AAV6,其中AAV6.P05、AAV4/6.15.P05(以下简称AAV-T2)、AAV4/6.15.P05.TM等变体在细胞附着/进入方面显著提升;
- 核转位效率:AAV6.P05和AAV-T2等变体显著提升;
- 基因表达水平:AAV6.P04和AAV4/6.15.P01(以下简称AAV-T1)等变体脱颖而出(图2)。
效能评估.png)
图2. 新型AAV衣壳在T细胞中的载体入胞、核转运、转基因表达及同源定向修复(HDR)效能评估。(A)产生图(B)数据的实验流程。(B)新型衣壳在总DNA、核DNA及转基因表达水平上的表现。(C)产生图(D)与(E)数据的实验流程。(D)代表性散点图显示在无或有25种衣壳AAV Kit 的情况下,RNP或mock电穿孔后TCRα与GFP的表达情况。(E)新型衣壳在HDR水平上的表现。总剂量:2,000 vg/cell;各衣壳剂量:80 vg/cell。所有结果均以AAV6为基准进行归一化,展示来自4位供体T细胞实验的中位值。
有趣的是,研究发现载体在细胞进入和基因表达方面的表现并不完全一致,提示不同步骤可能存在独立的优化潜力(图3)。
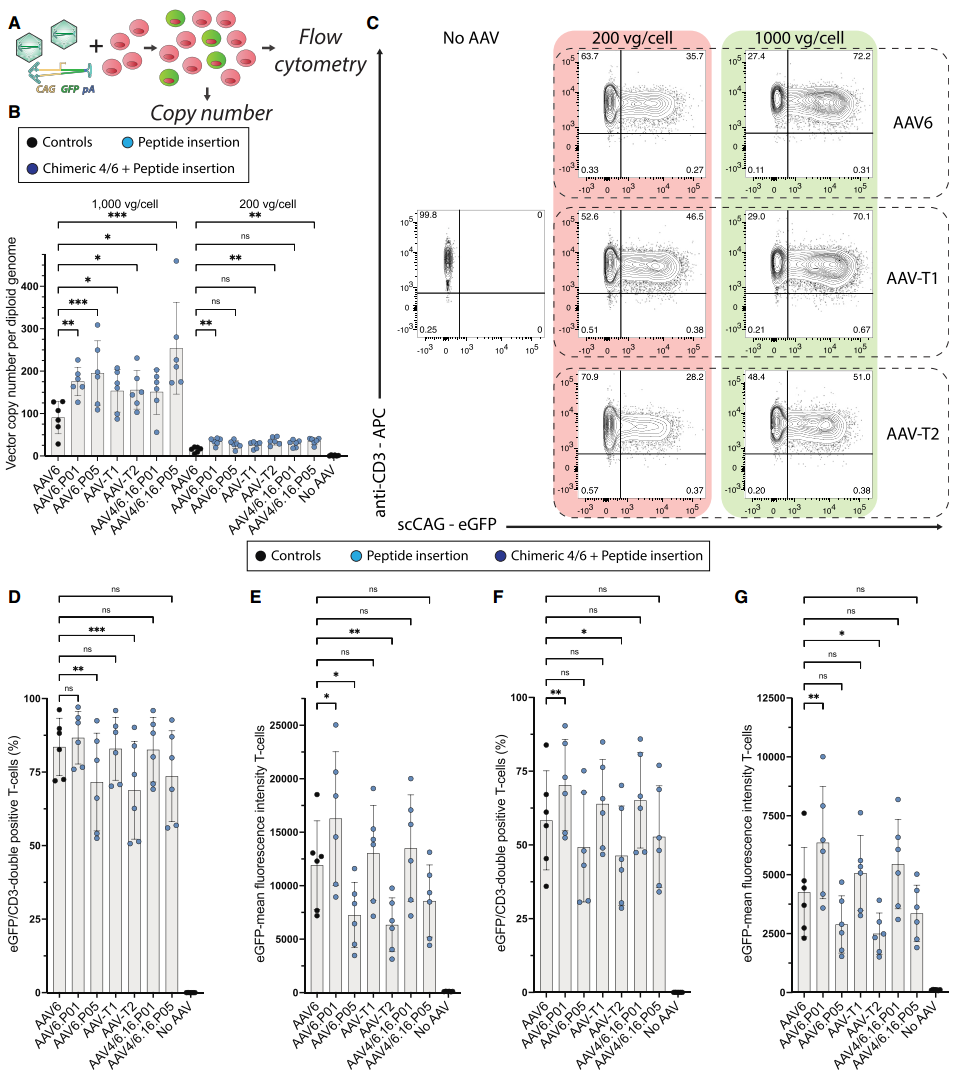
图3. 新型AAV衣壳在T细胞中的细胞进入和转基因表达的头对头比较。(A)产生所示数据的实验流程。(B)以所示剂量感染T细胞后,新型衣壳的载体拷贝数分析。(C)代表性散点图显示在缺乏或存在指定AAV衣壳变体时的CD3与GFP表达情况。(D)以1,000 vg/cell剂量感染后,eGFP⁺/CD3⁺双阳性T细胞的百分比。(E)以1,000 vg/cell剂量感染后,存活T细胞中eGFP的平均荧光强度。(F)以200 vg/cell剂量感染后,eGFP⁺/CD3⁺双阳性T细胞的百分比。(G)以200 vg/cell剂量感染后,存活T细胞中eGFP的平均荧光强度。
第二轮验证评估了上述AAV变体在T细胞基因编辑中的实际表现。通过使用TRAC同源臂包围的条形码eGFP表达盒以及严格对照证实eGFP表达确实来自靶向整合事件,发现AAV6.P05、AAV-T2等变体在靶向整合方面显著优于AAV6。
在最后的并行验证实验中,研究者发现携带P01肽的AAV4/5.16变体表现优于携带P05肽的AAV4/5.16变体,这与NGS结果相反。揭示了高通量筛选与实际应用间可能存在的差异。
进一步实验表明,与AAV6相比,AAV.P01、AAV-T1、AAV-T2和AAV4/6.16.P01介导的P2A-eGFP表达盒靶向敲入显著改善(图4),尽管某些变体(如含P05肽的变体AAV-T2)在基因表达方面可能不如传统载体,但它们在基因编辑应用中却表现出色,进一步证实了为特定应用目的开发专门优化的载体的重要性。
效能的头对头比较.png)
图4. 新型AAV衣壳在T细胞中同源定向修复(HDR)效能的头对头比较。(A)产生所示数据的实验流程。(B)代表性散点图显示在RNP或mock电穿孔后,在缺乏或存在AAV-T1的情况下,TCRα与GFP的表达情况。(C)以1,000 vg/cell剂量的指定AAV变体感染后,eGFP⁺/TCRα⁻ T 细胞的百分比。所有结果均来自6位供体T细胞的独立实验数据。
派真生物可提供各种条形码表达盒,助力AAV变体的高通量筛选。
三、AAV-T1/T2的优异性能
在CAR-T细胞的制备中,AAV-T1和T2仅需极低剂量即可高效完成靶向整合,且副作用更低,性能远胜传统AAV6。
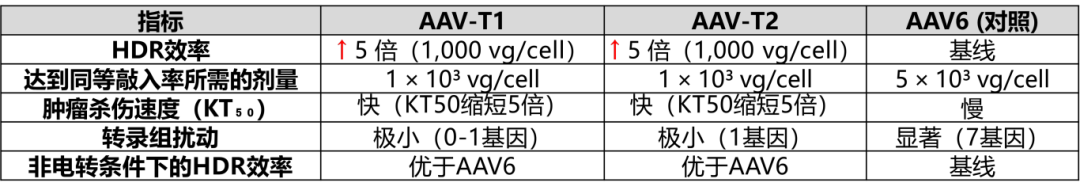
1. 载体效率提升
HDR效率(同源重组介导的CAR基因敲入):AAV-T1 和 AAV-T2 在TRAC基因座的靶向整合效率比传统 AAV6 提高 5倍。在 1,000 vg/cell 剂量下,AAV-T1/T2的敲入效率接近甚至超过 AAV6在5,000 vg/cell 的表现(图5C)。
病毒剂量降低:仅需 1/5剂量(1,000 vg/cell vs. 5,000 vg/cell)即可达到相同的CAR-T生成效率,显著降低病毒用量和潜在副作用。
2. 抗肿瘤活性
在弥漫内生性脑桥胶质瘤细胞(脑干胶质瘤模型)杀伤实验中,AAV-T1/T2生成的CAR-T细胞在 1,000 vg/cell 剂量下的肿瘤杀伤速度(KT50,半数杀伤时间)与 AAV6在5,000 vg/cell 相当(图6E、F)。
3. 转录组安全性
AAV-T1/T2处理的CAR-T细胞转录组扰动更小(仅0-1个显著差异基因),而AAV6组有7个基因显著改变(如CTLA4上调提示T细胞耗竭)。
4. 不依赖电穿孔的适用性
在无电穿孔条件下(使用A5K肽递送Cas9-RNP),AAV-T1仍比AAV6提升5倍HDR效率,AAV-T2也有1.5-2.5倍改善(图5C),证明其可兼容新型非电转系统。
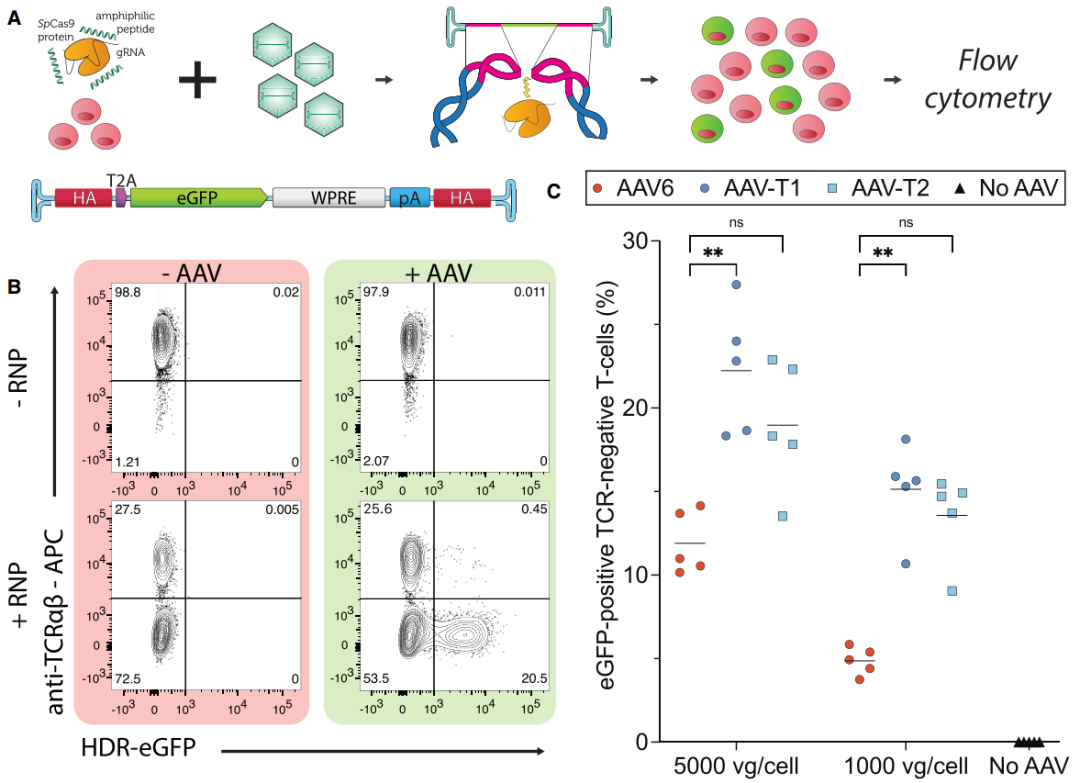
图5. 肽介导的Cas9/sgRNA递送实现T细胞无需电穿孔的体外基因编辑。(A)生成所示数据的实验流程。(B)散点图示例:显示在无电穿孔条件下,经肽-RNP或空白处理(mock)孵育后,T细胞中TCRα和GFP的表达情况;图中同时标注了是否加入AAV-T1。(C)在不同剂量AAV载体处理后,T细胞中eGFP阳性且TCRα阴性的百分比。所有结果均来自5位供体T细胞的独立实验。
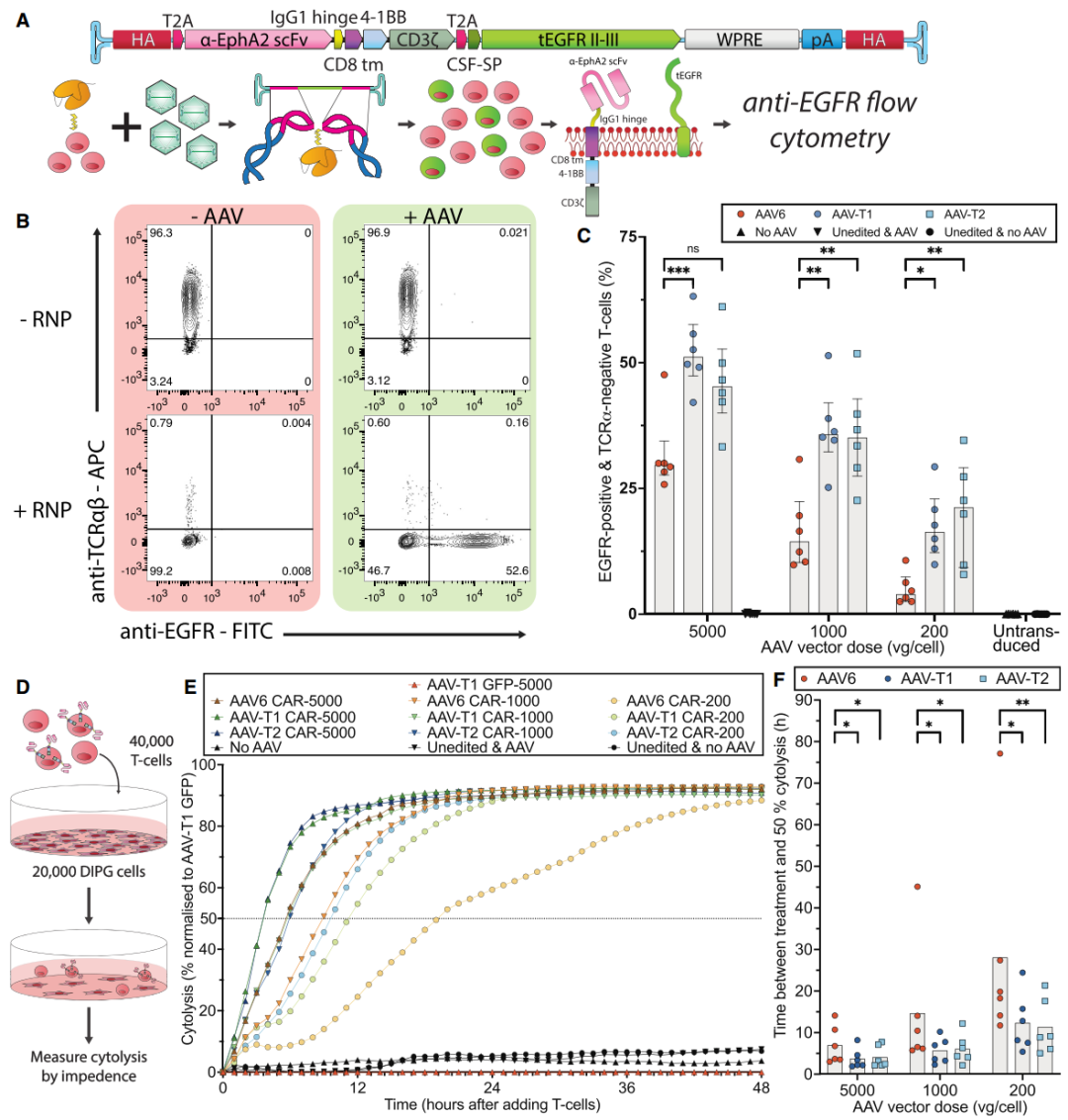
图6. 新型AAV衣壳在功能性CAR-T制备及肿瘤细胞杀伤方面优于AAV6。(A)同源臂侧翼的嵌合抗原受体(CAR)构建示意图,以及生成图(B)和(C)所示数据的实验流程。(B)代表性散点图:展示在有无RNP电穿孔或空白处理(mock)条件下,以及是否加入AAV-T1时,T细胞中TCRα和EGFR的表达情况。(C)在不同剂量AAV载体处理后,T细胞中EGFR阳性且TCRα阴性的百分比。结果来自6位供体T细胞的独立实验。(D)细胞溶解实验:利用xCelligence系统检测不同处理T细胞存在下,贴壁DIPG细胞的数量,生成图(E)和(F)所示数据。(E)细胞溶解百分比(以表达eGFP且TCRα阴性的T细胞处理条件下的细胞存活率为基准进行归一化)。结果展示6位供体T细胞独立实验的中位值。(F)从T细胞处理开始至达到50%细胞溶解所需的时间(KT50),对应不同AAV载体剂量及衣壳变体。结果来自6位供体T细胞的独立实验,柱状图显示中位值。
四、AAV-T1/T2将如何改变CAR-T产品的开发
总结与展望
AAV‑T1/T2的出现,为通用型CAR‑T带来了“更高效率+更低剂量+更好活性”的三赢局面。 如果您正在:
- 开发 TRAC‑CAR、TCR‑T或其他精准敲入型T细胞疗法;
- 希望降低 AAV 用量,缩短开发周期;
- 寻找可靠的载体设计与生产合作伙伴;
作为专业的基因治疗服务公司,我们的服务包括:
- 定制化载体设计:根据您的特定CAR结构和靶标细胞类型,我们提供优化的载体设计服务;
- 高效AAV包装:使用包括AAV-T1和AAV-T2在内的新型衣壳,提供高质量、高效率的病毒包装;
- 质量控制:全面的质控测试,确保病毒制品的纯度、效价和功能性;
- 技术支持:由经验丰富的科学家团队提供专业的技术咨询和支持;
我们致力于帮助您加速T细胞产品的研发进程,提高研发成功率,并最终为患者带来更加安全、有效的细胞治疗产品。
如果您正在开发T细胞产品,并希望了解更多关于这些新型AAV衣壳技术如何能够帮助您的项目,请与我们联系。我们期待与您合作,共同推动基因治疗领域的创新与发展。
参考资料:
Westhaus, A., et al. (2025). Tailoring capsid-directed evolution technology for improved AAV-mediated CAR-T generation. Molecular Therapy, 33(6), 2801-2820. https://doi.org/10.1016/j.ymthe.2024.12.012.
关于派真
作为一家专注于AAV 技术十余年,深耕基因治疗领域的CRO&CDMO,派真生物可提供从载体设计、构建到 AAV、慢病毒和 mRNA 服务的一站式解决方案。凭借深厚的技术实力、卓越的运营管理和高标准的服务交付,我们为全球客户提供一站式CMC解决方案,包括从早期概念验证、成药性评估到IIT、IND及BLA的各个阶段。
凭借我们独立知识产权的π-alphaTM 293 细胞AAV高产技术平台,我们能将AAV产量提高多至10倍,每批次产量可达1×10¹⁷vg,以满足多样化的商业化和临床项目需求。此外,我们定制化的mRNA和脂质纳米颗粒(LNP)产品及服务覆盖药物和疫苗开发的各个阶段,从研发到符合GMP的生产,提供端到端的一站式解决方案。