在基因治疗领域,从实验室到临床的转化之路充满挑战。最新研究表明,腺相关病毒(AAV)在不同物种间的表现存在显著差异,例如,能在特定小鼠品系中穿越血脑屏障的AAV-PHP.eB,在非人灵长类动物(NHP)中却丧失这一能力(Hordeaux et al., 2018; Matsuzaki et al., 2019)。这一发现凸显了跨物种测试的重要性(Tabebordba et al., 2021; Gonzalez et al., 2022),同时也意味着,为确保临床转化成功,必须在多种动物模型中进行严格验证。
为什么NHP动物模型对AAV研究至关重要?
NHP动物是指非人灵长类动物(Non-human primate),通常包括猴子、黑猩猩等,它们在生理、认知能力、神经解剖学、社会复杂性、繁殖和发育等方面与人类具有高度相似性,成为AAV评估的金标准模型。
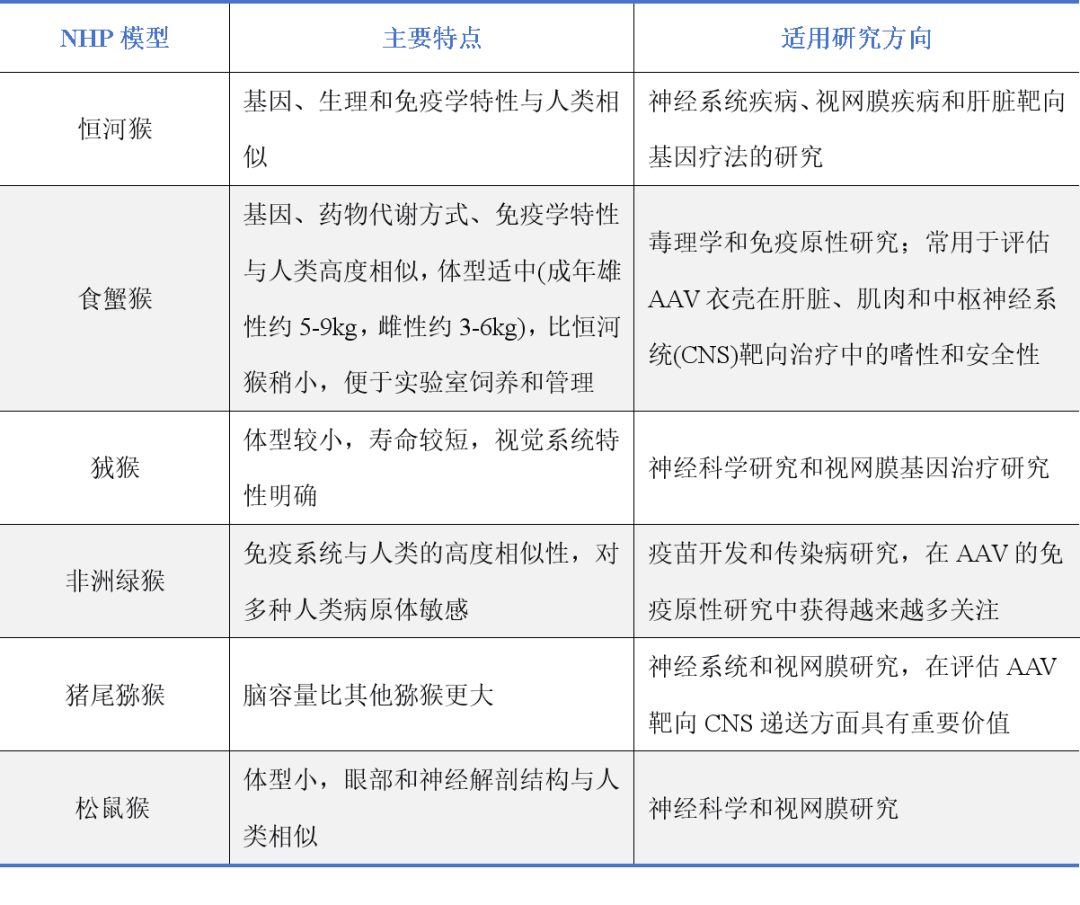
常用NHP模型及其应用特点
- 高内毒素可致命:有研究机构报告,使用高内毒素AAV导致NHP死亡案例。
- 肝毒性风险:低质量AAV可导致AST/ALT升高,影响实验可靠性。
- 免疫反应加剧:空壳率高会触发更强免疫反应,干扰治疗效果评估。
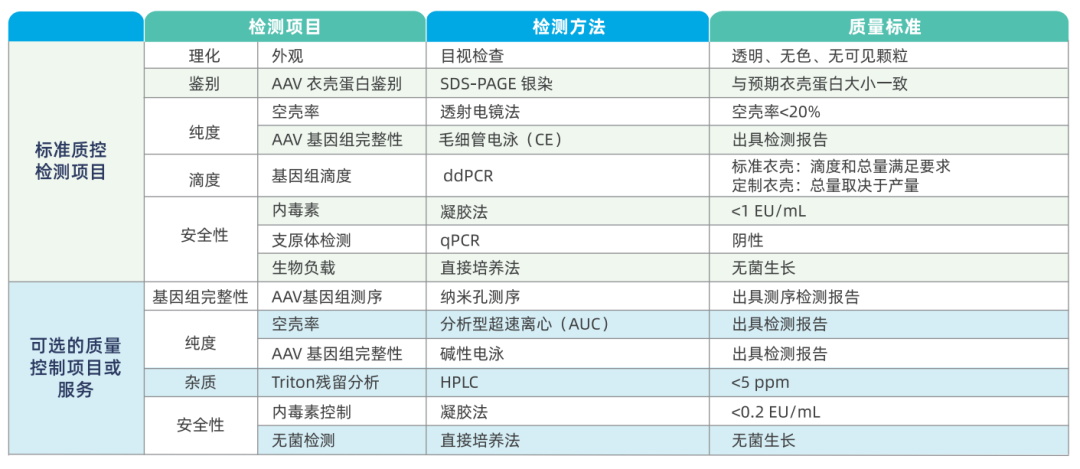
NHP级AAV的质量标准与优势
为解决上述挑战,专业NHP级AAV包装服务应满足以下关键标准:
1. 工艺稳定,产量高效
- 采用专利高产平台,满足大剂量需求
- 标准化生产流程,确保批次间一致性
- 内毒素严控:可低至<0.2EU/mL(远低于普通级别的10EU/mL)
- 空壳率精确控制:常规血清型<20%,可通过透射电镜和AUC方法双重验证
- 基因组完整性:可采用纳米孔测序和毛细管电泳检测
3.全面、准确、可靠的检测方法,确保产品质量
AAV在NHP动物的应用案例
2024年1月,暨南大学陈功/雷文亮团队发表的一篇题为《A nonhuman primate model with Alzheimer’s disease-like pathology induced by hippocampal overexpression of human tau》的文章,为AD研究带来了新突破。研究团队通过在非人灵长类动物(NHPs)中单次注射腺相关病毒(AAV),成功地过表达人类tau蛋白(图1),建立了AD病理模型,为研究AD的机制和开发治疗方法提供了新的可能性。
病毒工具:AAV9 hSyn::FLPo,AAV9 CAG::FRT-hTau
注射方式:脑立体定位注射至海马体
检测时间:注射后6-12周
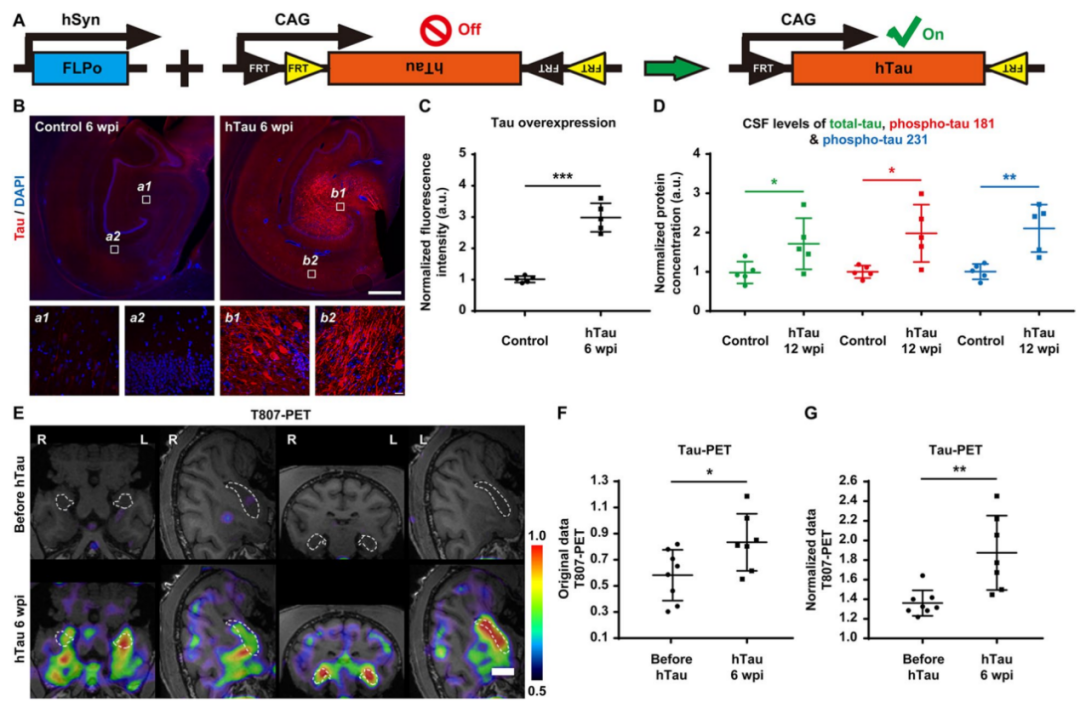
图1. 通过立体定向注射过表达hTau蛋白的AAV载体,使用免疫显色及PET/MRI成像等多种检测方法,检测结果显示AAV介导的基因转导效率约为75%,且在6至50周内保持稳定,表明AAV能够有效诱导tau蛋白的广泛且持久的表达。
2023年12月,复旦大学附属眼耳鼻喉科医院舒易来教授团队在Methods & Clinical Development在线发表题为《Preclinical evaluation of the efficacy and safety of AAV1-hOTOF in mice and nonhuman primates》的研究论文。
研究人员设计了一种双AAV载体递送的 OTOF 基因治疗剂,并在小鼠和猕猴中进行了系统的研究(图2),通过药效学、行为学和组织病理学评估了其在动物模型中的疗效和安全性。研究发现,AAV1-hOTOF 内耳输送显着改善了Otof−/−小鼠的听力,且不影响野生型小鼠的正常听力。AAV1 主要分布于耳蜗,在小鼠的肝脏等部位中未观察到AAV1-hOTOF 的明显毒性作用。
为了进一步评价Myo15启动子驱动的 AAV1-转基因的安全性,AAV1-GFP 通过圆窗膜递送到猕猴的内耳,在离体器官中检测到AAV1-GFP,未检测到显着的不良反应。这些结果表明,AAV1-hOTOF 在动物中具有良好的耐受性和有效性,为其临床转化提供了关键支持。
病毒血清型:AAV1
启动子:Myo15
动物模型:小鼠、猕猴
注射方式:圆窗膜注射
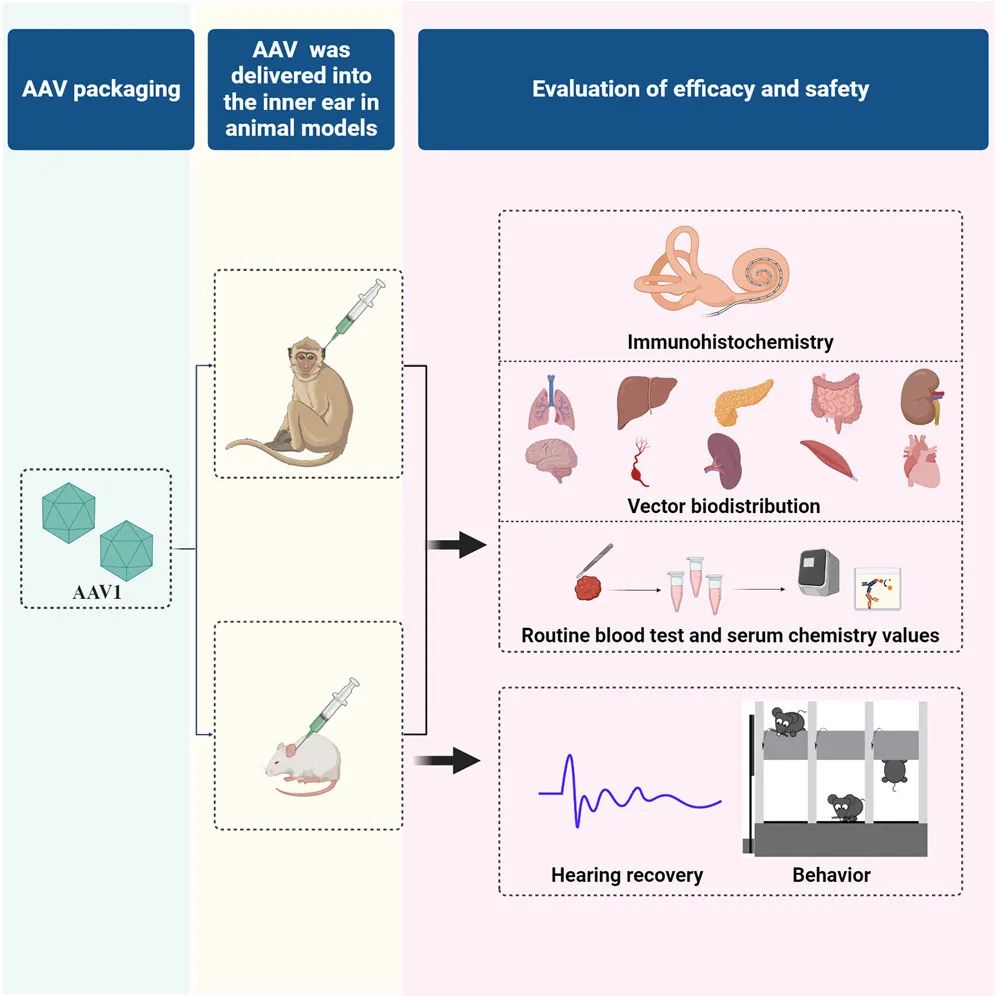
图2.AAV1-hOTOF在动物模型中的研究思路
客户证言
——昆明动物所某课题组
——中科院研究员
派真NHP级AAV产品
优质AAV包装与严格的质量控制:专为非人类灵长类动物和大型动物研究设计
参考文献
[1]Tabebordbar M, Lagerborg KA, Stanton A, King EM, Ye S, Tellez L, et al. Directed evolution of a family of AAV capsid variants enabling potent muscle-directed gene delivery across species. Cell 2021;184:4919-4938.e22.
[2]Gonzalez TJ, Simon KE, Blondel LO, Fanous MM, Roger AL, Maysonet MS, et al. Cross-species evolution of a highly potent AAV variant for therapeutic gene transfer and genome editing. Nat Commun 2022;13:5947.
[3]Hordeaux J, Wang Q, Katz N, Buza EL, Bell P, Wilson JM. The Neurotropic Properties of AAV-PHP.B Are Limited to C57BL/6J Mice. Mol Ther 2018;26:664-8.
[4]Matsuzaki Y, Tanaka M, Hakoda S, Masuda T, Miyata R, Konno A, et al. Neurotropic Properties of AAV-PHP.B Are Shared among Diverse Inbred Strains of Mice. Mol Ther 2019;27:700–4.
关于派真
作为一家专注于AAV 技术十余年,深耕基因治疗领域的CRO&CDMO,派真生物可提供从载体设计、构建到 AAV、慢病毒和 mRNA 服务的一站式解决方案。凭借深厚的技术实力、卓越的运营管理和高标准的服务交付,我们为全球客户提供一站式CMC解决方案,包括从早期概念验证、成药性评估到IIT、IND及BLA的各个阶段。
凭借我们独立知识产权的π-alphaTM 293 细胞AAV高产技术平台,我们能将AAV产量提高多至10倍,每批次产量可达1×10¹⁷vg,以满足多样化的商业化和临床项目需求。此外,我们定制化的mRNA和脂质纳米颗粒(LNP)产品及服务覆盖药物和疫苗开发的各个阶段,从研发到符合GMP的生产,提供端到端的一站式解决方案。