
“我在派真生物做了科研级质粒和病毒包装,现在想直接用于临床试验,这可行吗?”
“我的科研质粒中包含了WPRE元件,可以用于临床试验吗?“
“我的质粒载体只用了第一代测序来确定序列,用于临床时需要用第二代或第三代测序吗?”
这些是我们经常遇到的客户疑问。作为基因治疗服务提供商,我们深知科研级质粒与临床级质粒之间存在显著差异,而这些差异直接关系到基因治疗产品的安全性、有效性和监管合规性。本文将详细解析科研质粒与临床级质粒的区别,并为您提供从科研级向临床级过渡的路径建议。
01、为何科研质粒不能直接用于临床?
临床级质粒主要用于支持临床前安全性评价、研究者发起的临床研究(IIT)和新药临床试验申报(IND)。它被视为一种关键的“起始物料”,其生产过程必须在严格的质量管理体系(如GMP)下进行,以确保最终产品的安全性、有效性和批次间的一致性。
科研质粒和临床质粒的核心差异对比:
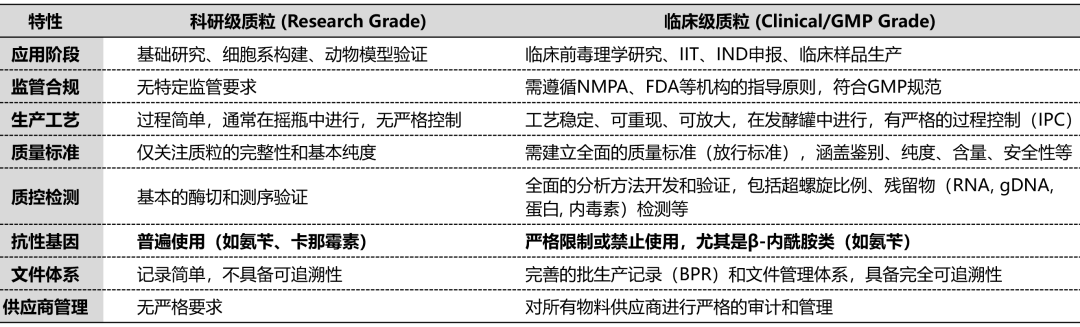
02、三大“高频问题”与监管期望
监管关注的是什么? 主要是β‑内酰胺过敏/交叉污染风险与抗性基因传播风险;因此避免 β‑内酰胺类(如 AmpR)是各监管共识(NMPA 明确建议避免;FDA 较早的基因/细胞治疗通用指导也建议避免使用 β‑内酰胺,并尽量不用临床上广泛使用的抗性标记)1。
可选路径:
① 更换为非 β‑内酰胺抗性(如 KanR 等)并建立抗生素残留清除与成品中无抗性序列的证明路径;
② 无抗筛选(如无抗发酵、代谢缺陷互补、操纵子/阻遏子滴定、RNA‑OUT 等)以从源头消除抗生素使用与残留关注。
2)启动子/调控序列:必须换成“上过临床”的么?
没有“白名单”,强调的是“可解释性与可控性”。EMA 明确:载体/表达盒的转录调控元件(如组织/时间特异启动子)应提供表征证据来证明所声称的特异性;DNA 元件选择要有科学论证。因此,“研究用”标签本身不是监管否决的理由,但来源清晰、机制可解释、风险可控的序列(以及已有临床先例者)更易通过。
此外,CDE明确指出,土拨鼠肝炎病毒转录后调节元件(woodchuck hepatitis post-transcriptional regulatory element, WPRE)包含土拨鼠肝炎病毒X蛋白相关序列,具有潜在致肝癌风险,建议在不影响元件正常功能的情况下对其进行改构2。
常见策略:
① 沿用有充分人用经验的启动子(如 CMV 增强子/β‑肌动蛋白混合启动子等)或经典的组织特异启动子(眼科、肝脏、肌肉等领域已较成熟)(如下表);
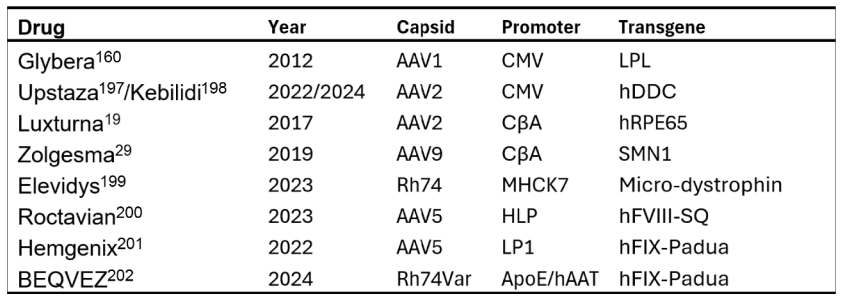
已上市的AAV基因治疗药物中用到的启动子3:
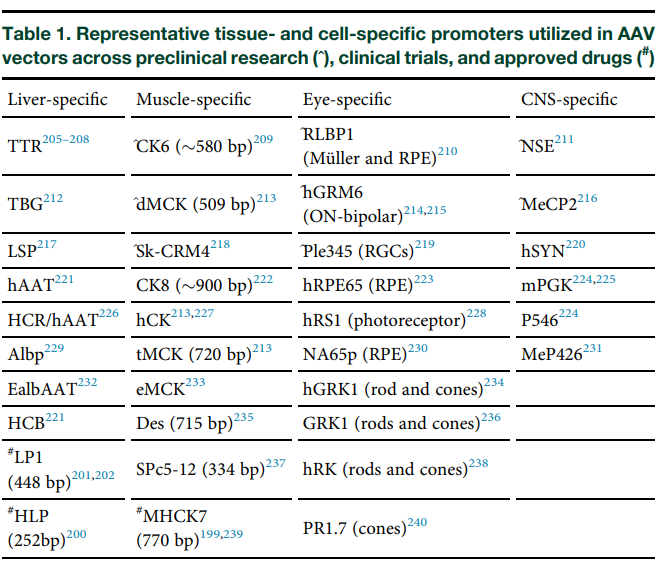
AAV载体中用到的组织和细胞特异性启动子3:
③ 应避免或替换含有潜在致瘤/转录激活风险的元件2。
3)质粒序列确认:只有一代行吗?还需要用二代或三代吗?
监管要的是“完整、准确、可验证”,而不是限定平台。FDA/EMA 均要求提供完整注释序列,并说明测序方法;FDA 对用于微生物载体或病毒载体≤40–50 kb 的构建,建议提供全序列并注释 ORF/其它序列4。
实践做法:
① Sanger测序方法准确性更好,二代测序(next generation sequencing, NGS)方法具有更高通量和灵敏度。由于两者在应用于载体全基因组序列测定时各具优缺点,可采用2种分析方法进行交叉确认。
② 方法学验证/适用性:按 ICH Q2(R2) 的原则对准确度、特异性、检测限/定量限、耐用性做验证或适用性确认,并在 IND/IMPD申请文件中描述方法与接受标准5。
03、把科研质粒“转正”的落地路线图
1. 序列与功能界定(sequence freeze)
明确标注 GOI、ORF、UTR、polyA、启动子/增强子等;
输出注释序列(GenBank 格式)与功能说明书(含每段序列来源与论证)。
2. 抗性标记整改
首选非β‑内酰胺标记或无抗筛选;如历史原因保留,需完成清除验证与残留检测设计。
3. 启动子与调控元件论证
选择临床有先例/文献成熟者更稳妥;若用新型/合成启动子,补齐表达特异性证据。
4. 测序与结构确认包
短读+长读策略,ITR/重复区做Sanger/酶切图谱交叉复核;提交方法学验证/适用性摘要。
5. 开发和建立临床级生产工艺 (Process Development):
建立符合GMP要求的主细胞库(MCB)和工作细胞库(WCB)。
开发稳定、可放大的发酵和纯化工艺,并建立严格的过程控制点(IPC)。
对生产过程中使用的所有原辅料进行严格的供应商审计和质量控制。
6. 建立全面的质量分析体系 (QC System):
开发并验证一系列高度灵敏的分析方法,用于精确检测质粒的超螺旋比例、浓度、纯度以及各种工艺相关残留(宿主蛋白、基因组DNA、RNA、内毒素等)。
04、常见问题解答
A: 科研质粒含有氨苄青霉素抗性基因、实验用标签等不适合人体应用的元件,且生产工艺不符合GMP要求,内毒素和杂质水平可能超标,直接使用将带来安全风险并难以获得监管批准。
Q2: 从科研质粒升级到临床级质粒需要多长时间?
A: 通常需要3-6个月,包括质粒重新设计、构建、工艺开发和质量验证。具体时间取决于载体复杂性和监管要求。
Q3: 临床级质粒的成本为何高于科研质粒?
A: 临床级质粒需要GMP生产环境、严格的质量控制、全面的文档体系和法规符合性评估,这些都大幅增加了生产成本。
专业的事,请交给专业的伙伴!
从实验室的一个想法到真正能够造福患者的药品,是一条漫长而严谨的道路。质粒作为这条路上的第一个关键节点,其质量直接决定了后续研发的成败和最终产品的安全。
在派真生物,我们深刻理解这一过程的复杂性和重要性。我们不仅能提供高质量的科研级质粒制备服务,更能凭借我们符合GMP标准的生产平台和完善的质量管理体系,为您提供从质粒设计优化到临床级生产的一站式解决方案,帮助您平稳、高效地完成从“科研”到“临床”的关键跨越,让您的创新成果更快地走向临床,惠及更多患者。
参考资料
1. https://www.ccfdie.org/en/fgflf/webinfo/2024/12/1732613149973704.htm
2. https://mp.weixin.qq.com/s?__biz=MzUxNTM5MDcwMA==&mid=2247588089&idx=1&sn=ac4a810fb48dd0fc8cc9138a4d7e5e5e&chksm=f863ca0e5487a0a59ae36c83adf73e90e7ab0cf090f3c01955d23ef57da7a95c24f86b5fac4d&scene=27
3. Suarez-Amaran, L., Song, L., Tretiakova, A. P., Mikhail, S. A., & Samulski, R. J. (2025). AAV vector development, back to the future. Mol Ther, 33(5), 1903-1936. doi: 10.1016/j.ymthe.2025.03.064
4.https://www.fda.gov/files/vaccines%2C%20blood%20%26%20biologics/published/Recommendations-for-Microbial-Vectors-Used-for-Gene-Therapy–Guidance-for-Industry.pdf
5. https://www.ema.europa.eu/en/documents/scientific-guideline/guideline-quality-non-clinical-clinical-requirements-investigational-advanced-therapy-medicinal-products-clinical-trials_en.pdf
关于派真
作为一家专注于AAV 技术十余年,深耕基因治疗领域的CRO&CDMO,派真生物可提供从载体设计、构建到 AAV、慢病毒和 mRNA 服务的一站式解决方案。凭借深厚的技术实力、卓越的运营管理和高标准的服务交付,我们为全球客户提供一站式CMC解决方案,包括从早期概念验证、成药性评估到IIT、IND及BLA的各个阶段。
凭借我们独立知识产权的π-alphaTM 293 细胞AAV高产技术平台,我们能将AAV产量提高多至10倍,每批次产量可达1×10¹⁷vg,以满足多样化的商业化和临床项目需求。此外,我们定制化的mRNA和脂质纳米颗粒(LNP)产品及服务覆盖药物和疫苗开发的各个阶段,从研发到符合GMP的生产,提供端到端的一站式解决方案。



