据估计,全球约15%的夫妇面临不孕不育问题,其中相当比例与遗传性生殖系统功能障碍相关。传统治疗手段(激素替代、辅助生殖技术)主要针对症状管理,而基因治疗有望从分子水平纠正致病机制。腺相关病毒(AAV)因其低免疫原性、长期表达特性和极低的基因组整合风险(<1%),已成为生殖系统基因递送的优选载体。
一、AAV生殖系统基因递送策略
在生殖系统疾病研究中,AAV的应用效果离不开三个关键选择:血清型、启动子和注射方式。不同组合的搭配,直接决定了基因递送的效率和特异性。
1. 血清型的选择
AAV的血清型由衣壳蛋白决定,不同血清型对生殖系统细胞的亲和力差异显著。
AAVDJ:对睾丸细胞转导效率高。在Lhcgr基因缺陷小鼠模型中,AAVDJ对睾丸间质祖细胞的转导效率远超传统的AAV8(图1)。此外,AAVDJ也可以穿透透明带,高效感染体外培养的受精卵[1]。
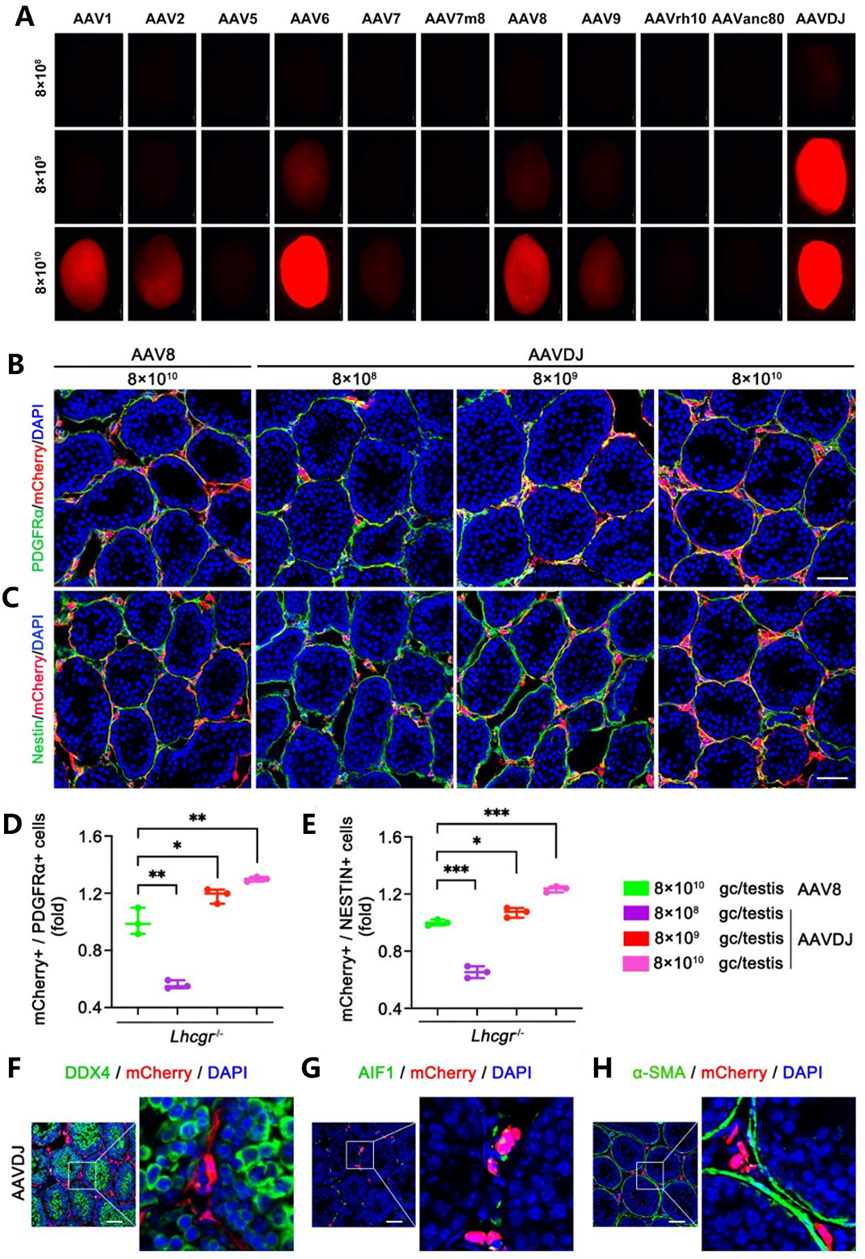
图1 AAVDJ对睾丸细胞显示出最高的转染效率。 (A) 野生型小鼠睾丸在分别注射表达mCherry的不同衣壳(1、2、5、6、7、7m8、8、9、rh10、anc80和DJ)的AAV后7天的宏观外观,剂量分别为8×10⁸、8×10⁹和8×10¹0gc/睾丸。(B-C) 向 Lhcgr-/- 小鼠睾丸分别递增剂量注射 AAVDJ-mCherry(8×10⁸、8×10⁹ 和 8×1010 gc/睾丸)或 AAV8-mCherry(8×1010 gc/睾丸)后,睾丸切片的代表性共聚焦图像。注射后 7 天收取睾丸组织,并用 Leydig 祖细胞标志物(PDGFRα、Nestin)进行免疫染色(n=3)。(C-D) 病毒转导率 = mCherry⁺ 细胞数 ÷ PDGFRα⁺ 或 Nestin⁺ Leydig 祖细胞数。(E-G) 注射 AAVDJ-mCherry(8×1010 gc/睾丸)后 7 天,对睾丸进行免疫染色,分别标记生殖细胞标志物 DDX4(F)、巨噬细胞标志物 AIF1(G)以及管周肌样细胞标志物 α-SMA(H)(n=3)。细胞核用 DAPI 复染[2]。
AAV9:生殖系统中的广谱血清型。在卵巢中,AAV9能穿透卵巢间质和卵泡基底膜,感染颗粒细胞(图2) ;在睾丸中,将AAV9显微注射到生精小管后,病毒能够穿透基底膜和血睾屏障(BTB),转导支持细胞、精原干细胞(SSCs)、管周细胞和间质细胞(图3)。
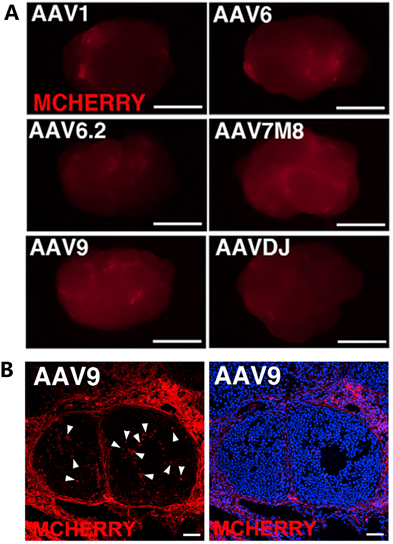
图2 不同血清型AAV对小鼠卵巢的感染效率。(A) 显微注射到小鼠卵巢中。注射后7天,在紫外灯下观察卵巢,所有注射的卵巢均出现荧光信号,但强度不一。(B)AAV9在颗粒细胞中的信号最强[3]。
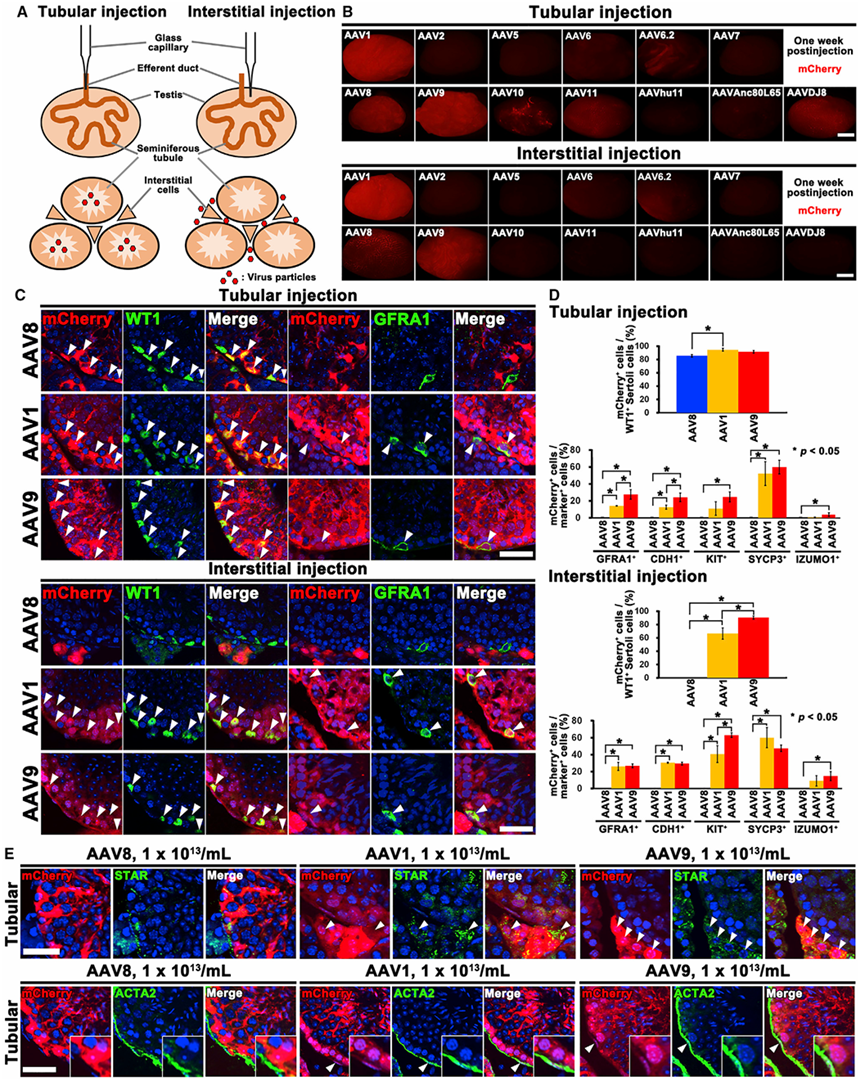
图3 不同AAV血清型对小鼠睾丸的感染效果。(A) 注射途径示意图。(B) 显微注射表达mCherry的AAV后1周,野生型小鼠睾丸的宏观外观。(C) 注射AAV1、AAV8或AAV9-mCherry后1周,对睾丸进行免疫染色,检测未分化精原细胞(GFRA1)和支持细胞(WT1)标志物。箭头指示被AAV感染的目标细胞。(D) 免疫染色定量分析。从3个不同睾丸中各选取3条小管,分别统计小管内和小管间注射的效果。(E) 注射AAV1或AAV9-mCherry后1周,对睾丸进行STAR或ACTA2免疫染色。箭头指示被AAV感染的目标细胞[4]。
AAV6:胚胎基因递送的优选血清型。研究发现,AAV6能够通过扩散方式跨越透明带,无需显微注射即可实现对着床前胚胎的高效转导,简化了胚胎基因递送操作流程。此外,向怀孕母鼠输卵管腔注射AAV6,可有效转导被透明带包裹的着床前胚胎(图4)。
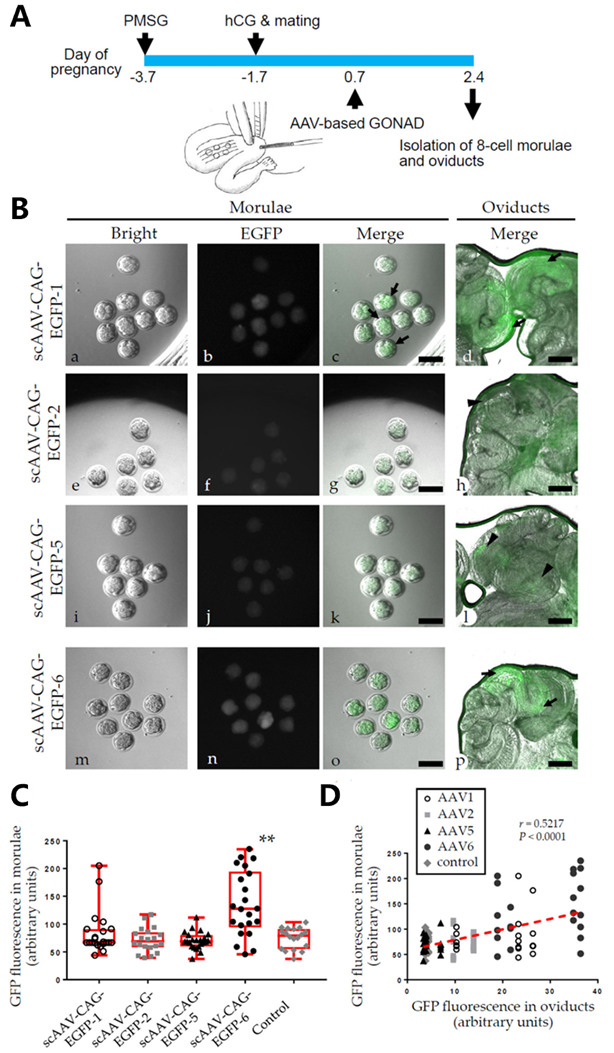
图4 rAAV-1、-2、-5 和 -6 对小鼠胚胎及输卵管的嗜性。(A) 实验流程示意图。B6C3F1雌鼠先经孕马血清促性腺激素(PMSG)和人绒毛膜促性腺激素(hCG)超排处理,次日与雄鼠合笼,早晨检查阴道栓。见栓者视为怀孕,于妊娠第0.7天(晚合子期)接受AAV-GONAD操作。至第2.4天,取桑葚胚和输卵管进行EGFP荧光观察。(B) 采用 scAAV-CAG-EGFP-1、-2、-5 和 -6 在 B6C3F1 孕鼠进行 AAV-GONAD 后 2 天,观察桑葚胚(a–c、e–g、i–k、m–o)和输卵管(d、h、l、p)的荧光。Bright:白光照片;EGFP:蓝光激发照片;Merge:白光与蓝光叠加。 (C) 不同血清型 rAAV 处理后的单个桑葚胚 GFP 表达定量。Kruskal–Wallis 检验结合 Dunn 多重比较显示,scAAV-CAG-EGFP-6 组与对照组差异显著(**p < 0.005)。(D) 单个桑葚胚平均 GFP 表达水平与对应输卵管表达水平的相关性分析。胚胎与输卵管上皮转导效率呈中等程度相关(Pearson 相关系数 r = 0.5217,p < 0.0001)。红色线为拟合直线[5]。
其它血清型:AAV1在睾丸支持细胞和精原干细胞中具有一定转导能力[4],在受精卵和胚胎也具有较高的转导能力[1];AAV8虽能靶向睾丸间质细胞,但效率低于AAVDJ和AAV9。
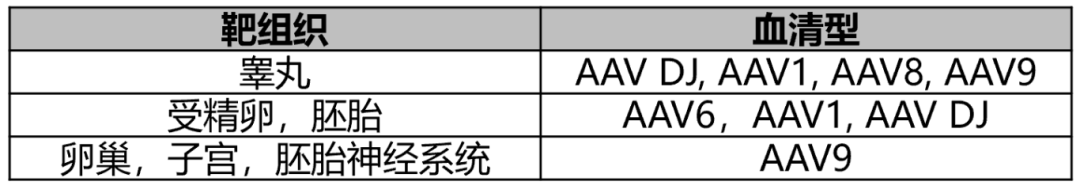
表1 生殖系统疾病研究常用的AAV血清型总结
2. 启动子:让基因在“正确的细胞”中表达
启动子是决定基因表达特异性的“开关”,特异性启动子可以实现基因在特定组织或细胞中高效特异性表达。虽然已有部分组织特异性启动子可用(如Amh、Star启动子),但其表达强度通常弱于广谱启动子。因此,结合局部注射与强启动子(CAG、EF1α、CMV等)仍是AAV在生殖系统研究中目前最有效的策略。
3. 注射方式和剂量
生殖系统具有复杂的结构屏障,如睾丸的血-睾屏障,卵巢的间质和卵泡基底膜,传统的全身给药难以让AAV到达目标细胞。因此,局部精准注射是生殖系统AAV应用的关键。
常用的注射方式包括:
睾丸局部注射:睾丸间质注射(图5),直接将AAV注射到睾丸间质空间,适用于靶向间质细胞(如治疗睾酮缺乏症)。例如,在Lhcgr缺陷小鼠模型中,通过间质注射AAVDJ-Lhcgr,能快速恢复间质细胞功能,提升睾酮水平[2]。生精小管注射,通过输出小管将AAV注入生精小管内,可靶向支持细胞(图6)。
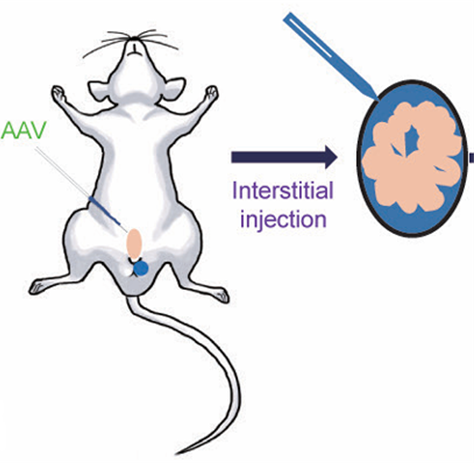
图5 小鼠睾丸间质注射示意图[6]。
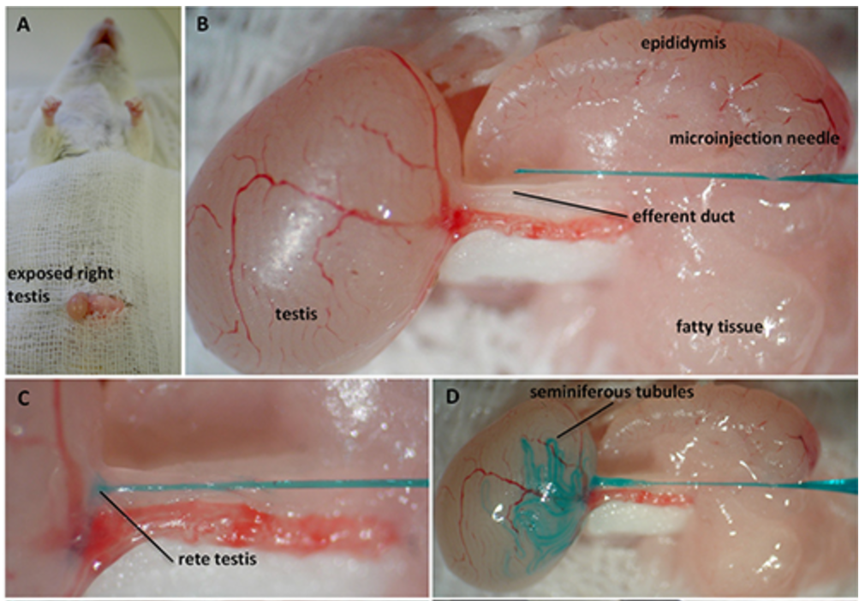
图6 小鼠生精小管注射。对已麻醉小鼠开腹,切口位于包皮腺正上方(A)。显露睾丸后,将其与腹部脂肪垫分离(B)。在双目镜下找到并剔除附睾脂肪,将微注射针置于附睾管旁,针尖朝向输出小管(C)。把玻璃毛细管插入输出小管,并顺势推进至睾丸,使其尖端直达睾丸网(D)。借助 Fast Green 实时监测 DNA 注入及生精小管充盈情况[7]。
卵巢局部注射:卵巢间质注射,适用于靶向颗粒细胞和卵泡膜细胞(图7)。
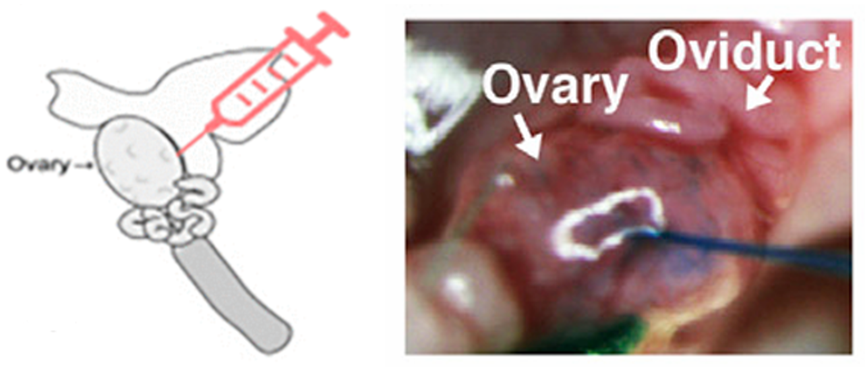
图7 卵巢显微注射示意图[4,8]。
输卵管原位注射:在妊娠早期,将AAV注入输卵管lumen,可实现早期胚胎的原位感染,避免了胚胎体外操作的复杂流程,提高了基因治疗的效率[5]。
宫腔内注射:将AAV直接注入子宫腔内,该方式可使病毒精准作用于子宫内膜组织 [9]。
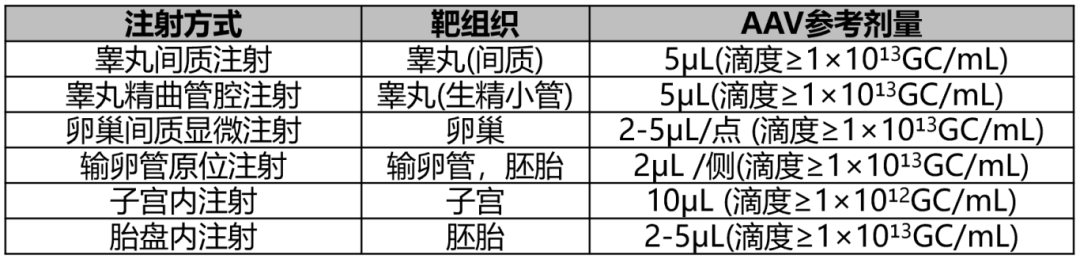
表2 不同注射方式的作用区域和AAV参考剂量(以小鼠为例)
二、典型应用案例
1. 雄性不育的基因治疗
Lhcgr 基因缺陷是导致男性间质细胞功能衰竭(LCF)的重要原因,患者表现为睾酮缺乏、生精障碍和不育。传统的睾酮替代治疗会抑制下丘脑-垂体-性腺轴,进一步加重不育。
发表在《Cell Proliferation》杂志上面的一篇文章“AAV-mediated gene therapy restores natural fertility and improves physical function in the Lhcgr-deficient mouse model of Leydig cell failure”中,研究团队构建了 AAVDJ-Lhcgr 载体,通过睾丸间质注射给药。结果显示,治疗后小鼠血清睾酮水平达到野生型小鼠的60%(图8);生精小管直径显著增大,精子数量和活力恢复至正常水平,且精子能正常受精; 80%的治疗小鼠能通过自然交配产生健康后代,且后代基因组中未检测到AAV整合,证明了其安全性[2]。
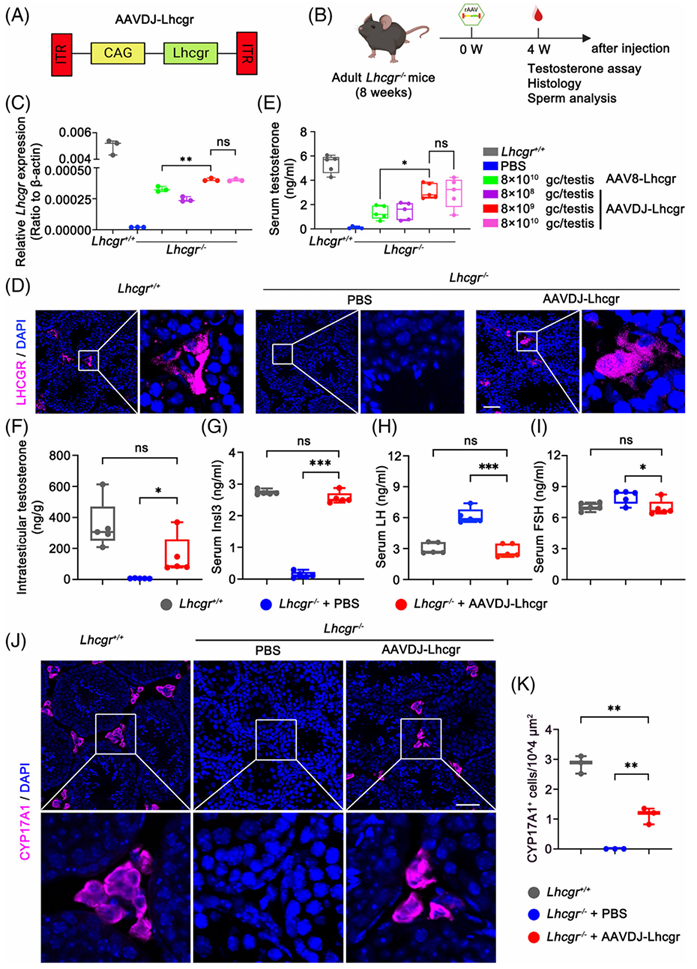
图8 AAVDJ-Lhcgr可恢复Lhcgr敲除小鼠中的Lhcgr表达和睾酮水平[2]。
2. 先天性不孕的基因治疗
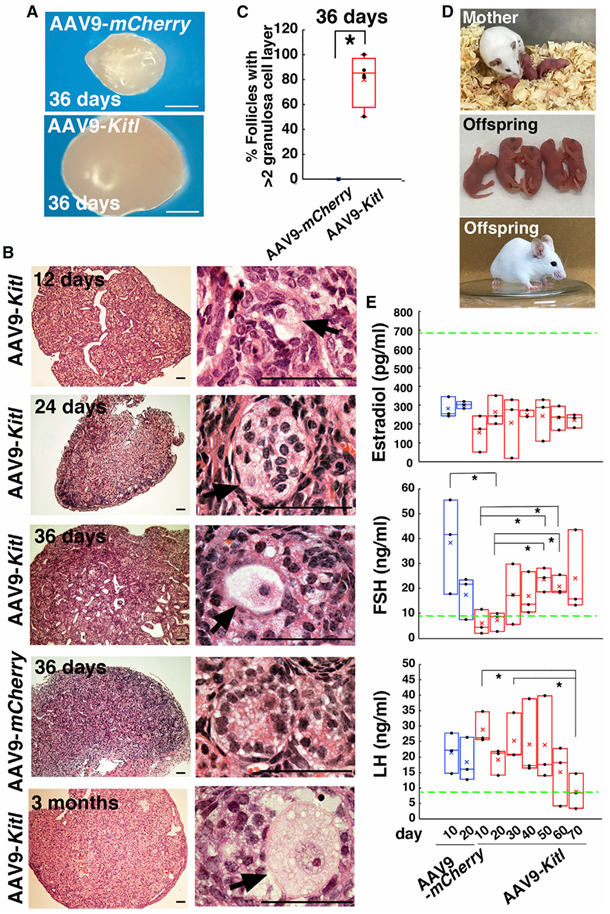
图9 AAV9-Kitl 感染挽救 Kitl SI-t/Kitl SI-t突变小鼠的不育。(A) 与 (B) 注射 AAV9-Kitl 后 Kitl SI-t/Kitl SI-t小鼠卵巢的外观 (A) 与组织学 (B);箭头示生长中的卵母细胞。(C) 具有两层颗粒细胞的卵泡计数 (n = 8 个卵巢)。(D) AAV9-Kitl 注射后出生的子代。(E) AAV9-Kitl 感染后 Kitl SI-t/Kitl SI-t突变小鼠外周血激素水平[3]。
3. 生殖系统肿瘤的基因治疗
前列腺癌是男性常见恶性肿瘤,其进展常伴随抑癌基因maspin的下调,导致肿瘤细胞凋亡抑制、血管生成增加,传统治疗(如雄激素剥夺疗法)响应期有限且易复发,急需新型高效治疗手段。
发表在《Human Gene Therapy》杂志上的文章 “Adeno-Associated Virus 2-Mediated Intratumoral Prostate Cancer Gene Therapy: Long-Term Maspin Expression Efficiently Suppresses Tumor Growth” 中,研究团队构建了AAV2-maspin、AAV2-LacZ(对照)、AAV2-GFP(报告)三种AAV2载体,通过裸鼠前列腺癌移植瘤瘤内注射给药(每肿瘤注射 1×10¹⁰GC病毒,100μL)。结果显示,maspin表达持续且高效,AAV2-maspin治疗组肿瘤内maspin蛋白在注射后10天可检测到,28天达峰值并维持至56天,部分肿瘤112天仍有表达;肿瘤细胞凋亡显著增强,LNCaP和DU145移植瘤中凋亡细胞数量是 AAV2-LacZ组的3-10倍,maspin阳性细胞中凋亡比例显著高于GFP阳性细胞;血管生成被有效抑制,治疗组肿瘤CD31阳性微血管密度较对照组降低40%以上;肿瘤生长与存活改善,LNCaP和DU145移植瘤体积显著小于对照,15% LNCaP肿瘤、8% DU145肿瘤完全消失,治疗组小鼠存活期较对照组延长约45-60天,且无明显毒性,证明了其有效性与安全性(图10)。
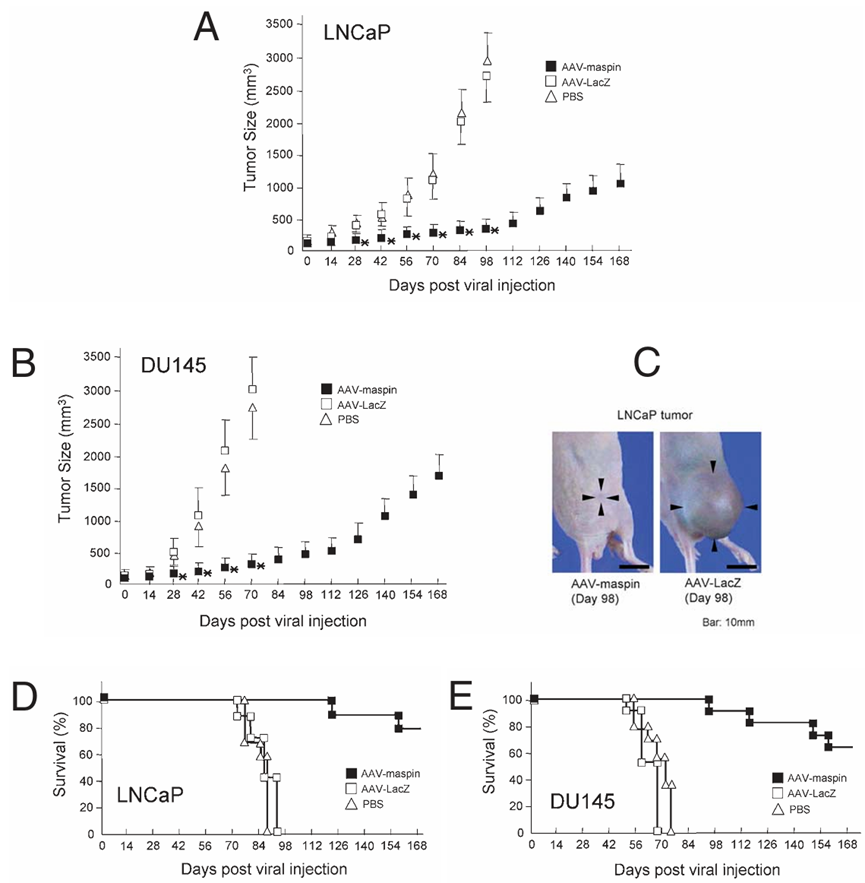
图10 AAV2-maspin在前列腺癌小鼠模型中抑制肿瘤生长,延长荷瘤小鼠的生存期[10]。
三、总结与展望
从恢复小鼠的自然生育能力,到抑制生殖系统肿瘤生长,AAV以其独特的优势,在生殖系统基因治疗领域展现出巨大潜力。随着血清型改造、启动子优化和注射技术的不断进步,我们有理由相信,AAV可以为更多不孕不育患者和生殖系统疾病患者带来希望,推动生殖健康领域进入“精准基因治疗时代”。
派真生物拥有完整的AAV载体研发与生产技术平台,可为您提供从载体设计、衣壳工程、质粒构建到病毒包装的一站式服务,助力生殖系统疾病研究。
[5] Sato M, et al. Direct injection of recombinant AAV-containing solution into the oviductal lumen of pregnant mice caused in situ infection of both preimplantation embryos and oviductal epithelium. Int J Mol Sci. 2022;23:4897.
[6] Pang J, et al. Targeted gene silencing in mouse testicular Sertoli and Leydig cells using adeno-associated virus vectors .Asian Journal of Andrology. 2025; 27: 627–637.
[7] Michaelis M, Sobczak A, Weitzel JM. In vivo microinjection and electroporation of mouse testis. J Vis Exp. 2014 Aug 23;(90):51802.
[8] Cozzolino M, Ergun Y, Seli DA, Herraiz S. Intraovarian PRP injection improves oocyte quality and early embryo development in mouse models of chemotherapy-induced diminished ovarian reserve. Aging (Albany NY). 2024 Sep 13; 16:12123-12137 .
[9] Song M, Zhao G, Sun H, et al. circPTPN12/miR-21–5p/∆Np63α pathway contributes to human endometrial fibrosis. eLife. 2021;10:e65735.
[10] Watanabe M, et al. Adeno-associated virus 2-mediated intratumoral prostate cancer gene therapy: Long-term maspin expression efficiently suppresses tumor growth. Hum Gene Ther. 2005;16:699-710.
关于派真
作为一家专注于AAV 技术十余年,深耕基因治疗领域的CRO&CDMO,派真生物可提供从载体设计、构建到 AAV、慢病毒和 mRNA 服务的一站式解决方案。凭借深厚的技术实力、卓越的运营管理和高标准的服务交付,我们为全球客户提供一站式CMC解决方案,包括从早期概念验证、成药性评估到IIT、IND及BLA的各个阶段。
凭借我们独立知识产权的π-alphaTM 293 细胞AAV高产技术平台,我们能将AAV产量提高多至10倍,每批次产量可达1×10¹⁷vg,以满足多样化的商业化和临床项目需求。此外,我们定制化的mRNA和脂质纳米颗粒(LNP)产品及服务覆盖药物和疫苗开发的各个阶段,从研发到符合GMP的生产,提供端到端的一站式解决方案。