一、研究亮点
- AI赋能蛋白质工程:利用AlphaFold2系统性设计ProAPOBECs变体,突破了传统APOBEC3A的序列偏好限制,实现GC、CC、AC、UC等多种序列背景下的高效C-to-U编辑,编辑窗口可达2-5个核苷酸。
- 体内高效编辑:单AAV即可递送,在小鼠肝脏和大脑实现了近50%的RNA编辑效率,显著改善疾病表型,无DNA脱靶效应。
- 应用广泛:成功编辑神经发育障碍、神经退行性疾病、代谢疾病、ALS、视网膜色素变性等多种疾病相关突变。
二、主要研究结果
研究团队首先对CU-REWIRE3.0(由 10 重复 PUF 结构域(PUF10)与胞嘧啶脱氨酶 APOBEC3A 融合而成)中的PUF10域进行结构优化,在第4个重复序列(R4)中插入亮氨酸-脯氨酸(LP)肽段,构建了增强型PUF10(ePUF10),开发出CU-REWIRE4.0系统。CU-REWIRE4.0蛋白表达量显著高于3.0版本,对EGFP mRNA C459位点的编辑效率从69.7%提升至82.3%,无一脱靶位点位于 ePUF10 结合序列下游 20 nt 范围内,表明 ePUF10 的靶向精度高,其依赖的脱靶编辑极少。
2. 基于结构的APOBEC3A优化最小化脱靶效应
为降低APOBEC3A的二聚化和RNA非特异性结合,研究团队基于晶体结构分析,确定了影响二聚化的关键位点(H11、C171)和参与 RNA 识别的残基(K30、H56)。通过在这些位点引入点突变,构建了多个 CU-REWIRE4 变体并在 HEK293T 细胞中评估其编辑效率与脱靶情况。结果显示,携带 C171A 突变的 CU-REWIRE 4.1 在保持高编辑效率的同时显著降低脱靶;而N 端结构域(NTD)突变体(4.2、4.4、4.5)虽编辑效率中等,但将脱靶降至最低。靶向/脱靶比分析表明,经改造的变体具有更优的编辑特异性,可根据不同应用需求灵活选择。改造后的变体仍保持对 UC 基序的偏好性,反映了 APOBEC3A 的内在序列特异性。
3. AI辅助工程化构建ProAPOBECs蛋白库
研究团队利用AlphaFold2分析了1160个真核生物AID/APOBEC家族基因,发现脱氨酶核心结构域高度保守,而NTD和C 端结构域(CTD)具有进化可塑性。
研究团队将不同 APOBEC 核心脱氨酶与人 APOBEC3A 的 NTD/CTD 拼接,构建出一系列”专业版 APOBEC”(ProAPOBECs)。经结构预测后,将 ProAPOBEC-C171A 突变体与 ePUF10 融合,开发出 CU-REWIRE5 系统(5.1–5.17 版本)。表达分析显示,绝大多数 CU-REWIRE5 变体(CU5s)在 HEK293T 细胞中稳定表达,并对 EGFP mRNA 的 C459 位点表现出不同程度的编辑活性。
4. ProAPOBECs显著扩展RNA编辑的序列范围
为系统评估 CU5 系列的序列偏好,研究团队在 EGFP mRNA 上将 U458C459 替换为 GC、CC、AC 进行测试。结果显示,多种 CU5 编辑器均能突破 UC 限制,在不同序列背景下实现 C→U 转换。其中,CU5.7/5.13 保持 UC 偏好,CU5.16 偏好 AC,CU5.1/5.8(携带人 APOBEC1/APOBEC3H 脱氨酶结构域)可高效编辑 GC 或 AC,CU5.15(小鼠 APOBEC3)偏好 CC 或 UC,而 CU5.3/5.17(小鼠/大鼠 APOBEC1)可编辑任意 NC 环境,堪称”广谱”编辑器。
RNA-seq 评估显示,CU5.1、5.17、5.16 的脱靶率高于 CU4.1,且活性越高的 CU5 脱靶位点越多,提示需在编辑效率与特异性间平衡。
5. 体外验证疾病相关位点编辑能力
研究团队系统评估了三种 CU5 变体的编辑窗口特征。CU5.1(GC 偏好)在ePUF10 结合位点下游第 2 或第 4 核苷酸(nt)处对 GC 基序的编辑效率最高,成功将致病性 APOE4/3 转化为保护型 APOE2(约 90% 效率),并高效编辑 ALS 相关 SOD1 突变和视网膜色素变性相关视紫红质突变(约 85% 效率),而传统 xCBE 在 APOE 位点无活性。
CU5.15(CC 偏好)编辑窗口为下游 2-4 nt,成功编辑 MEF2C 和 PCSK9 突变位点。CU5.17(NC 广谱)编辑窗口为下游 2-5 nt,可高效编辑神经发育障碍相关 DDX3X 突变。三种变体均具备明确可预测的编辑窗口,为精准治疗性 RNA 编辑提供了可靠工具。
6. 小鼠肝脏体内RNA编辑显著降低胆固醇水平
为验证体内应用价值,研究团队靶向 Pcsk9 以降低心血管疾病风险。携带大熊猫源 ProAPOBEC 的 CU5.21 在小鼠 Pcsk9 C832AG 位点的编辑效率达 96%,远超 CU4.1(37%)和传统编辑器 CURE/xCBE。免疫荧光显示其主要定位于细胞质,体外测序未检出基因组 C→T 突变。
用AAV8 递送 CU5.21 至小鼠肝脏,4 周后 Pcsk9 mRNA 降低超 70%,血清 PCSK9 蛋白及总胆固醇显著下降,小鼠生长正常(图1)。转录组水平仅检出约 400 个 C→U 事件,体内基因组测序未检出 C→T 突变。以上结果表明,CU5.21 可在体内高效、精准地编辑 Pcsk9,脱靶效应极低,为治疗性 RNA 编辑提供了安全有效的平台。
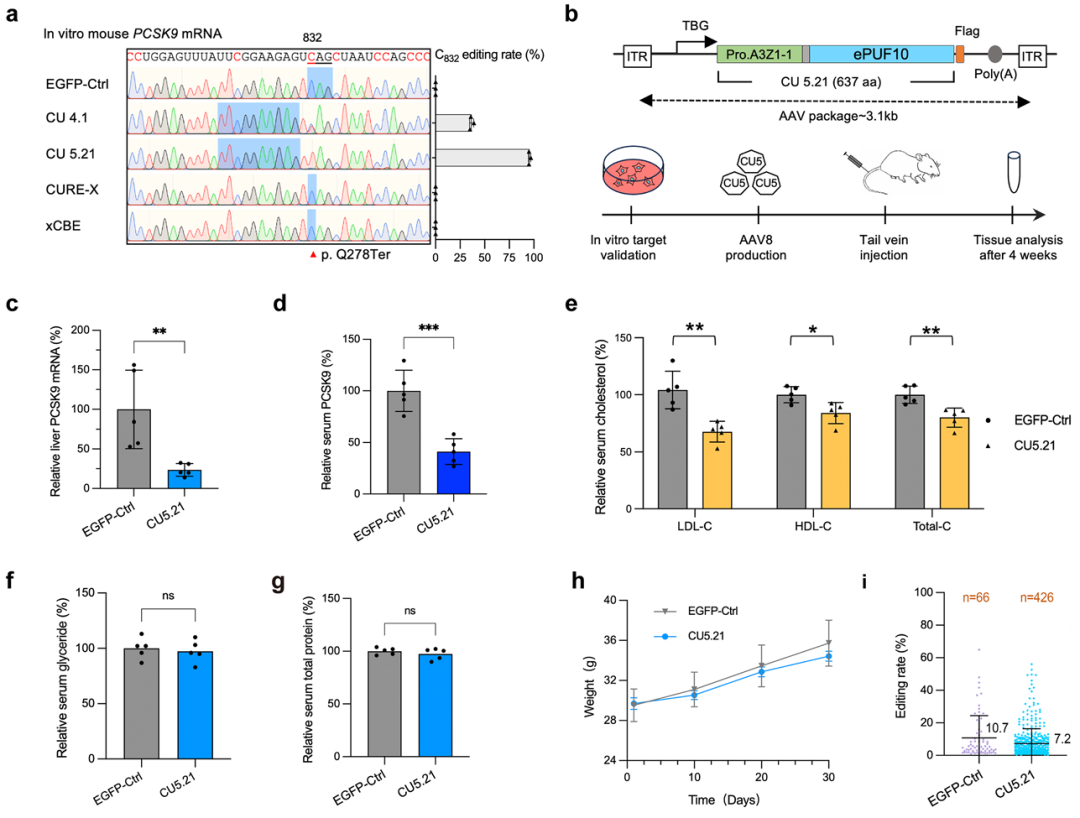
图1 CU5.21碱基编辑器有效降低 PCSK9表达并有效降低小鼠胆固醇水平。
7. 大脑体内RNA编辑成功逆转自闭症小鼠表型
为评估 CU5 在脑部 RNA 编辑中的潜力,研究团队选用了携带 Mef2c p.L35P(c.T104C)突变的 ASD 小鼠模型,该突变在人类中可导致严重 ASD,既往 DNA 编辑需双 AAV 载体,临床转化难度大。
体外实验显示,CU5.15 对 Mef2c mRNA C104 的编辑率达 43%,显著优于CRISPR/Cas 系统。将 CU5.15 装入可穿越血脑屏障的 AAV-PHP.eB 载体,单次尾静脉注射 L35P+/−小鼠,结果显示,前额叶皮层和海马的 U104 占比分别达 61.3% 和 68%,无旁观编辑,基因组测序未检出 C→T 突变,证实纯 RNA 编辑(图2)。
CU5.15 治疗使 MEF2C 蛋白水平完全恢复至野生型,小鼠寿命接近野生型,三箱社交测试和社交入侵实验均显示社交障碍显著改善。本研究证实,单AAV递送的CU5.15 RNA碱基编辑可高效纠正脑部遗传突变,为 ASD 及其他神经系统疾病治疗开辟了新途径。
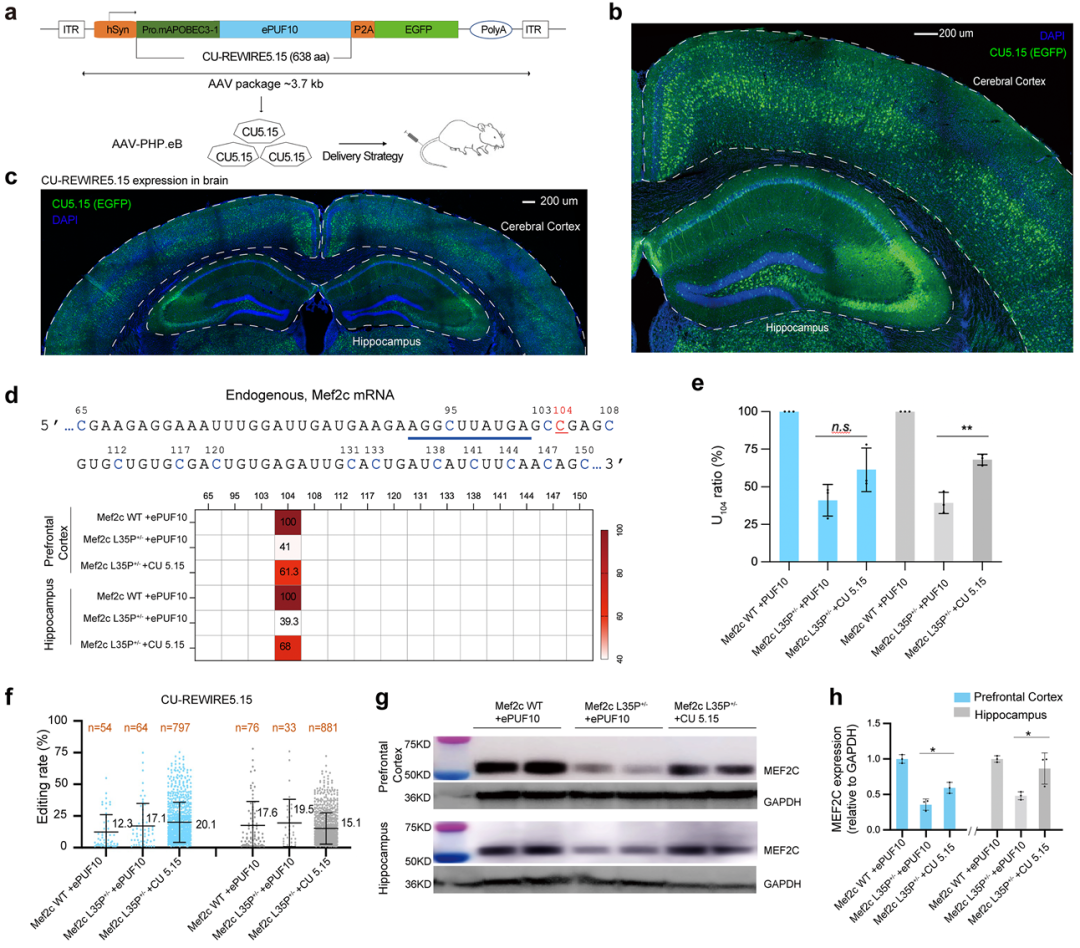
图2 在Mef2c L35P+/−小鼠体内进行RNA碱基编辑,可纠正基因突变并恢复蛋白表达。
三、总结与意义
本研究利用AI辅助蛋白质工程,系统性地构建了ProAPOBECs RNA碱基编辑工具库,首次实现了高效、精准、安全的体内C-to-U RNA编辑。更令人振奋的是,研究团队在自闭症小鼠模型中通过单次RNA编辑治疗,不仅纠正了基因突变,还显著改善了疾病表型,延长了生存期,这是RNA编辑领域的重大突破。
该研究为遗传疾病的RNA编辑治疗奠定了坚实基础。ProAPOBECs工具库的建立,就像为科学家提供了一套“精准外科手术刀“,可以针对不同序列背景的致病突变进行定制化编辑,极大地拓展了RNA碱基编辑的应用范围。
本研究使用的AAV载体信息:

实验动物:4-8周龄小鼠
注射方法:尾静脉注射,剂量2×10¹² vg/mouse ,体积200 µL/只(PBS稀释)
取材时间:注射后4周
派真生物有幸为本研究提供AAV病毒包装服务,助力科研团队实现体内RNA碱基编辑的重大突破。
该论文的共同第一作者为上海交通大学医学院松江研究院韩文建副研究员和复旦大学医学遗传研究院袁博青年研究员;共同通讯作者为韩文建副研究员、王泽峰教授和仇子龙教授。
该研究工作得到了“脑科学与类脑研究”国家重大科技专项、国家自然科学基金委重点项目、青年科学基金项目、上海市卫健委种子计划项目以及上海市超级博士后激励计划等项目资助。
关于派真
作为一家专注于AAV 技术十余年,深耕基因治疗领域的CRO&CDMO,派真生物可提供从载体设计、构建到 AAV、慢病毒和 mRNA 服务的一站式解决方案。凭借深厚的技术实力、卓越的运营管理和高标准的服务交付,我们为全球客户提供一站式CMC解决方案,包括从早期概念验证、成药性评估到IIT、IND及BLA的各个阶段。
凭借我们独立知识产权的π-alphaTM 293 细胞AAV高产技术平台,我们能将AAV产量提高多至10倍,每批次产量可达1×10¹⁷vg,以满足多样化的商业化和临床项目需求。此外,我们定制化的mRNA和脂质纳米颗粒(LNP)产品及服务覆盖药物和疫苗开发的各个阶段,从研发到符合GMP的生产,提供端到端的一站式解决方案。