2026年1月2日,北京大学生命科学学院伊成器教授团队在Nature Biotechnology杂志(IF=41.7)在线发表了题为Single-strand deaminase-assisted editing for functional RNA manipulation的研究论文。该研究建立了由单链脱氨酶辅助的可调节RNA信息操纵平台AIM(adjustable RNA information manipulation)。该平台突破了目前RNA碱基编辑工具“单点编辑”的限制,实现了在RNA靶向区域内对不同数量、多种类型碱基的可控与精准操纵,为RNA功能研究与疾病干预提供了强大的底层技术支撑。
研究亮点
提出”RNA编辑窗口“的概念:通过特殊设计的“环状引导RNA”(LF-gRNA),在目标RNA上形成一个大小可调的单链环区,使编辑器只作用于环内暴露的碱基,而双链区域则受到保护。通过调整环的大小,可精准控制编辑的碱基数量与位置。
构建多功能RNA编辑工具箱:
(1)AIM-A:A-to-I编辑,高效且脱靶低;(2)AIM-C:C-to-U编辑,无A-to-I副活性,特异性高;(3)AIM-A&C:首次实现同一RNA分子内A和C的同时编辑,极大扩展了编码与非编码RNA的改写能力。
成功纠正提前终止密码子(UAA):约22%的无义突变属于UAA类型,传统RNA编辑工具难以同时改写两个A。AIM在小鼠杜氏肌营养不良(DMD)模型中实现最高27%的双A同时编辑,恢复约20%的肌营养不良蛋白表达,显著改善肌肉病理。
精准操控相邻磷酸化位点,调控蛋白质功能:利用AIM的可调编辑窗口,对多个蛋白的相邻磷酸化密码子进行单点或双点同时突变,成功改变蛋白质稳定性与功能。
主要研究内容
1.AIM平台的开发
AIM平台由三个核心元件构成:负责RNA靶向定位的 dCas13 蛋白、经过理性设计单链RNA脱氨酶TadA,以及一种特殊设计的可成环向导RNA(Loop-forming gRNA,LF-gRNA)。
LF-gRNA在目标序列两侧与靶RNA形成互补配对,从而在中间区域诱导形成一个局部单链RNA环区。该环区中的碱基充分暴露,成为单链RNA脱氨酶作用的有效底物;与此同时,环区两侧形成的双链RNA结构则对邻近序列起到屏蔽作用,有效限制脱氨反应向非目标区域扩散。通过调节LF-gRNA诱导的单链环区长度与相对位置,AIM实现了对RNA编辑窗口大小与覆盖范围的精确控制,从而在靶向区域内完成单碱基或多碱基的可控编辑。
2.AIM编辑功能的扩展:ABE、CBE与ACBE
在上述结构基础上,研究团队对TadA脱氨酶进行了系统性的蛋白质工程改造,构建了具有不同编辑特性的AIM工具体系(图1),从而将AIM从单一编辑模式拓展为多功能RNA编辑平台:
AIM-A / AIM-Amax:通过优化TadA对腺嘌呤的催化活性与局部特异性,实现高效、可控的 A-to-I 编辑(RNA ABE);
AIM-C / AIM-Cmax:通过重塑TadA底物选择性,获得具有稳定C-to-U编辑活性的变体,建立了一种不依赖ADAR或APOBEC家族的新型RNA CBE体系;
AIM-A&C / AIM-A&Cmax:在同一脱氨酶框架内整合A-to-I与C-to-U活性,实现A与C在同一RNA分子、同一编辑窗口内的同时编辑(RNA ACBE)。AIM平台能够覆盖多种RNA碱基编辑需求,为复杂RNA信息重写提供了高度模块化的技术基础。
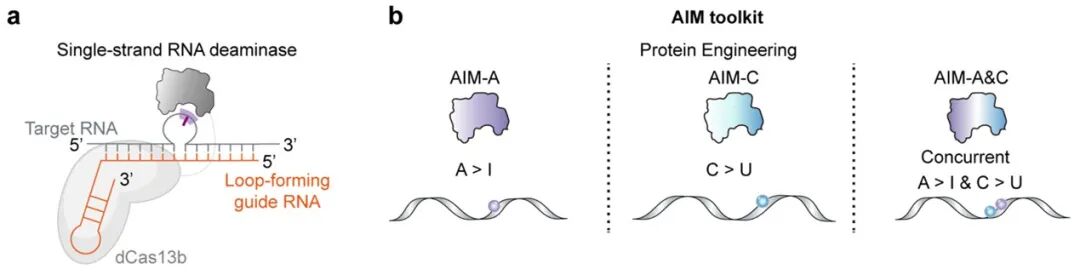
图1 AIM平台的设计原理和功能
3.功能应用验证
依托AIM平台在编辑窗口上的灵活性与编辑类型上的多样性,研究团队完成了多项现有RNA编辑工具难以实现的功能性应用验证。
首先,在提前终止密码子UAA的通读场景中,AIM展现出显著优势。UAA终止信号的解除需要在同一密码子内实现两个腺嘌呤位点的同时编辑,而传统RNA编辑工具通常仅能高效作用于单一A位点。利用AIM-Amax系统,研究团队在多个转录本中实现了同一密码子内两个A位点的同步编辑,从而成功诱导UAA向可读密码子的功能性重编码。进一步在囊性纤维化细胞模型及杜氏肌营养不良小鼠模型中,研究者检测到全长蛋白的表达恢复及相应生理功能改善,验证了AIM在疾病相关场景中的应用潜力(图2)。
此外,研究团队将AIM平台用于蛋白翻译后修饰相关RNA信息的操纵。鉴于翻译后修饰具有动态性和可逆性,其编码密码子成为RNA层面功能干预的理想靶点。通过AIM对单个或相邻磷酸化相关密码子进行定向改写,研究团队实现了对蛋白稳定性与功能状态的精准调控,进一步拓展了AIM在功能RNA信息操纵方面的适用范围。
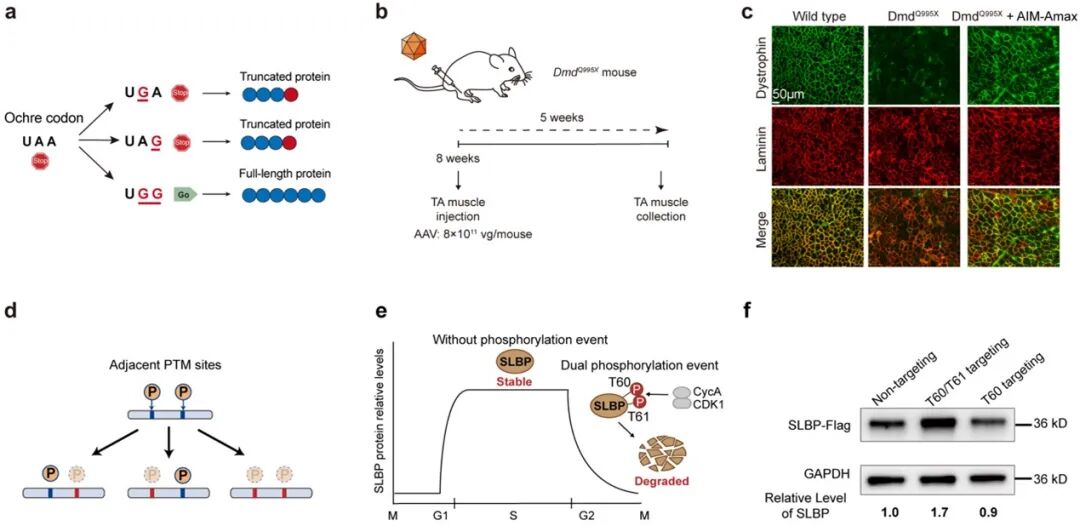
图2 AIM在RNA信息操纵中的应用
4.特异性与安全性评估
为系统评估AIM平台的安全性,研究团队对其RNA与DNA层面的潜在脱靶效应进行了多维度分析。全转录组测序结果显示,AIM在RNA层面的非靶向编辑事件数量较低,且未引起显著的全局基因表达变化。
在DNA层面,研究者采用R-loop assay及靶向DNA扩增子深度测序,对潜在DNA脱靶编辑进行评估。结果显示,AIM在DNA上的编辑水平与阴性对照无显著差异。此外,在细胞和动物模型中均未观察到AIM诱导的免疫激活反应,表明该平台具有良好的生物安全性。
研究意义
AIM平台通过LF-gRNA介导的RNA结构重塑,实现了在特定RNA区域内对多个碱基的精确操纵,并在此基础上系统拓展了A-to-I、C-to-U以及A&C 同时编辑等多种编辑模式。
该平台兼具高度可编程性、良好的特异性与安全性,为RNA编辑从“单点编辑”迈向“信息操纵”提供了新的技术范式。
未来,AIM有望应用于RNA二级结构、翻译调控元件以及RNA–RNA或RNA–蛋白相互作用位点等功能元件的精确操纵,成为解析与重塑RNA功能的重要工具。
| 本研究用到的AAV病毒信息 | |
| 血清型 | AAV9 |
| 启动子 | CMV, U6 |
| 表达基因 | dCas13b-TadA, sgRNA |
| 给药方式 | 8 × 1011 GC/ mouse,胫骨前肌局部注射 |
参考资料:
Zhuang, Y., Zhu, Q., Wu, H. et al. Single-strand deaminase-assisted editing for functional RNA manipulation. Nat Biotechnol (2026). https://doi.org/10.1038/s41587-025-02956-7
关于派真
作为一家专注于AAV 技术十余年,深耕基因治疗领域的CRO&CDMO,派真生物可提供从载体设计、构建到 AAV、慢病毒和 mRNA 服务的一站式解决方案。凭借深厚的技术实力、卓越的运营管理和高标准的服务交付,我们为全球客户提供一站式CMC解决方案,包括从早期概念验证、成药性评估到IIT、IND及BLA的各个阶段。
凭借我们独立知识产权的π-alphaTM 293 细胞AAV高产技术平台,我们能将AAV产量提高多至10倍,每批次产量可达1×10¹⁷vg,以满足多样化的商业化和临床项目需求。此外,我们定制化的mRNA和脂质纳米颗粒(LNP)产品及服务覆盖药物和疫苗开发的各个阶段,从研发到符合GMP的生产,提供端到端的一站式解决方案。