
2023年5月,来自瑞典鲁德贝克实验室的科研人员在Cancer Cell上发表治疗胶质母细胞瘤的AAV基因疗法最新研究论文——Tailoring vascular phenotype through AAV therapy promotes anti-tumor immunity in glioma。

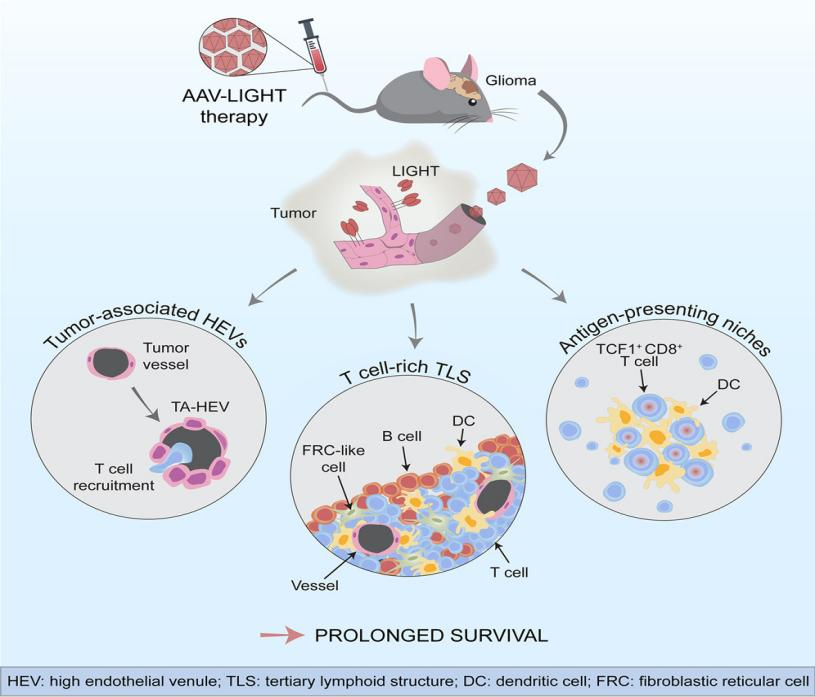
在此研究中,作者利用AAV载体递送技术使得小鼠胶质母细胞瘤部位的内皮细胞表达LIGHT,这种疗法延长了小鼠的生存期,诱导了肿瘤相关的高内皮小静脉(HEV)和富含T细胞的三级淋巴结构(TLS)的生成,从而促进T细胞启动和浸润到肿瘤中发挥杀伤肿瘤细胞的作用。
常规免疫疗法对脑部肿瘤“束手无策”
胶质母细胞瘤(GBM)是一种侵袭性脑肿瘤,具有死亡率高、生存期短、预后差、复发率高的特点。在过去的几十年里,GBM的治疗方法几乎没有任何进展。GBM患者5年生存率仅为5%左右,以免疫检查点抑制剂(如PD-1/PD-L1)为代表的癌症免疫疗法虽然对多种癌症有效,但对脑肿瘤却无效。原因在于脑肿瘤中的血管功能失调并充当屏障(即血脑屏障),在肿瘤部位形成高度免疫抑制的微环境,阻止杀伤性T细胞到达肿瘤中。如何突破血脑屏障,成了免疫疗法治疗脑部肿瘤的关键。
体内研究揭示AAV-LIGHT治疗脑胶质瘤的生物学机制
LIGHT是一种TNF超家族分泌蛋白,也被称为肿瘤坏死因子配体超家族成员14(TNFSF14),可促进T细胞募集从而诱导高内皮微静脉(HEV)和三级淋巴样结构(TLS)。在这项研究中,作者预筛了一组与淋巴素发生相关的分子——CXCL13.CCL21.LTαβ和LIGHT,从中确定LIGHT为治疗GBM最有希望的候选药物。
作者使用高度靶向脑内皮细胞的AAV BR1载体诱导抗αPD-1的CT-2A神经胶质瘤小鼠模型的胶质母细胞中产生LIGHT,观察到肿瘤部位的血管的形状和功能发生了变化,为杀伤性T细胞创造了一个有利环境,有利于T细胞被招募到肿瘤中。AAV-LIGHT还诱导了与脑肿瘤相关的免疫细胞聚集体——三级淋巴结构(TLS),可以激活杀伤性T细胞来对抗TLS中的肿瘤细胞。作者进一步分析发现TLS包含Ki67+增殖B细胞和T细胞,含有CD11c+DC,它们与T细胞密切相互作用,并在TLS中观察到DC网络的形成,这说明AAV-LIGHT诱导的TLS以T细胞、CD11c+ DC和CCL21+ FRC样细胞为主,因此类似于淋巴结的T细胞区。令人兴奋的是,AAV-LIGHT疗法不仅延长了胶质母细胞瘤小鼠模型的生存期,还有部分小鼠的肿瘤被完全清除。
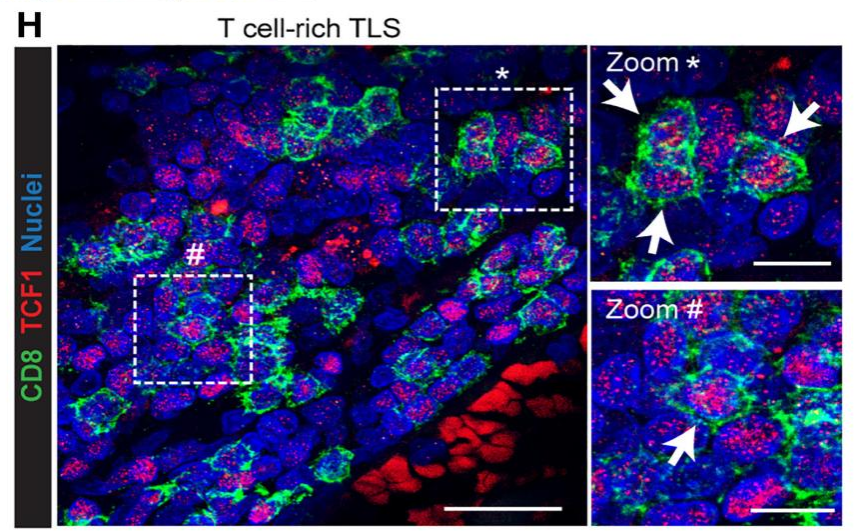
AAV-LIGHT诱导的类似于淋巴结的T细胞区—TLS
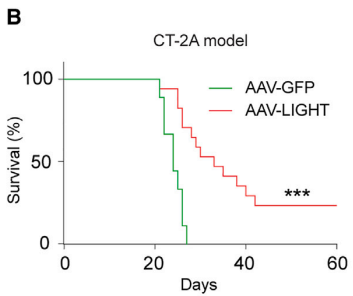
AAV-LIGHT延长了小鼠的生存期
值得一提的是,AAV-LIGHT疗法还促进了一种特殊的杀伤性T细胞群——干细胞样T细胞(stem-like T cells),它们既位于TLS内,也位于肿瘤血管周围形成的特殊生态位中,起到增强免疫疗效的作用。
本研究中的AAV-LIGHT在小鼠体内显示出有潜力的脑部胶质母细胞瘤治疗效果,是一种突破血脑屏障的免疫疗法,后续如果应用于人体治疗还需经过临床验证。
资料来源
1.https://doi.org/10.1016/j.ccell.2023.04.010
2.公众号医麦克
https://mp.weixin.qq.com/s/zk00oAZdHY4G2MYp1xCgYQ
关于派真
作为一家专注于AAV 技术十余年,深耕基因治疗领域的CRO&CDMO,派真生物可提供从载体设计、构建到 AAV、慢病毒和 mRNA 服务的一站式解决方案。凭借深厚的技术实力、卓越的运营管理和高标准的服务交付,我们为全球客户提供一站式CMC解决方案,包括从早期概念验证、成药性评估到IIT、IND及BLA的各个阶段。
凭借我们独立知识产权的π-alphaTM 293 细胞AAV高产技术平台,我们能将AAV产量提高多至10倍,每批次产量可达1×10¹⁷vg,以满足多样化的商业化和临床项目需求。此外,我们定制化的mRNA和脂质纳米颗粒(LNP)产品及服务覆盖药物和疫苗开发的各个阶段,从研发到符合GMP的生产,提供端到端的一站式解决方案。

