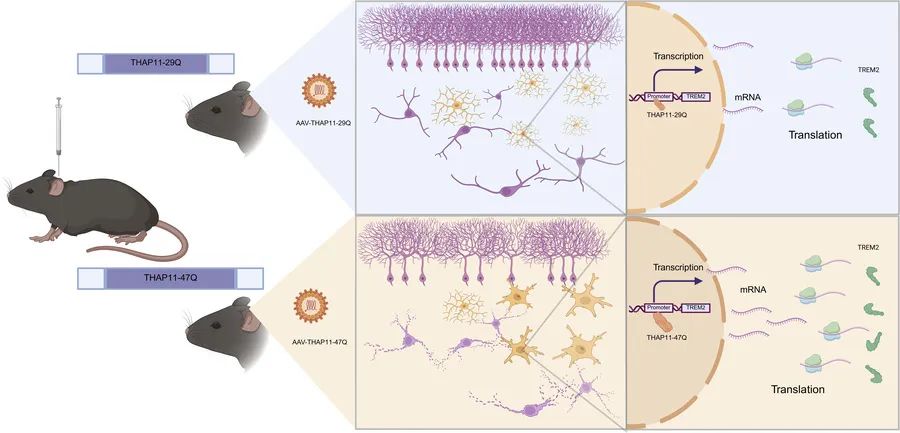
多聚谷氨酰胺(polyQ)疾病是一类由单基因突变引起的神经退行性疾病。长期以来,科学界已知的polyQ疾病共有九种,包括亨廷顿舞蹈症(Huntington’s disease)以及多种脊髓小脑性共济失调(spinocerebellar ataxia,SCA)亚型。直到2023年,第10种polyQ疾病——SCA51才被正式确认。
SCA51由THAP11基因中CAG三核苷酸重复序列异常扩增引起。正常人的CAG重复数为20-38次,而SCA51患者则超过45次。该疾病主要表现为:步态共济失调和构音障碍,小脑明显萎缩(MRI影像显示),渐进性运动功能减退。作为新发现的疾病,SCA51的致病机制尚不明确,临床治疗选择极其有限,因此迫切需要基础研究突破。
近日,暨南大学粤港澳中枢神经再生研究院杨甦/李世华和湘雅医院江泓团队在临床医学国际期刊Journal of Clinical Investigation(IF=13.3)在线发表题为“Mutant THAP11 causes cerebellar neurodegeneration and triggers TREM2-mediated microglial activation in mice”的研究论文。研究人员利用AAV载体递送系统结合基因编辑方法,成功构建了携带THAP11突变基因的转基因小鼠模型。实验结果显示,该基因突变主要通过功能获得性机制导致小鼠小脑区域的特异性神经元死亡。深入的机制探索发现,突变的THAP11蛋白能够异常调节基因转录过程,进而激活TREM2相关的细胞信号传导通路。这一过程促使小胶质细胞被过度激活,引发以神经炎症为特征的病理反应,最终造成神经元的损伤和死亡。该研究阐明了TREM2介导的小胶质细胞活化在polyQ疾病中的关键作用,为相关疾病的治疗提供了新的潜在靶点。

一、研究亮点
首次建立SCA51动物模型体系
创建了AAV介导的过表达模型和基因敲入小鼠模型,成功复现人类SCA51的核心病理特征,为机制研究提供了可靠的实验平台。
揭示TREM2-小胶质细胞激活的全新致病通路
发现突变THAP11直接激活小胶质细胞上的TREM2受体,证实小胶质细胞激活是神经元变性的关键驱动因素,为治疗干预提供了明确的分子靶点。
二、主要研究结果
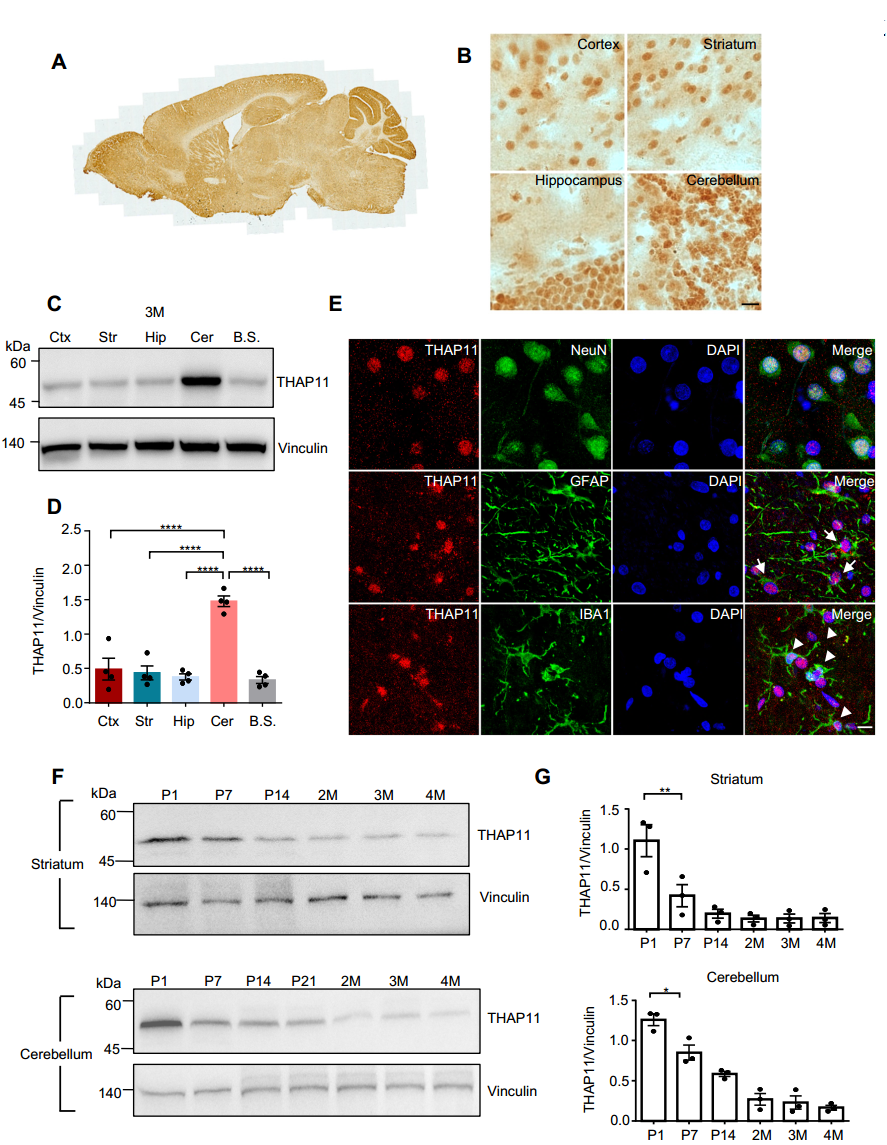
1.THAP11在小脑特异性高表达
研究团队首先系统分析了THAP11在小鼠和猕猴脑内的表达模式(图1)。结果显示:小脑区域THAP11表达量最高,与SCA51主要累及小脑的临床表现高度吻合;THAP11在脑发育过程中呈现年龄依赖性的下降趋势,但在成年小鼠和猴脑中仍可检测到稳定表达。这一动态表达模式表明,THAP11不仅是早期神经发育的关键调控因子,其功能还可能延伸至成年神经系统的稳态维持。
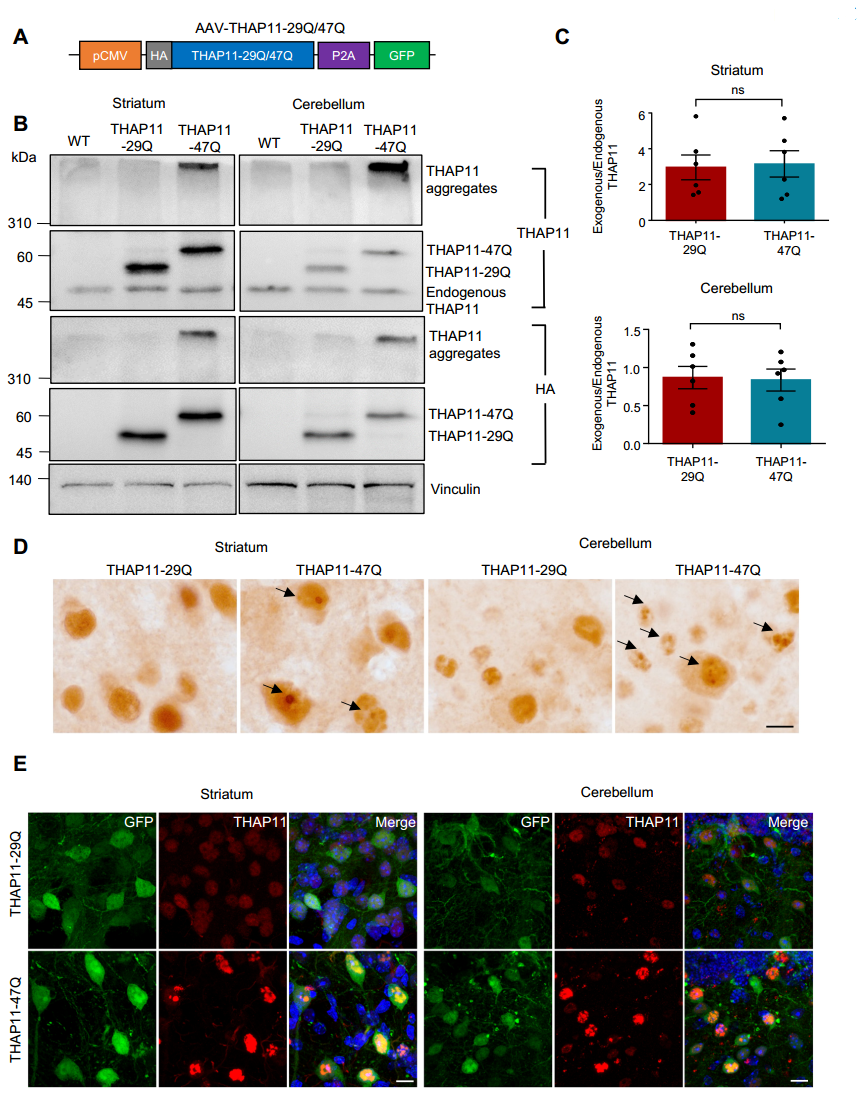
2. 获得性功能增强是主要致病机制
为确定SCA51的致病机制,研究者分别检测了THAP11功能丧失和获得的影响:(1)功能丧失实验:利用CRISPR/Cas9技术敲低内源性THAP11,结果显示神经元存活率未受影响,证明功能丧失不是主要致病因素;(2)功能获得实验:利用AAV介导的基因递送技术,在小鼠的小脑和纹状体中过表达携带47个CAG重复的突变THAP11(THAP11-47Q),观察到显著的蛋白聚集和小脑神经元变性,证实获得性毒性功能是关键致病机制(图2)。
3. 突变蛋白引起严重运动功能障碍
研究团队通过多项行为学测试评估了THAP11-47Q对小鼠运动功能的影响:(1)转棒实验:突变组小鼠停留时间显著缩短;(2)平衡木测试:通过时间明显延长,协调性下降;(3)握力测试:肌力明显减弱;(4)步态分析:步长缩短,规律性指数降低。这些结果与人类SCA51患者的共济失调症状高度一致。
4. 转录组学揭示小胶质细胞激活
通过RNA测序分析突变THAP11对基因表达的影响,共鉴定出284个差异表达基因,小胶质细胞激活标志基因(如TREM2、C1qA、C1qC、Cle7a)显著上调,特别是TREM2及其下游靶基因表达增加。GO富集分析显示上调通路主要涉及吞噬作用、ERK级联反应和细胞杀伤功能等。
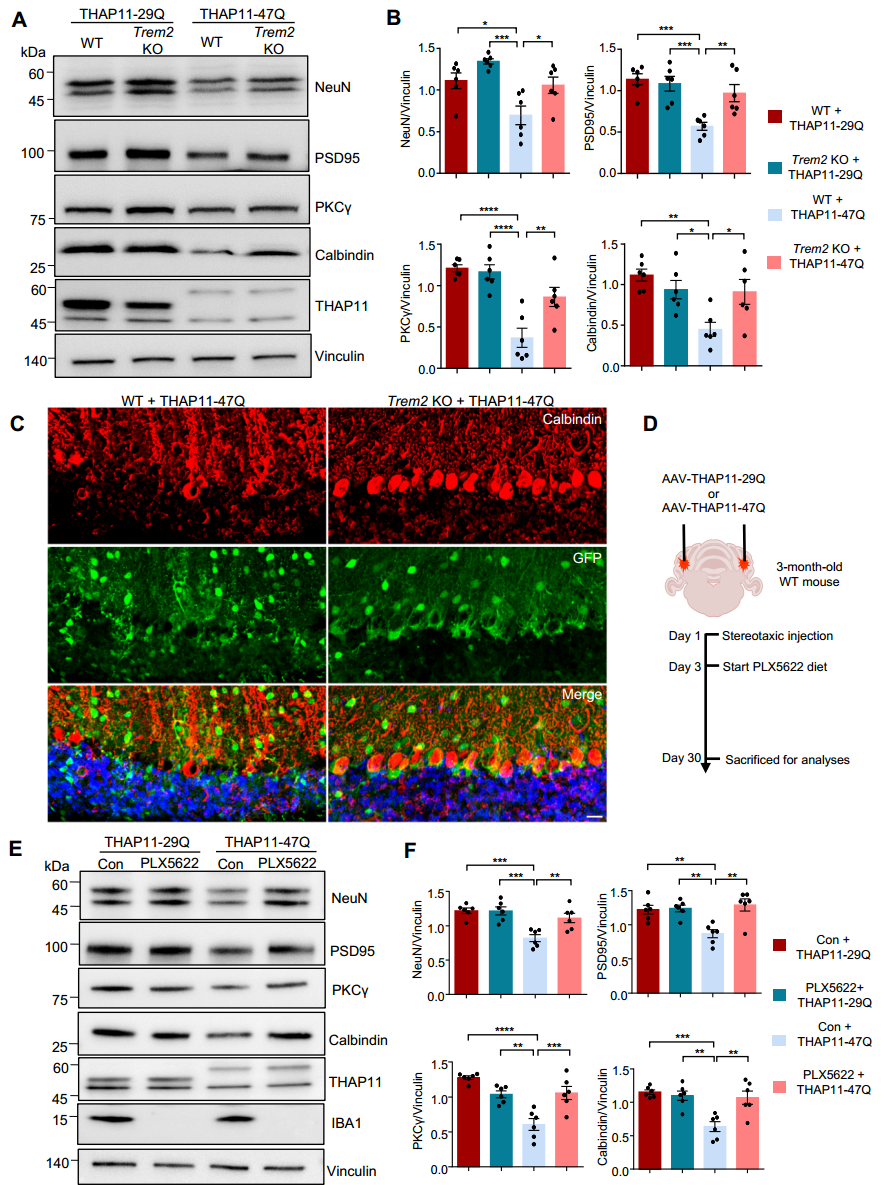
5. 敲除 TREM2可显著缓解THAP11-47Q导致的神经毒性
染色质免疫共沉淀实验结果显示,突变THAP11-47Q通过增强其对TREM2启动子的结合能力,特异性上调 TREM2的表达。敲除TREM2基因或使用小胶质细胞清除剂PLX5562可显著缓解突变THAP11导致的神经毒性。这一结果提示,靶向TREM2或小胶质细胞活化通路有望成为治疗SCA51的潜在策略(图3)。
三、总结与意义
本研究在SCA51致病机制研究方面取得了多项重要突破:
• 首次明确SCA51主要由获得性毒性功能引起,为治疗策略制定提供了理论基础。
• 发现TREM2-小胶质细胞激活通路是关键致病环节,为药物研发提供明确靶点。
• 验证了靶向小胶质细胞的治疗有效性,为临床转化奠定了基础。
• 建立的动物模型为后续药物筛选提供了重要工具。
该研究不仅加深了对罕见神经退行性疾病的认识,也为polyQ疾病家族的治疗提供了新思路。特别是TREM2调控小胶质细胞激活的发现,可能对其它神经退行性疾病的研究产生重要启示。
本研究用到的AAV病毒信息
派真生物有幸为该研究提供了基因编辑、基因过表达质粒构建和AAV包装服务。
关于派真
作为一家专注于AAV 技术十余年,深耕基因治疗领域的CRO&CDMO,派真生物可提供从载体设计、构建到 AAV、慢病毒和 mRNA 服务的一站式解决方案。凭借深厚的技术实力、卓越的运营管理和高标准的服务交付,我们为全球客户提供一站式CMC解决方案,包括从早期概念验证、成药性评估到IIT、IND及BLA的各个阶段。
凭借我们独立知识产权的π-alphaTM 293 细胞AAV高产技术平台,我们能将AAV产量提高多至10倍,每批次产量可达1×10¹⁷vg,以满足多样化的商业化和临床项目需求。此外,我们定制化的mRNA和脂质纳米颗粒(LNP)产品及服务覆盖药物和疫苗开发的各个阶段,从研发到符合GMP的生产,提供端到端的一站式解决方案。