杜氏肌营养不良症(Duchenne Muscular Dystrophy, DMD) 是最常见的 X‑连锁隐性致死性肌肉疾病,全球男性新生儿中的发病率约 1/3500–5000。核心病因是 DMD基因突变导致肌萎缩蛋白(dystrophin)缺失或功能缺陷,最终出现进行性骨骼肌与心肌退行性病变。目前临床上尚无根治方法,患者通常在20-30岁因呼吸衰竭或心脏并发症死亡。开发有效的基因治疗策略,恢复肌萎缩蛋白的表达,是当前DMD研究的前沿热点。
对DMD临床前研究长期受限于缺乏与人类生理解剖高度相似的大型动物模型。目前常用的小鼠、犬、猪模型都不能完全模拟患者病程,制约了疗效和安全性评估的可信度,而建立大型灵长类模型通常需要 6–7 年的时间。
2025年4月,昆明理工大学陈永昌/季维智和解放军总医院吴士文团队在Cell Reports Medicine杂志(医学1区Top期刊,IF=10.6)发表了一项突破性研究成果,研究团队通过 CRISPR/Cas9 一步法定点敲除 DMD Exon50,构建出全球首个Exon50突变的DMD恒河猴模型,将建模周期直接压缩到 < 1 年。该模型高度模拟人类DMD的核心病理特征和典型的运动功能障碍,为疾病研究提供了理想的实验平台。基于这一优质的猴模型,研究人员设计了一种靶向Exon51的单侧切割基因治疗策略,显著恢复了抗肌萎缩蛋白表达,有效改善了模型动物的病理损伤和运动功能,在DMD猴模型中疗效持续1.5年以上,为DMD的临床基因治疗提供了关键的科学依据和极具转化前景的治疗方案。

研究亮点
1. 全球首个Exon50突变的DMD恒河猴模型。研究团队采用一步法构建了杜氏肌营养不良恒河猴模型,该模型比小鼠模型更接近人类疾病特征,为转化医学研究提供了更可靠的实验平台。
2. 单剪切基因治疗策略。 研究采用了单剪切(Single-cut)基因编辑策略,这种方法较传统双剪切策略具有更高的效率和安全性,减少了脱靶风险。
3. 长期治疗效果可持续至少1.5年。研究团队利用腺相关病毒(AAV)载体系统递送肌萎缩蛋白(micro-dystrophin)基因编辑系统,实现了高效的基因表达和组织靶向。单次给药的治疗效果可持续至少1.5年,无严重不良反应,为临床应用提供了重要依据。
主要研究结果
1. Exon50突变DMD恒河猴模型的构建
研究团队设计了靶向DMD基因50号外显子剪接供体位点的sgRNA,通过胚胎显微注射和代孕移植,最终获得6只活产猴,包含4只50号外显子突变的猴模型(1雌3雄)。分子水平检测显示,所有突变猴均在51号外显子中引入提前终止密码子,导致dystrophin完全缺失(图1)。DMDExon50突变猴模型表现出与人类DMD患者高度相似的病理特征,包括肌肉组织无dystrophin表达、肌肉纤维化、CK升高、步态异常、运动能力下降等典型DMD症状。
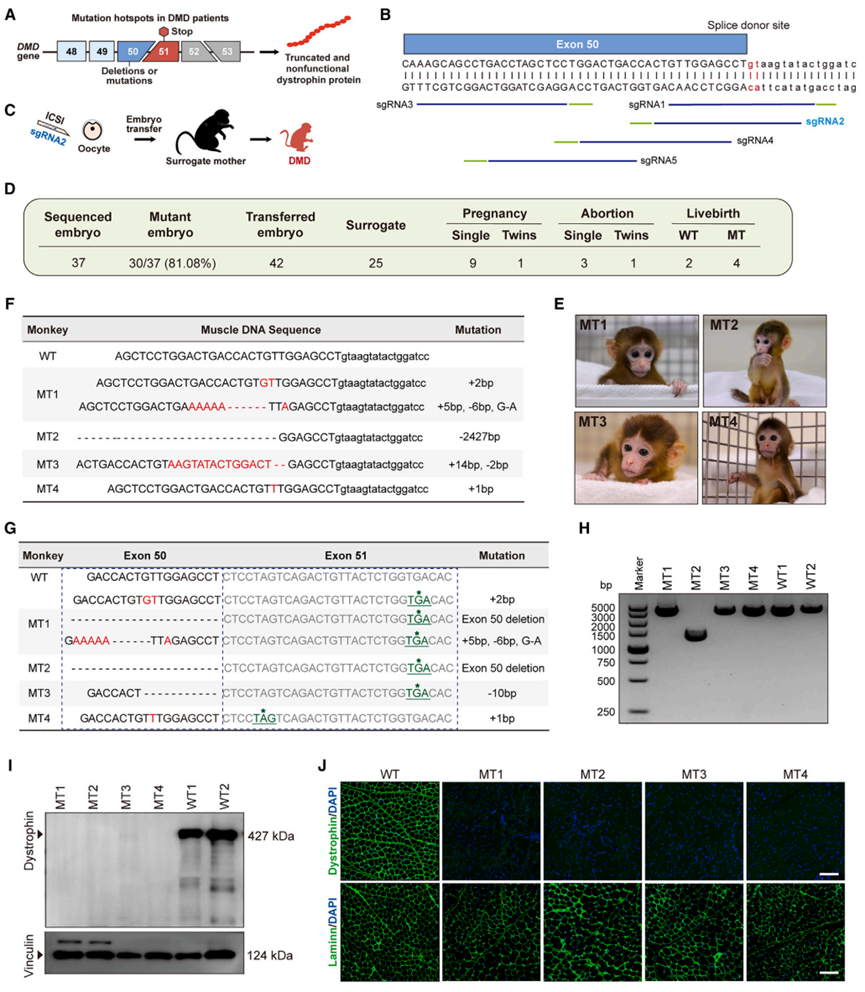
图1. DMDEx50猴模型的构建与表征。
(A) 靶向DMD基因第50号外显子的基因编辑策略示意图。(B) 用于靶向猴DMD基因第50号外显子的sgRNA位点位置示意图。(C) DMDEx50猴模型的生成过程示意图。(D) DMDEx50猴模型信息。(E) 四只DMDEx50模型猴的照片。(F) 肌肉DNA中的突变类型与序列:红色碱基为插入序列,虚线表示缺失序列。(G) 肌肉mRNA中的突变类型与序列:红色碱基为插入序列,虚线表示缺失序列;终止密码子用绿色下划线加星号标注。(H) WT与DMDEx50猴外周血DNA PCR琼脂糖凝胶电泳结果。(I) Western blot显示1岁WT和DMDEx50猴股四头肌中Dystrophin的表达。(J) 1岁WT和DMDEx50猴股四头肌Dystrophin和Laminin的免疫荧光染色。
2. 单剪切基因治疗策略和治疗效果
为纠正DMD基因第50号外显子的突变,研究团队设计了靶向剪接受体位点的sgRNA,并从中筛出sgRNA3和sgRNA4两条高活性sgRNA。体外测试显示,这两条sgRNA的总编辑率分别达到48.67%和40.37%,其中能恢复阅读框的“有效编辑”占比依次为16.43%和13.70%。由于人类与恒河猴在DMD基因第51号外显子的序列完全一致,因此这些sgRNA无需修改即可用于人类。后续在人类HEK293T与HeLa细胞中的验证也印证了这一点:sgRNA3在这两种细胞系中的总编辑率分别为53.65%和30.95%,跨物种兼容性良好。
在此基础上,研究团队进一步构建了肌肉特异性的MyoAAV递送平台,引入仅有1056个氨基酸的紧凑型核酸酶Cas12iMax,采用巨细胞病毒强启动子(CMV)驱动表达的单载体治疗方案MyoAAV-Cas12iMax-sgRNA3Ex51。在临床前试验中,局部肌内注射后不同肌群的表现差异明显:腓肠肌的总编辑率与有效编辑率分别达到7.50%和1.12%,而肱三头肌仅为1.55%和0.17%(图2)。更有趣的是,mRNA层面的编辑比例远高于DNA层面,暗示可能存在转录后调节机制。
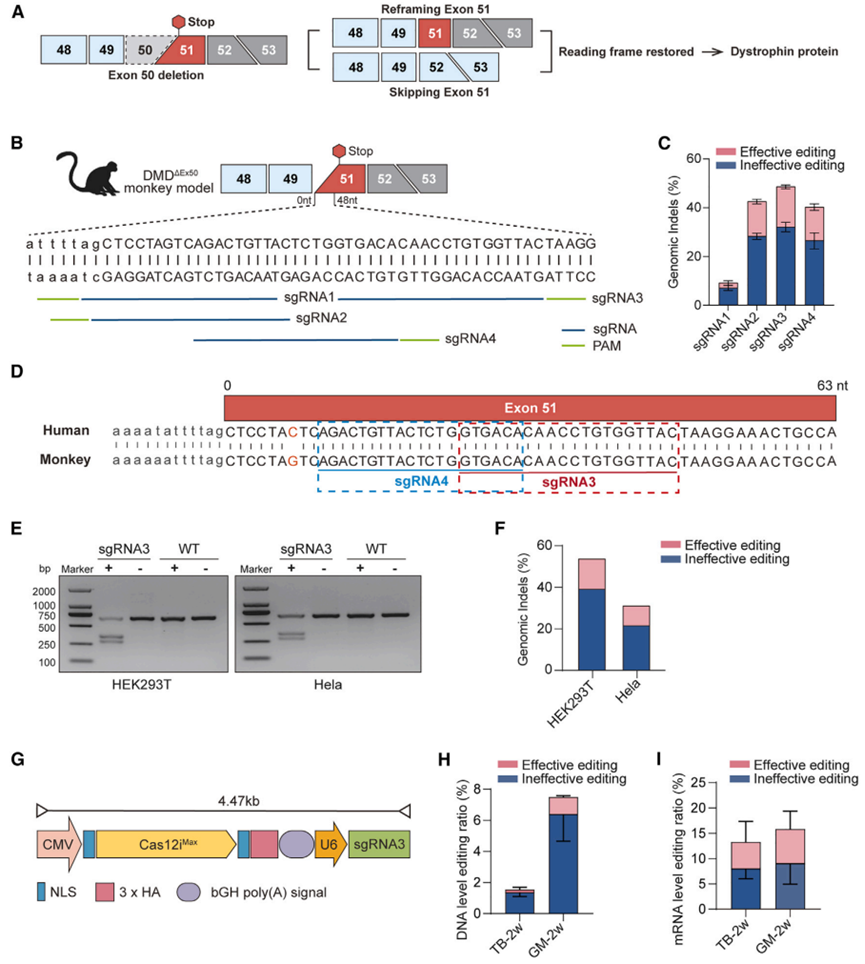
图2. MyoAAV-Cas12iMax-sgRNA3Ex51在体内外均实现高效编辑。
(A) DMDEx50突变与基因编辑策略示意图。第50号外显子缺失导致阅读框移码,并在第51号外显子提前出现终止密码子。设计策略通过重排或跳过第51号外显子以恢复dystrophin蛋白的正确阅读框。(B) 针对DMDEx50猴模型第51号外显子的sgRNA设计方案。图中列出sgRNA1–sgRNA4的序列及其对应的PAM位点。(C) 四种sgRNA(sgRNA1–sgRNA4)在DMDEx50猴模型中诱导的基因组插入/缺失(indels)。将每种sgRNA分别构建到Cas12iMax质粒中,并转染COS-7细胞,随后进行单克隆测序。恢复DMD基因阅读框的编辑视为有效(粉色),其余为无效(蓝色)。数据以平均值±标准误表示。(D) 人类与猴子第51号外显子序列比对,显示sgRNA3和sgRNA4的靶向区域高度保守。图中标记了sgRNA3和sgRNA4的靶位点,表明其具备跨物种编辑潜力。(E) sgRNA3的体外编辑效率验证。细胞转染sgRNA3与Cas9质粒(+)或对照质粒(-)。PCR扩增目标区域后行凝胶电泳,发现转染sgRNA3(+)的细胞出现切割条带(下方条带),表明Cas9成功介导基因组编辑;野生型(WT,无sgRNA3)未出现切割产物,证明sgRNA3介导的编辑具有特异性。(F) sgRNA3在HEK293T和HeLa细胞中诱导的基因组indels定量分析,分别展示有效(粉色)与无效(蓝色)编辑比例。(G) 用于靶向基因编辑的MyoAAV-Cas12iMax-sgRNA3载体示意图。CMV:巨细胞病毒启动子;NLS:核定位信号/序列;U6:人U6启动子。(H) 肱三头肌(TB)与腓肠肌(GM)局部肌肉注射MyoAAV-Cas12iMax-sgRNA3Ex51后,DNA水平的编辑效率。图表显示有效(粉色)与无效(蓝色)编辑比例,数据以平均值±标准误表示。(I) 注射后2周,TB与GM肌肉中mRNA水平的编辑效率。图表显示有效(粉色)与无效(蓝色)编辑比例,数据以平均值±标准误表示。
随后,研究团队通过静脉注射 MyoAAV-Cas12iMax-sgRNA3Ex51,对17 月龄的 DMDΔEx50猴进行了系统性基因治疗(图3)。结果显示:(1)在 DNA 层面,不同肌肉的编辑率存在差异,肱三头肌(TB)与肱二头肌(BB)在 8 周至 1 年内始终保持在 2.42–3.28% 的总编辑水平;(2)mRNA水平的总编辑率远高于 DNA 水平;(3)载体转导效率稳定,治疗 35 周后仍能检测到高水平信号。耐人寻味的是,尽管 1.5 年后在分子层面已难以检测编辑的痕迹,TB 肌肉中仍有 7.58% 的细胞呈抗肌萎缩蛋白阳性,暗示可能存在某种长期蛋白维持机制。
Western blot 和免疫染色进一步证实,该策略能够持续恢复蛋白表达。8 周时,TB 的阳性肌纤维比例最高,达 45.16%,随后随时间推移略有下降,但 35 周时 BB 仍有 32.16% 的阳性率。到 1.5 年时,TB 仍可检测到 7.58% 的阳性信号。
组织学分析显示,治疗后的猴子表现出明显的病理改善,包括肌纤维结构恢复、坏死减少、纤维化程度降低等。功能测试证实,治疗猴的核心肌群力量明显增强,在最具挑战性的仰卧位测试中,5秒内自主站立成功率显著提高。
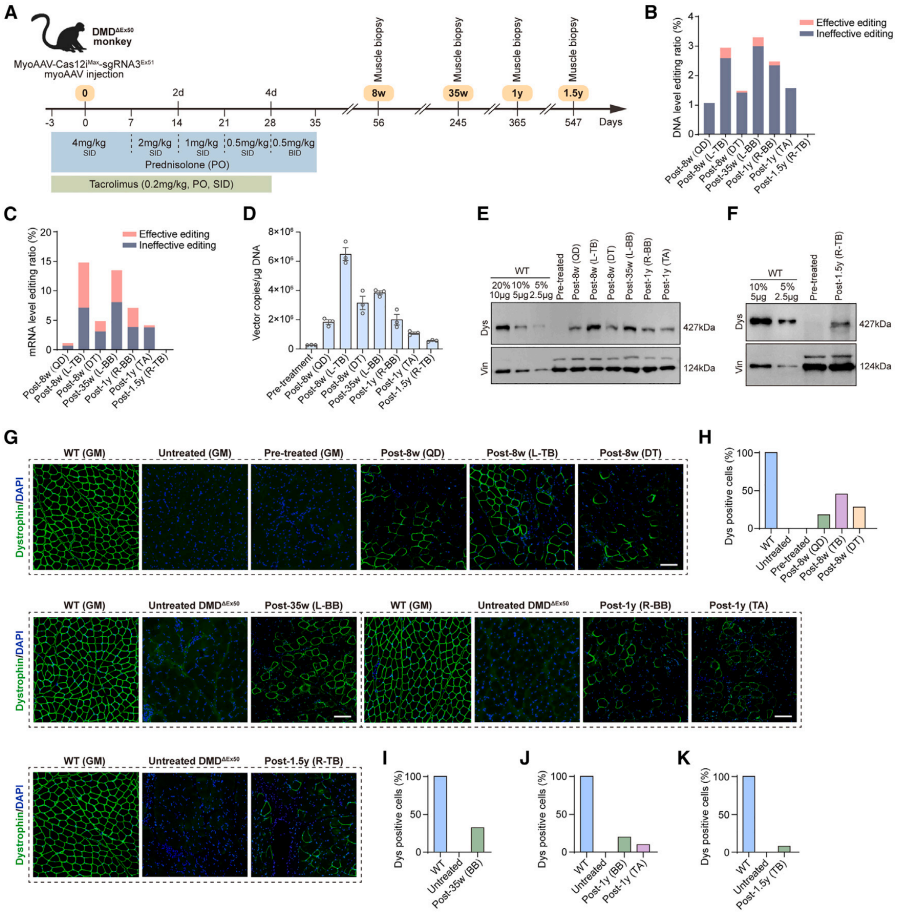
图3. 系统性递送MyoAAV-Cas12iMax-sgRNA3Ex51在DMDΔEx50猴模型中恢复dystrophin蛋白表达。
(A) DMDΔEx50猴治疗实验时间轴。图中标示免疫抑制剂给药方案及肌肉活检时间点。SID:每日一次;BID:每日两次;PO:口服。(B 和 C) 治疗后不同时间点多种肌肉组织的DNA水平(B)和mRNA水平(C)编辑率。图中分别展示有效编辑(粉色)与无效编辑(蓝色)比例。(D) 治疗后肌肉组织中的载体基因组拷贝数。以每毫克DNA的载体拷贝数表示不同肌肉组织在各时间点(治疗前、8周、35周、1年、1.5年)的检测结果。检测的肌肉包括股四头肌(QD)、左肱三头肌(L-TB)、三角肌(DT)、左肱二头肌(L-BB)、右肱二头肌(R-BB)和胫骨前肌(TA)。数据以平均值±标准误展示,每个圆点代表一个独立样本。(E 和 F) 治疗前后多种肌肉组织dystrophin(Dys)蛋白表达的Western blot分析。以野生型(WT)和未治疗的DMDΔEx50样本作对照。每孔上样50 μg总蛋白。为方便比较,WT样本按不同比例上样,如WT(10%)表示上样5 μg(占50 μg的10%)。Vinculin(Vin)作为上样内参。(G) 不同时间点及不同肌肉部位的肌肉切片dystrophin(绿色)与细胞核(DAPI,蓝色)免疫荧光染色。(H–K) 各肌肉部位及时间点的dystrophin阳性细胞定量:(H) 治疗后8周的股四头肌(QD)、肱三头肌(TB)和三角肌(DT);(I) 治疗后35周的肱二头肌(BB);(J) 治疗后1年的肱二头肌(BB)和胫骨前肌(TA);(K) 治疗后1.5年的肱三头肌(TB)。
3. 治疗的长期效果和安全性
研究结果显示,单次基因治疗可产生持续至少1.5年的治疗效果,同时未观察到明显的免疫毒性或其他不良反应。通过全基因组测序和扩增子测序对潜在脱靶效应进行系统评估,结果显示,在允许至多3个错配的严格条件下,仅检测到极少数单核苷酸变异(SNVs),且主要位于非编码区。
本研究对行业和临床的启示
本研究首次在灵长类动物中实现了DMD的快速建模与高效基因治疗验证,为DMD患者提供了具有临床转化潜力的“单切、单载体、系统性”治疗策略,标志着基因编辑治疗DMD迈出关键一步。

本研究中使用的AAV载体信息:

派真生物有幸为本研究提供了AAV病毒包装服务,助力该突破性研究成果的产生。
关于派真
作为一家专注于AAV 技术十余年,深耕基因治疗领域的CRO&CDMO,派真生物可提供从载体设计、构建到 AAV、慢病毒和 mRNA 服务的一站式解决方案。凭借深厚的技术实力、卓越的运营管理和高标准的服务交付,我们为全球客户提供一站式CMC解决方案,包括从早期概念验证、成药性评估到IIT、IND及BLA的各个阶段。
凭借我们独立知识产权的π-alphaTM 293 细胞AAV高产技术平台,我们能将AAV产量提高多至10倍,每批次产量可达1×10¹⁷vg,以满足多样化的商业化和临床项目需求。此外,我们定制化的mRNA和脂质纳米颗粒(LNP)产品及服务覆盖药物和疫苗开发的各个阶段,从研发到符合GMP的生产,提供端到端的一站式解决方案。