近年来,以腺相关病毒(AAV)为载体的基因治疗捷报频传,多款突破性药物成功获批上市,为罕见遗传病患者带来了希望。然而面对心肌梗死这类常见疾病时,AAV却显得”力不从心”。症结在于:现有的AAV就像”只有油门没有刹车”的汽车——基因一旦表达,就无法控制它在何时开启、在哪里发挥作用、以及表达到什么程度。这种”失控”的风险,成为阻碍AAV基因治疗从罕见病走向常见病、从粗放治疗迈向精准医疗的最大技术瓶颈。
心肌梗死等缺血性心脏病是全球头号”杀手”。心肌梗死后心肌细胞大量丢失,残存的心肌难以代偿,最终导致心功能衰竭。科学家其实早已找到能让心肌细胞重新增殖的关键基因,但这些”种子”用少了不起效,用多了会致命。以明星再生因子YAP5SA为例,它确实能强力启动心肌细胞分裂,让受损的心脏长出新细胞,但如果让它持续表达,心肌细胞就会疯狂增殖,心脏越长越厚,最终导致心源性猝死。这就像给心脏踩了油门却没有刹车,结果”好心办了坏事”。这种”要么无效、要么致命”的困境,让无数心脏再生疗法止步实验室。破局的关键在于:能否给基因装上精准”开关”,让它们完成任务后及时”退场”?
2025年6月,北京大学血管稳态与重构全国重点实验室郭宇轩/董尔丹研究员团队在Nature Cardiovascular Research杂志上发表了题为”The drug-elicitable alternative splicing module for tunable vector expression in the heart“的研究论文,为这一难题提供了突破性解决方案。该研究基于FDA已批准的药物,开发了具有自主知识产权的基因开关技术DreAM (Drug-elicitable alternative splicing module),在小鼠心梗模型中实现了对心肌再生时间、强度和位置的精准控制,成功避免了持续表达导致的猝死和肝癌风险。

研究亮点
- 首创DreAM基因开关技术: 基于FDA批准的小分子可变剪接调节剂Risdiplam,开发了具有自主知识产权的AAV基因表达调控技术DreAM。该系统精简至1.2 kb,完美适配AAV载体,实现了对基因表达超过2000倍的动态范围调控和2-3天的时间分辨率。
- 实现安全的心脏再生治疗: 利用DreAM系统精细控制YAP5SA的表达时间,仅短暂激活3-4天即可促进心肌细胞增殖、显著改善心梗后心脏功能、减少心脏纤维化,同时完全避免了持续表达YAP5SA导致的心源性猝死。
- 解决肝脏脱靶安全性问题:创新性地结合肌肉向性衣壳MyoAAV和肝脏特异性miR-122靶序列,在保留心脏治疗效果的同时,成功消除了AAV在肝脏的泄漏表达及长期致瘤风险。
- 拓展AAV基因治疗应用前景:DreAM技术实现了原有技术难以企及的对AAV基因表达在时间、空间和表达水平上的精细调控,有潜力改变AAV在基础和转化研究中的现有应用模式,为全新形态的基因治疗策略开辟道路。
主要研究结果
1. DreAM技术的开发
为了实现对AAV基因表达的时空精准调控,研究团队选择了FDA批准的小分子药物Risdiplam作为”开关”分子。Risdiplam最初获批用于脊髓性肌萎缩症治疗,其作用原理是诱导含有特定核酸序列的RNA片段(假外显子,PSE)发生选择性剪接,从内含子变成外显子(图1)。
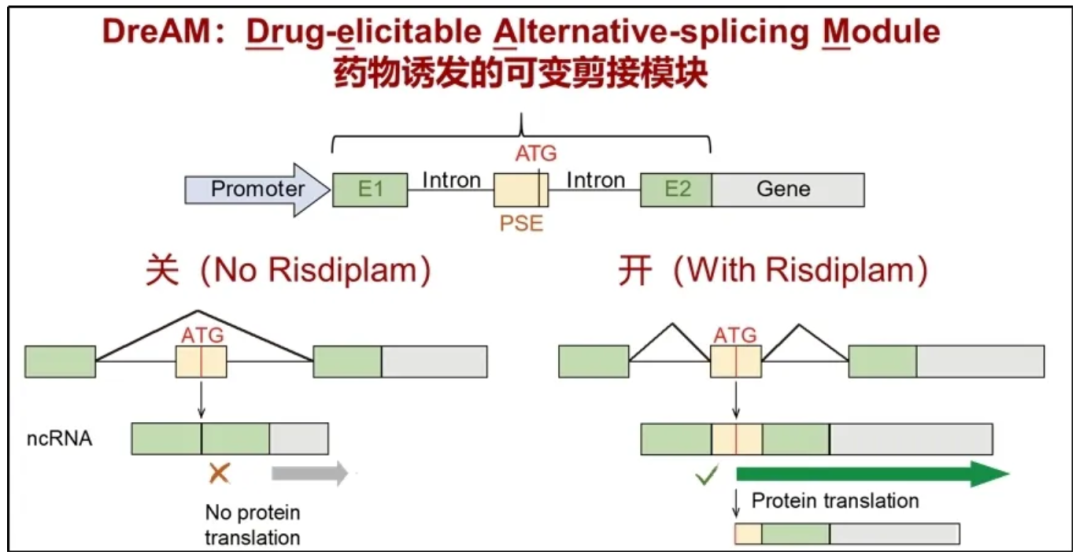
图1. DreAM技术原理图。 DreAM为一段含有[外显子1-内含子-假外显子-内含子-外显子2]的核酸序列,其中假外显子受Risdiplam调控且包含唯一的蛋白翻译起始位点ATG。无药物时:细胞将假外显子当作”垃圾”剪掉,mRNA中没有ATG,基因无法表达(开关关闭)。加入Risdiplam后:细胞将假外显子保留下来,mRNA获得ATG,基因开始表达(开关开启)。
研究团队首先用Risdiplam处理小鼠48小时后取心脏进行RNA-Seq差异剪接分析,筛选出7个可被Risdiplam诱导RNA剪接变化的候选元件。随后对这些候选基因进行工程化改造:(1)保留RNA剪接过程中的三个关键剪接位点——5’剪接位点(5’SS)、3’剪接位点(3’SS)以及位于3’SS上游18-40 nt的分支位点(Branch points, BP),删除其余部分;(2)删除所有外显子中的起始密码子(ATG),仅保留Risdiplam激活的假外显子序列中的一个ATG。基于此设计的调控元件能通过响应Risdiplam保留包含ATG的假外显子,从而控制蛋白质的翻译起始(图2)。
通过构建GFP报告基因质粒在细胞中进行筛选,研究团队最终获得了来自Zfr基因、基因调控倍数最高的元件,命名为DreAM(Drug-elicitable Alternative-splicing Module,即药物诱发的可变剪接模块)。这种基于内源性RNA剪接机制的”无蛋白”设计避免了传统化学诱导系统的免疫原性问题,且体积小巧(仅1.2 kb),不含外源转录因子,为临床转化铺平了道路。
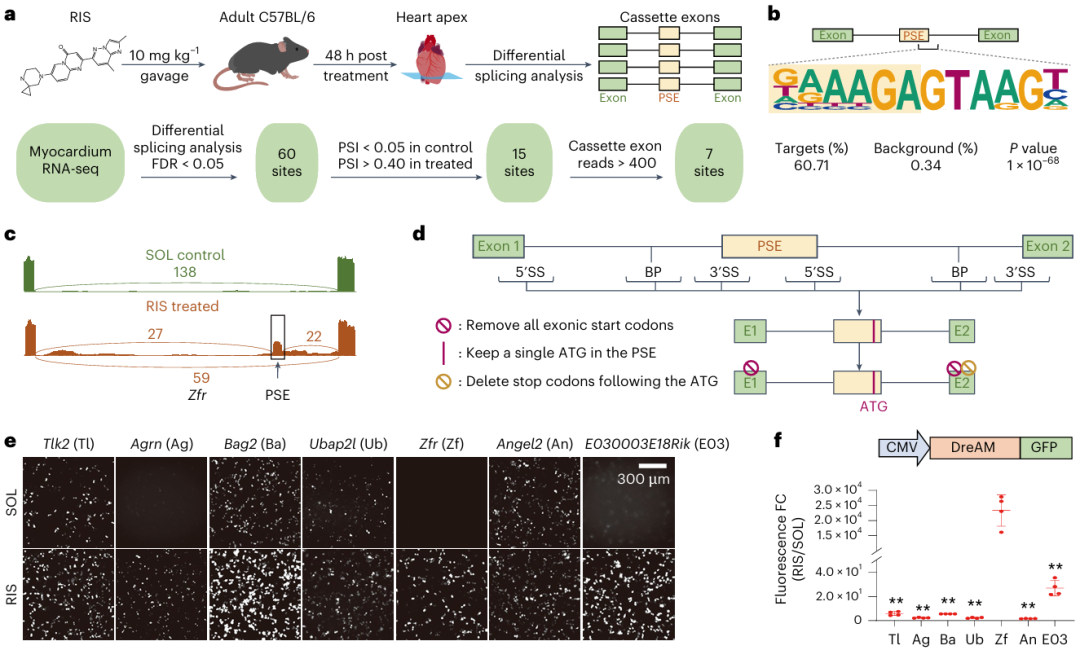
图2. DreAM技术的开发
2. AAV-DreAM载体的体内精准调控能力验证
为了评估DreAM是否能在体内对AAV基因进行精细调控,研究团队包装了AAV-CMV-DreAM-GFP载体,通过皮下注射至出生后1天(P1)的小鼠体中,从动力学和量效关系两方面系统评估了DreAM系统在体内调控AAV基因表达的特征。
结果显示,在动力学方面,单次给药Risdiplam后,DreAM可在1天内诱导心脏、肝脏和骨骼肌中基因表达达到峰值(心脏中超500倍,骨骼肌中超2500倍),并在3-5天内迅速回落至基线水平,时间分辨率达2-3天(图3)。
在量效关系方面,AAV-DreAM基因表达与Risdiplam的剂量呈正相关,且在心脏和骨骼肌中具有良好的基因表达量调控幅度。
为了验证DreAM在成体动物中能否长期反复调控基因表达,研究团队构建了心脏特异性的AAV-Tnnt2-DreAM-Luciferase载体并注射到成年小鼠体内。随后在0.5个月、1.5个月、3.5个月三个时间点反复给药并进行活体成像。结果显示,每次给予Risdiplam都能成功”点亮”心脏的荧光素酶信号,证明DreAM开关可在体内反复开启,为慢性疾病的长期管理提供了技术基础。
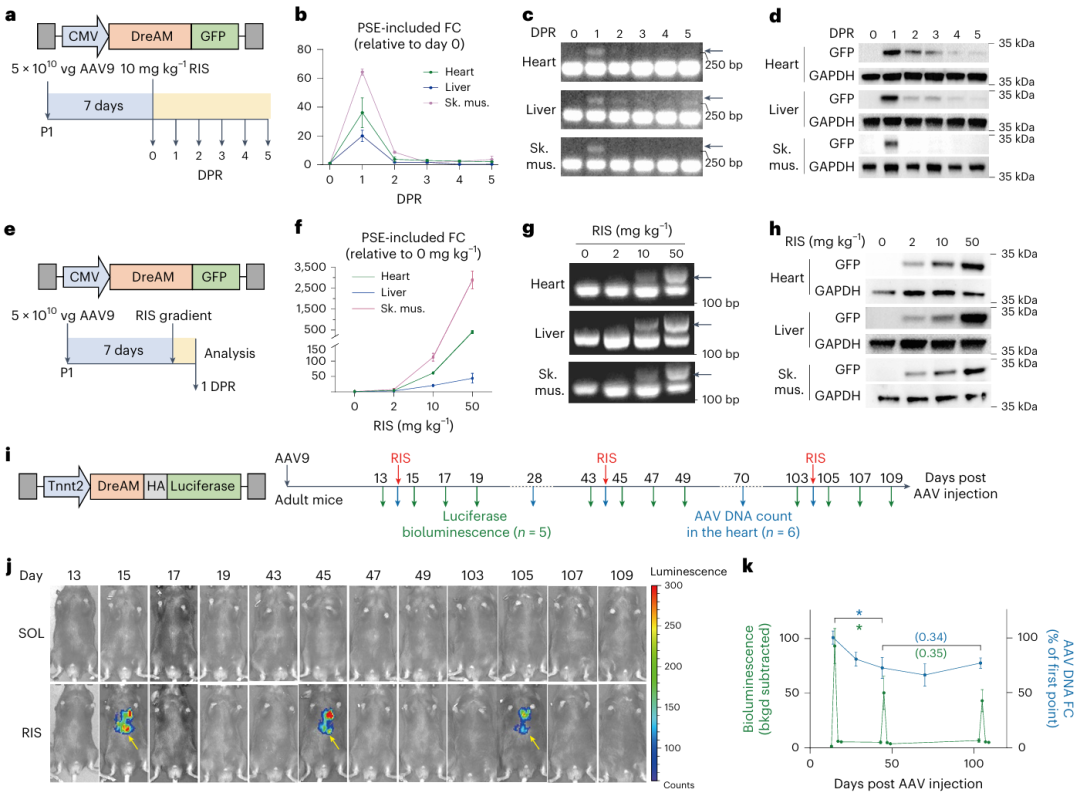
图3. DreAM作为Risdiplam的响应性开关,实现AAV基因表达的动态可逆调控
然而,研究团队发现AAV9-Tnnt2-DreAM存在”脱靶”问题——基因不仅在心脏表达,也在肝脏泄漏表达,这是因为AAV9病毒和Risdiplam药物在肝脏的富集都超过了心脏。为此,团队设计了两套”纠偏”方案:方案一,在基因序列中植入肝脏特异性miR-122靶点(miR122TS),让肝脏自身的miRNA把泄漏的mRNA”清理”掉;方案二,更换病毒”外壳”——使用对心脏亲和力更高的MyoAAV衣壳替代AAV9。结果显示,两种方法都成功将基因表达“锁定“在心脏,大幅减少了肝脏泄漏(图4)。

图4. 消除DreAM元件的肝脏泄漏
3. AAV-DreAM调控YAP5SA表达实现可控的心肌细胞增殖
研究团队构建了AAV-Tnnt2-DreAM-YAP5SA载体,在新生期小鼠中验证DreAM能否有效调控YAP5SA的表达时间,以避免其长期过表达引发的不良事件(如心源性猝死)。在出生后1天(P1)递送AAV后,第7天开始连续4天给予Risdiplam(灌胃给药,每天一次)。结果显示,DreAM元件能有效响应Risdiplam,调控细胞核内YAP5SA的表达。在无Risdiplam激活的情况下,DreAM元件可有效防止因YAP5SA过表达导致的小鼠死亡,这与常规AAV-YAP5SA在5-11天内引起100%动物死亡形成鲜明对比(图5)。
而在Risdiplam激活DreAM元件时,心脏YAP5SA表达增强,小鼠表现为心脏收缩功能改善、心室壁增厚、心室腔缩小,心肌细胞横截面积减小,表达增殖标志物Ki67的心肌细胞数量显著增多。这些结果表明,DreAM元件能有效调控YAP5SA在小鼠心脏组织中的表达时长及其介导的心肌细胞增殖程度,为安全的心脏再生治疗奠定了基础。

图5. DreAM可调控YAP5SA表达,避免心肌过度增生导致的小鼠死亡
4. AAV-DreAM-YAP5SA载体治疗小鼠心肌梗死的有效性与安全性
研究团队在成年小鼠心肌梗死模型中系统评估了DreAM技术的治疗潜力。首先,向心梗后3天的小鼠体内递送常规AAV-YAP5SA载体(阳性对照组),结果显示该载体能部分恢复小鼠心脏收缩功能,使心室壁增厚,但在心肌梗死17-20天时小鼠全部死亡,再次证实了YAP5SA长时程过表达的严重副作用。
接下来,研究团队向心梗后3天的小鼠递送包含DreAM元件的AAV-YAP5SA载体,在心梗后第8-9天连续两天给予Risdiplam,控制YAP5SA仅表达3-4天。在此条件下,DreAM调控的YAP5SA短暂表达使小鼠心功能明显恢复,心脏纤维化面积减少,并且能有效避免小鼠死亡(图6)。EdU掺入实验显示增殖细胞主要聚集在梗死边界区,与AAV转导区域高度吻合,证明DreAM实现了空间上的精准调控。这些结果充分证实了AAV-DreAM-YAP5SA载体对小鼠心梗表型具有显著的缓解能力,并且该治疗策略不会造成心肌细胞过度增殖和动物死亡。
然而,AAV9和YAP可能导致肝损伤和肝脏肿瘤的发生,AAV9-DreAM-YAP5SA载体的肝脏泄漏表达存在长期安全性隐患。为了解决这一关键问题,研究团队将DreAM整合至心肌细胞特异性、肝脏去靶向的AAV9-Tnnt2-miR122TS载体中,对Risdiplam激活YAP5SA表达4个月后的小鼠肝脏进行评估。结果显示,递送常规AAV9-DreAM-YAP5SA的小鼠(6/6)出现明显的肿瘤病变,肝脏肿瘤生物标志物升高,而引入miR122TS后有效消除了肝脏肿瘤的发生(0/6),也降低了肝脏肿瘤生物标志物的表达。重要的是,miR122TS不影响AAV9-DreAM-YAP5SA对心肌细胞增殖的促进作用,实现了“心脏获益、肝脏安全”的精准治疗。
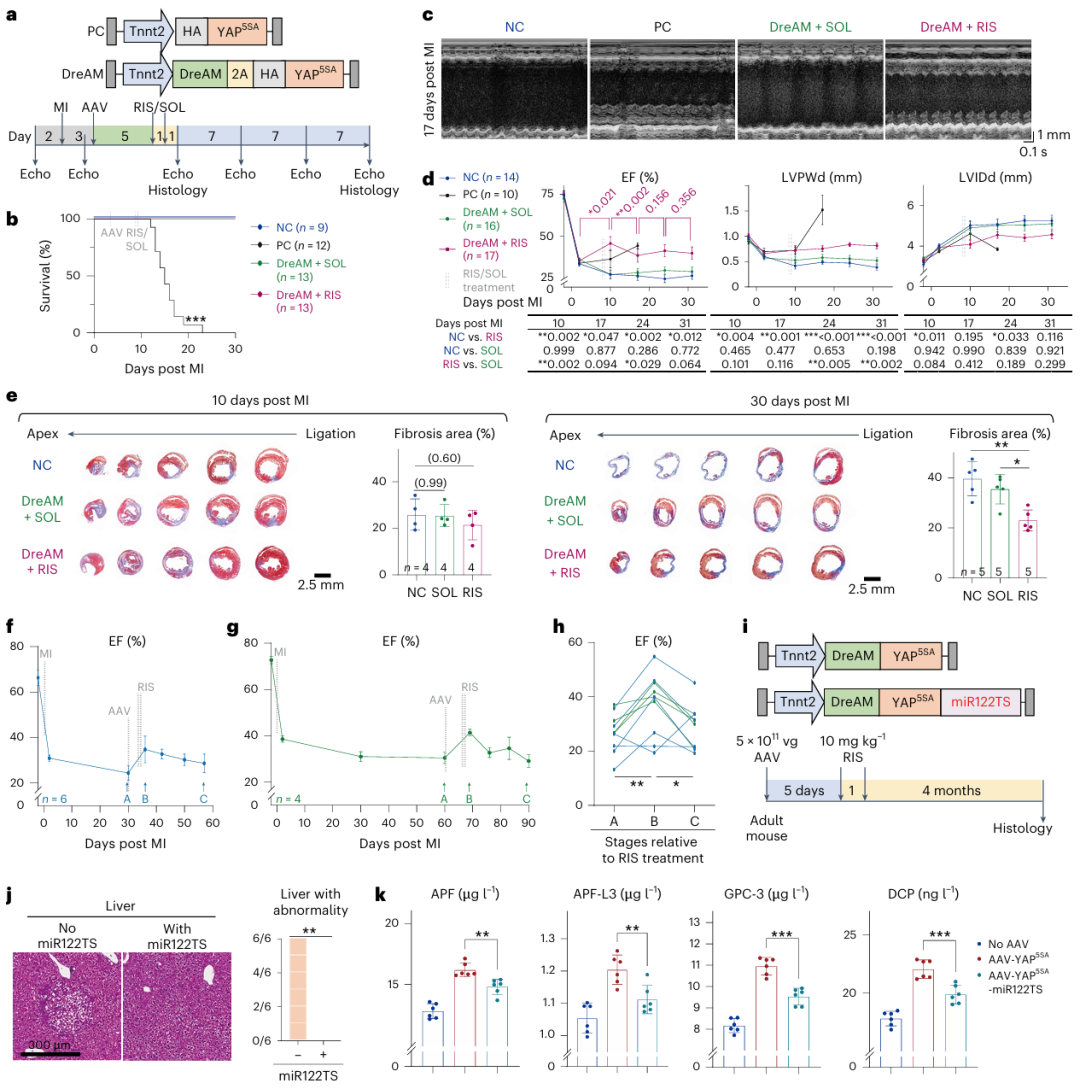
图6. DreAM实现YAP的瞬时激活,在改善心肌梗死相关心功能障碍的同时,避免了肝脏脱靶致瘤
研究意义
本研究利用FDA批准的RNA剪接调控药物Risdiplam,开发了新型基因开关DreAM,实现了AAV基因表达在时间、剂量和组织特异性上的精准调控。该技术为AAV基因治疗提供了全新的调控策略,并首次证明药物诱导型开关能够同时提升AAV疗法的有效性和安全性。
DreAM作为模块化平台,可与组织特异性启动子、miRNA靶序列、组织靶向性衣壳等元件灵活组合,构建多层次调控网络。更重要的是,其响应药物Risdiplam已获FDA批准且临床安全性明确,这为DreAM的临床转化扫清了关键障碍。
DreAM有望重塑AAV基因治疗的应用范式。从心脏再生到基因补充疗法、肿瘤治疗和代谢病,它提供了一个通用工具——在恰当时机、靶向组织、以适宜剂量表达治疗基因,实现传统方法无法企及的精准治疗。
派真助力——AAV包装
| 基因信息 | DreAM-GFP,DreAM-HA-Luciferase,DreAM-HA-YAP5SA,DreAM-P2A-HA-YAP5SA-miR122TS |
| 血清型 | AAV9,MyoAAV |
| 启动子 | Tnnt2,CMV |
| 实验动物 | C57BL/6 小鼠(新生鼠:P1;成年鼠:6–10 周) |
| 注射方式 | 新生鼠:皮下注射,5×1010 vg / 只 |
| 成年鼠:尾静脉注射,5×1011 vg / 只 |
派真助力——慢病毒包装
| 基因信息 | SFFV-DreAM-GFP |
| 启动子 | SFFV |
| 体外感染细胞 | HEK293T、HeLa、MDBK 等 |
研究团队介绍
本研究由北京大学血管稳态与重构全国重点实验室PI郭宇轩研究员和董尔丹研究员为共同通讯作者。北京大学基础医学院博士研究生陈展、杨璐梓为共同第一作者。该研究获得了北京大学基础医学院赵东宇教授、张岩教授、郑乐民教授、周菁教授和北京大学药学院的苗蕾教授、陈卫老师的大力支持。波士顿儿童医院William T. Pu教授、贝勒医学院James F. Martin教授和孟凡森博士、首都医科大学附属安贞医院高霏教授、四川大学华西第二医院李一飞教授为本研究提供了重要帮助。该研究获得”四大慢病”重大专项、北京市自然科学基金”非共识”创新项目和北京基驭医疗科技有限公司的大力资助。
参考资料来源
1. Chen Z, Yang L, Zhang Y, et al. The drug-elicitable alternative splicing module for tunable vector expression in the heart. Nature Cardiovascular Research, 2025. DOI: 10.1038/s44161-025-00665-7
2. https://mp.weixin.qq.com/s/1UK_9Bjyr7Y_yzHhy6tHpg
关于派真
作为一家专注于AAV 技术十余年,深耕基因治疗领域的CRO&CDMO,派真生物可提供从载体设计、构建到 AAV、慢病毒和 mRNA 服务的一站式解决方案。凭借深厚的技术实力、卓越的运营管理和高标准的服务交付,我们为全球客户提供一站式CMC解决方案,包括从早期概念验证、成药性评估到IIT、IND及BLA的各个阶段。
凭借我们独立知识产权的π-alphaTM 293 细胞AAV高产技术平台,我们能将AAV产量提高多至10倍,每批次产量可达1×10¹⁷vg,以满足多样化的商业化和临床项目需求。此外,我们定制化的mRNA和脂质纳米颗粒(LNP)产品及服务覆盖药物和疫苗开发的各个阶段,从研发到符合GMP的生产,提供端到端的一站式解决方案。