一、研究背景
基因治疗为许多遗传性疾病患者带来了希望,以 AAV9 为代表的重组腺相关病毒载体(rAAV)在脊髓性肌萎缩症(SMA)、杜氏肌营养不良(DMD)等罕见病治疗中屡创奇迹。然而,预存免疫仍然是AAV基因治疗的主要障碍。30-80%的成年人体内存在针对常见AAV血清型(如AAV2、AAV9等)的中和抗体(NAbs)。初次给药后,患者还会产生高滴度、持久的 NAbs,使重复给药更加困难。若给免疫阳性患者注射 AAV,会因载体被中和及转导组织出现 T 细胞浸润而显著降低疗效,甚至诱发血栓性微血管病、非典型溶血尿毒综合征等严重不良反应。
目前最常见的应对策略是排除血清阳性患者,但高阳性率大幅缩小了适应人群。研究显示,45% 的 AAV 临床试验排除 NAbs 阳性受试者,血液病试验中这一比例超过 90%。
另有研究采用利妥昔单抗清除 B 细胞或雷帕霉素抑制 T 细胞等免疫抑制方案,但这些药物副作用明显,且无法完全避免免疫介导的毒性。
如何打破这一僵局?科学家们将目光投向了进化的远端。
近日,杜克大学 Aravind Asokan 团队在国际著名期刊《Cell Reports Medicine》 上发表了题为 “Complete neutralizing antibody evasion by serodivergent non-mammalian AAVs enables gene therapy redosing”的文章。该研究利用非哺乳动物来源的 AAV(Non-mammalian AAVs),开发出了一种具有免疫逃逸能力、血清学上高度差异化的新型载体 AAV.div3A,并成功实现了基因治疗的重复给药。这一突破为那些因抗体阳性而无法治疗,或急需二次治疗的患者打开了新的希望之门。

二、主要研究方法和研究结果
1.构建多样性的Dependoparvovirus衣壳文库
这项研究的核心逻辑在于:灵长类来源的 AAV 同源性太高,抗体容易发生交叉反应。如果使用进化距离极远的鸟类或爬行类病毒,人体的免疫系统是否就会“视而不见”?因此,研究团队首先构建了一个由多种且分化显著的非灵长类依赖性细小病毒(Dependoparvovirus)分离株组成的文库(AAV.div library)。
研究者对435个Dependoparvovirus的VP1序列进行主成分分析和K-means聚类,从非灵长类分支中选择16个候选衣壳,它们与灵长类AAV的VP1相似度最高仅60%,彼此间相似度不超过73%(图1)。
先前研究发现,非哺乳动物 AAV 无法转导人细胞,但把灵长类 AAV VP1 的 40 个氨基酸 N 端移植过去即可恢复转导;AAV2 或 AAV8 N 端效果相近,而 AAV5 或海狮 AAV N 端则改变嵌合特性,使其能转导 GPR108 缺失细胞。为捕获更大序列多样性和生物学差异,研究团队采用矩阵策略,将 5种N端结构域(来自AAV2/AAV5/AAV8/海狮AAV/野生型)分别与 16 个候选衣壳组合,共构建80个嵌合衣壳。每个衣壳配套携带唯一的10核苷酸条形码的自身互补型CBh-GFP-barcode ITR质粒。
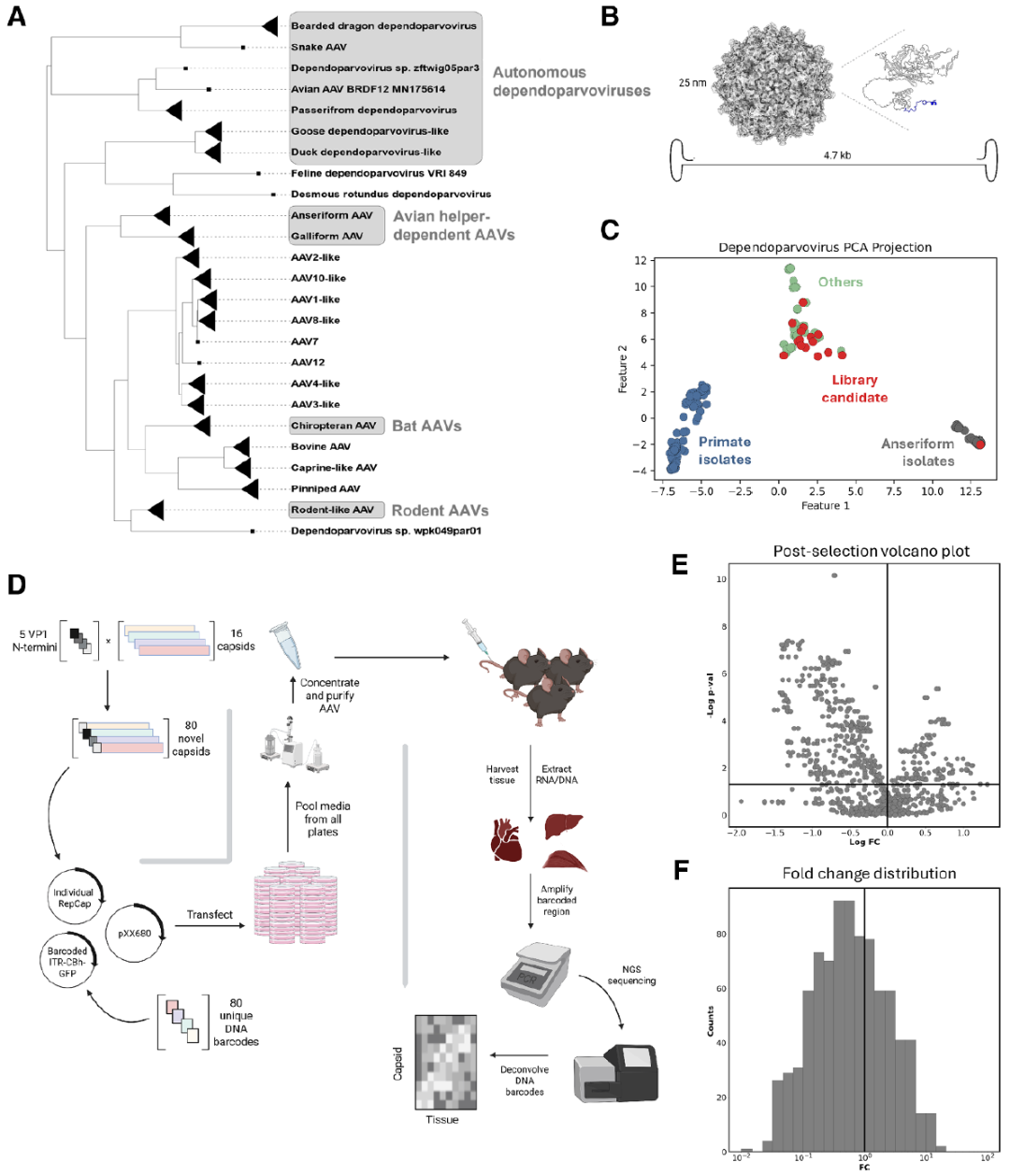
图1. 依赖性细小病毒(Dependoparvovirus)衣壳文库的设计与筛选。(A) 依赖性细小病毒属的最大似然系统发育树。基于294株依赖性细小病毒的Rep78序列,使用IQ-TREE推断其亲缘关系。根据序列相似性将病毒株划分为不同亚支。灰色框表示被选入衣壳矩阵的支系。(B) 代表性依赖性细小病毒的结构与基因组,突出显示N端结构域。(C) 依赖性细小病毒VP1蛋白序列的主成分分析(n = 435)。采用K-means聚类。蓝色为AAV2样病毒株,灰色为雁形目依赖性细小病毒样病毒株,绿色为其他依赖性细小病毒株。矩阵候选者以红色标记。(D) 衣壳矩阵条形码筛选示意图。将16种AAV衣壳与5种VP1 N端序列的DNA序列进行组合克隆,共获得80种衣壳序列。每种衣壳使用独特的条形码ITR质粒,在2个15 cm皿的HEK293细胞中进行三质粒共转染。转染后第3天和第7天收集培养基并合并,最终纯化为单一病毒库。向3只雌性C57BL/6J小鼠尾静脉注射5×10¹³ vg/kg的混合AAV文库;细胞实验以1×10⁵ vg/细胞的剂量进行三个重复感染。小鼠在14天后处死,细胞在感染后48小时收集。提取DNA和RNA后,扩增AAV基因组中的条形码区域并进行NGS测序。通过分析条形码,确定筛选前后每种衣壳的相对丰度。(E) 衣壳文库火山图。数据跨重复实验和组织/细胞类型合并。倍数变化(fold change)定义为筛选后文库中某衣壳占比与输入文库中占比的比值。(F) 倍数变化(FC)直方图。数据跨重复实验和组织/细胞类型合并。倍数变化定义为筛选后文库中某衣壳占比与输入文库中占比的比值。
2.体内外高通量筛选后,AAV.div3A脱颖而出
NGS测序结果显示,在不同组织和细胞中,表现最佳的衣壳来自番鸭(Muscovy duck)AAV。病毒生产定量结果显示,番鸭AAV/AAV2 N端嵌合体(AAV.div3A)在产量和载体质量上与AAV9标准对照相当;结构建模显示,番鸭来源的衣壳与灵长类来源的衣壳表面差异巨大,表面可变区(VR)发生了明显搅动。这些表面扰动区域正是灵长类 AAV 介导受体结合与中和抗体识别的关键位点。
AAV.div3A 或 AAV9(均包装 ss-CBh-Luc-P2A-GFP)小鼠体内研究结果显示,心脏、骨骼肌和肝脏均检测到强劲的荧光素酶表达,脑、肾、脾亦有信号。多数组织间 AAV.div3A 与 AAV9 转导水平无统计学差异,仅心脏略低于 AAV9(图2)。
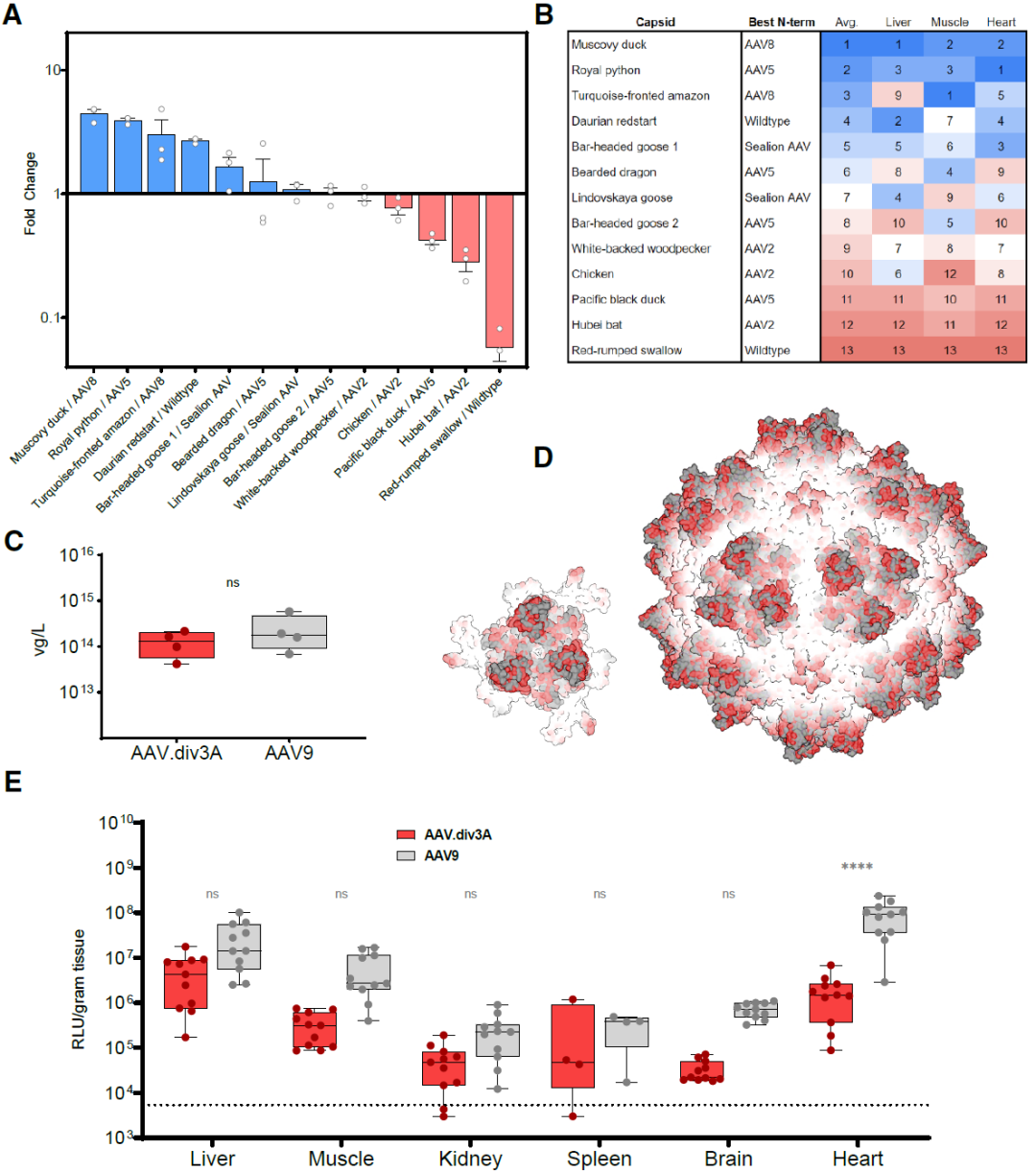
图2. 文库筛选确定 AAV.div3A 为表现最佳的嵌合衣壳。(A) 衣壳富集分析。取每种衣壳在体内表现最佳的 N 端片段,计算其在肝脏、骨骼肌和心脏组织中的平均 RNA 富集倍数(FC)。以腓肠肌作为骨骼肌代表组织。若某衣壳在文库输入中的占比低于 0.015%,则剔除。(B) 衣壳排序。依据“体内表现最佳的 N 端片段”的 RNA 富集倍数,为每种衣壳确定相对排名。输入占比 <0.015% 的衣壳被排除。生物学重复取均值作图。(C) 病毒产量比较。对 AAV.div3A 与 AAV9 分别进行 4 次独立制备:每次用 10–20 盘 15 cm HEK293 细胞,每盘共转染 12 μg pXX680、10 μg pLH-RepCap 和 6 μg ITR 质粒。第 3 天和第 7 天收集体外培养液与细胞,经 PEG 沉淀、碘克沙醇超速离心及换液浓缩纯化。以 qPCR 检测 ITR 拷贝数定量,并将总产量按每盘细胞数归一化。(D) 结构对比。将 AAV.div3A(红色)与 AAV9(灰色)衣壳或三聚体叠加显示,以突出表面结构差异。AAV.div3A 衣壳由 AlphaFold3 预测的 VP3 结构经 CapBuild 构建,并用 ChimeraX 可视化(pTM = 0.92);AAV9 衣壳结构取自 PDB 7MT0。(E) 体内转导实验。雌性 C57BL/6J 小鼠经尾静脉注射包装 ss-CBh-Luc-P2A-GFP 的载体,剂量 5×10¹³ vg/kg。6 周后处死,通过荧光素酶活性测定转导效率,仍以腓肠肌作为骨骼肌代表。虚线表示未转导组织的背景发光值。
3.AAV.div3A的血清学特征:零交叉反应,零血清流行率
4.AAV.div3A 可逃避预先存在的中和抗体及载体诱导的免疫反应
为了评估 AAV.div3A 在体内的免疫逃避能力,研究团队在小鼠体内进行了被动免疫和载体诱导的免疫实验。
被动免疫实验:先给小鼠腹腔注射“AAV9 中和抗体阳性人血清”,72 h 后再尾静脉注射 5×10¹³ vg/kg 的 AAV9 或 AAV.div3A。不同组织的转基因表达与分布结果显示,AAV9 组心脏、肌肉、脑的荧光素酶信号被完全“中和”,跌至背景以下,相比之下,AAV.div3A 组各组织表达丝毫未降,全面碾压 AAV9。
载体诱导的免疫实验:先用 5×10¹² vg/kg “空壳” AAV9 给小鼠“预免疫”6 周,再分别追加 AAV9 或 AAV.div3A(同剂量、包装 ss-CBh-Luc-P2A-GFP)。结果显示,二次给 AAV9,转导效率完全丧失,转基因水平比未免疫小鼠低 >99%。相比之下,二次给 AAV.div3A,所有组织依旧高表达,肝脏信号甚至反超对照。
5.理性改造 AAV.div3A 衣壳提升组织特异性
针对杜氏肌营养不良、庞贝病等肌肉疾病治疗需求,研究团队采用理性设计策略,在 AAV.div3A 的 VR8 区插入含 RGD 的肽段,旨在通过衣壳改造提升其肌肉特异性。体外细胞筛选显示,携带 MyoAAV 4A 序列的 AAV.div3A-M4 表现最为抢眼,在成肌细胞中的转导效率较亲本提升了 20 倍(图3)。
然而,体内实验呈现了截然不同的结果。在小鼠尾静脉注射后,细胞实验中表现优异的 M4 突变体并未在体内显著提升转导效率;反而是采用本组前期序列的 AAV.div3A-M1 脱颖而出。M1 突变体在心脏和膈肌的转基因表达分别提升了 14 倍和 12 倍,同时实现了显著的肝脏“去靶向”效果,肝内基因组减少 95%,心脏/肝脏表达比值高达 13 倍,展现出卓越的肌向性。
进一步研究发现,这种增强效应具有严格的位点依赖性,M1 肽段仅在插入 VR8 区时有效。免疫学评估表明,虽然单纯的肽段插入并未赋予载体额外的抗体逃逸能力,但也未引发异常的中和或交叉反应,证明了该改造策略的安全性与潜力。
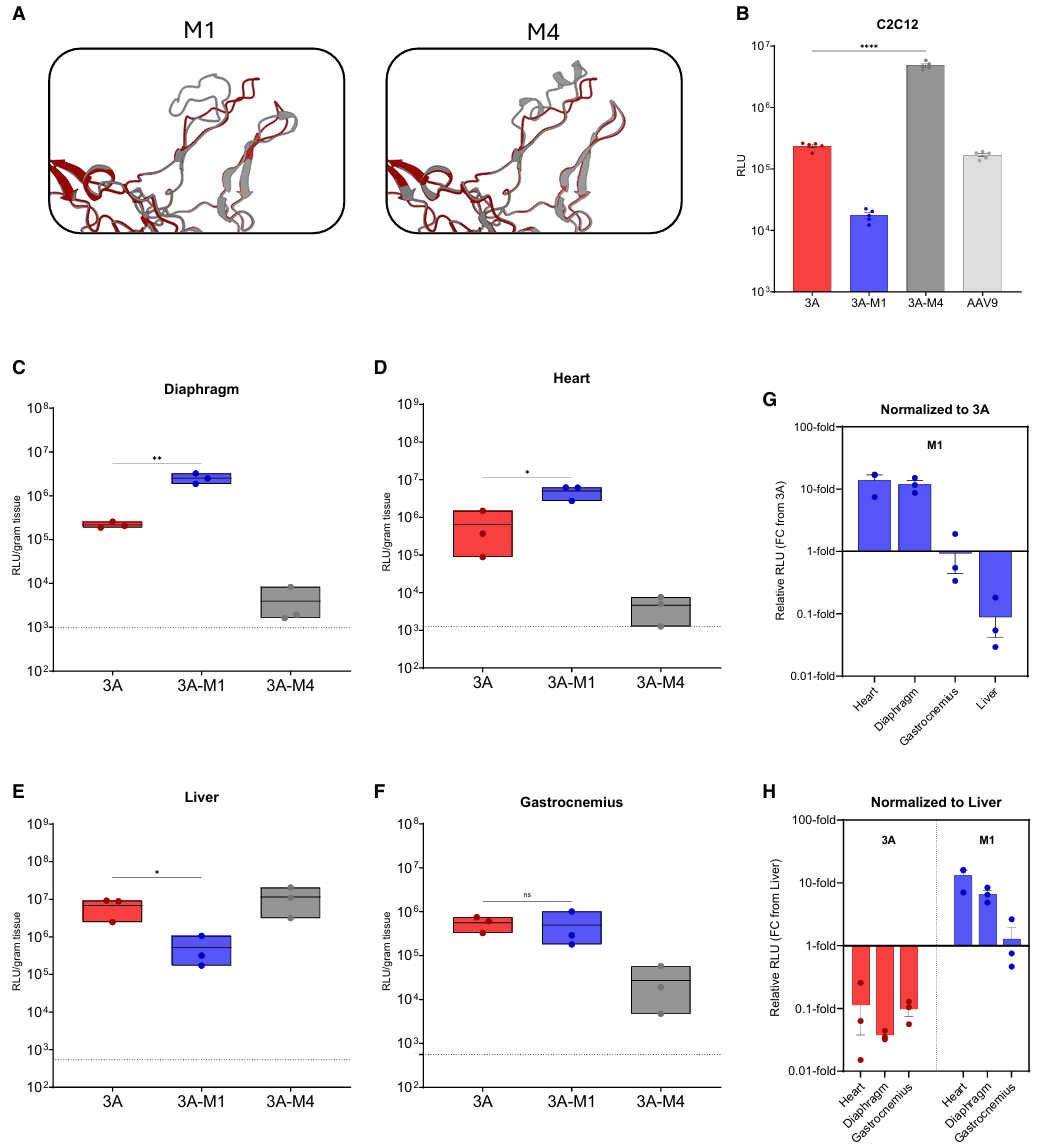
图3. 理性改造 AAV.div3A 衣壳获得肌向变异体。(A) AlphaFold3 预测的 VR8 环结构。左侧红色为 AAV.div3A,灰色为 AAV.div3A-M1;右侧灰色为 AAV.div3A-M4。(B) 体外转导。以 5×10⁴ vg/cell 的 MOI 感染C2C12 细胞,72 h 后行荧光素酶检测。(C–F) 体内转导。雌性 C57BL/6J 小鼠尾静脉注射 5×10¹³ vg/kg 剂量,6 周后取膈肌 (C)、心脏 (D)、肝脏 (E) 及腓肠肌 (F) 行荧光素酶检测;虚线为背景发光值。(G) 各组织中 AAV.div3A-M1 转导值相对于 AAV.div3A 的比值。(H) AAV.div3A 与 AAV.div3A-M1 在各组织的转导值分别以其自身肝脏值为基准进行归一化。
6.AAV.div3A 在庞贝病小鼠模型中实现治疗性二次给药
为了验证 AAV.div3A 在临床治疗中的实际潜力,研究团队将目光投向了庞贝病——一种需长期管理的常染色体隐性遗传病。由于临床上首次 AAV 治疗后常因载体稀释或基因沉默导致疗效衰减,开发能够有效“二次给药”的载体成为了攻克此类疾病的关键。
研究者在幼年庞贝病小鼠中模拟了这一临床难题:在首剂 AAV9 治疗四周后进行二次注射。结果显示,重复给予 AAV9 的小鼠转基因表达不升反降;而采用 AAV.div3A 或其肌肉靶向性变体 div3A-M1 作为第二剂给药时,则显著提升了小鼠体内的 GAA 酶水平(图4)。
尤为值得关注的是 AAV.div3A-M1 的表现,它在重复给药场景下再次验证了卓越的肌肉靶向性优势。与单次治疗相比,它使膈肌和心脏的酶活性分别提升了 9 倍和 7 倍。这一结果有力证明,基于 AAV.div3A 的衣壳系统不仅能实现成功的治疗性再给药,更能通过精准的组织靶向,为此类遗传病的终身治疗提供了极具前景的新策略。

图4.基于 AAV.div3A 衣壳的庞贝病模型重复给药治疗研究。(A) GAA 重复给药实验流程。B6:129 背景 GAA 敲除小鼠经尾静脉注射 2×10¹² vg/kg的 ssAAV9-CBh-GAA;4 周后,再次尾静脉注射 2×10¹³ vg/kg的 AAV9、AAV.div3A 或 AAV.div3A-M1(均包装 ss-CBh-GAA),或给予 PBS 对照(每衣壳组 3 雌 2 雄)。第 10 周处死,取组织以 4-MUG 荧光法测定 GAA 活性。(B–E) 重复给药后的 GAA 活性。二次给药 6 周后,分别检测膈肌 (B)、心脏 (C)、肝脏 (D) 及腓肠肌 (E) 的 GAA 活性,数据以 nmol 底物·h⁻¹·mg 蛋白⁻¹ 表示。
三、讨论与总结
1.跨越物种界限
Dependoparvovirus 属在自然界中拥有极高的遗传多样性,涵盖禽类、爬行类等多种宿主,但因跨物种感染障碍,这一巨大宝库长期未被基因治疗领域开发。本通过一项简单而高效的策略——仅替换极小的 N 端结构域,便成功打破了这一壁垒,让源自番鸭的远缘病毒能在人类细胞中高效运作。筛选出的候选株 AAV.div3A 不仅转导强劲,更具备独特的生物学特征:它不依赖传统的 AAVR 受体进入细胞,这使其成为除 AAV4 外首个被证实拥有独立入胞机制的天然分离株。
2.天然的“隐身衣”:逃逸中和抗体与免疫记忆
AAV.div3A 的最大优势在于其独特的免疫学特性。由于它源自与哺乳动物亲缘关系较远的番鸭,其衣壳蛋白(VP1)与灵长类 AAV 的相似度仅为 59%。这种巨大的进化差异赋予了它天然的“隐身”能力:它不仅在人群中无预存免疫,更能在拥有高滴度 AAV9 抗体的小鼠体内实现高效转导,甚至表现出抗体依赖性的增强效应。这意味着,对于那些因体内存在中和抗体而被传统基因疗法拒之门外的患者,AAV.div3A 提供了一条全新的治疗路径。
3.规避 T 细胞攻击,实现安全的二次给药
除了体液免疫,细胞免疫也是阻碍 AAV 重复给药的主要障碍。通常,初次给药诱导的记忆 T 细胞会在二次给药时被激活,导致转基因表达丧失。然而,以 AAV.div3A 进行二次给药时,并未出现这种“免疫排斥”现象。生物信息学分析提示,这是因为引入的 N 端片段极小,且缺乏主要的 T 细胞抗原表位,从而巧妙地避开了 HLA 分子的呈递与识别,为治疗的持久性提供了安全保障。
4.从“隐身”到“精准”:理性设计的肌肉特异性
在拥有免疫逃逸的底盘后,通过在衣壳表面理性插入 RGD 肽段,获得了 AAV.div3A-M1 变体。该变体不仅继承了亲本的免疫逃逸能力,更获得了卓越的肌肉特异性——极大地提升了心脏和膈肌的转导,同时显著降低了肝脏富集。这种“血清学独立底盘 + 功能性肽段”的组合策略,在庞贝病模型中成功实现了治疗性酶水平的再次提升,证明了其临床应用价值。
四、前景与局限
- 新型衣壳筛选与验证:我们建立了完善的 AAV 衣壳筛选平台,可协助客户评估包括非灵长类 AAV 在内的新型衣壳在不同组织中的转导效率与靶向性。
- 免疫学分析服务:提供高灵敏度的中和抗体(NAb)检测服务,以及针对预存免疫的血清学分析,助力临床前研究的受试者筛选策略制定。
参考文献
Loeb, E. J., Fergione, S. A., Yudistyra, V., et al. (2025). Complete neutralizing antibody evasion by serodivergent non-mammalian AAVs enables gene therapy redosing. Cell Reports Medicine, 6, 102475. https://doi.org/10.1016/j.xcrm.2025.102475
关于派真
作为一家专注于AAV 技术十余年,深耕基因治疗领域的CRO&CDMO,派真生物可提供从载体设计、构建到 AAV、慢病毒和 mRNA 服务的一站式解决方案。凭借深厚的技术实力、卓越的运营管理和高标准的服务交付,我们为全球客户提供一站式CMC解决方案,包括从早期概念验证、成药性评估到IIT、IND及BLA的各个阶段。
凭借我们独立知识产权的π-alphaTM 293 细胞AAV高产技术平台,我们能将AAV产量提高多至10倍,每批次产量可达1×10¹⁷vg,以满足多样化的商业化和临床项目需求。此外,我们定制化的mRNA和脂质纳米颗粒(LNP)产品及服务覆盖药物和疫苗开发的各个阶段,从研发到符合GMP的生产,提供端到端的一站式解决方案。