

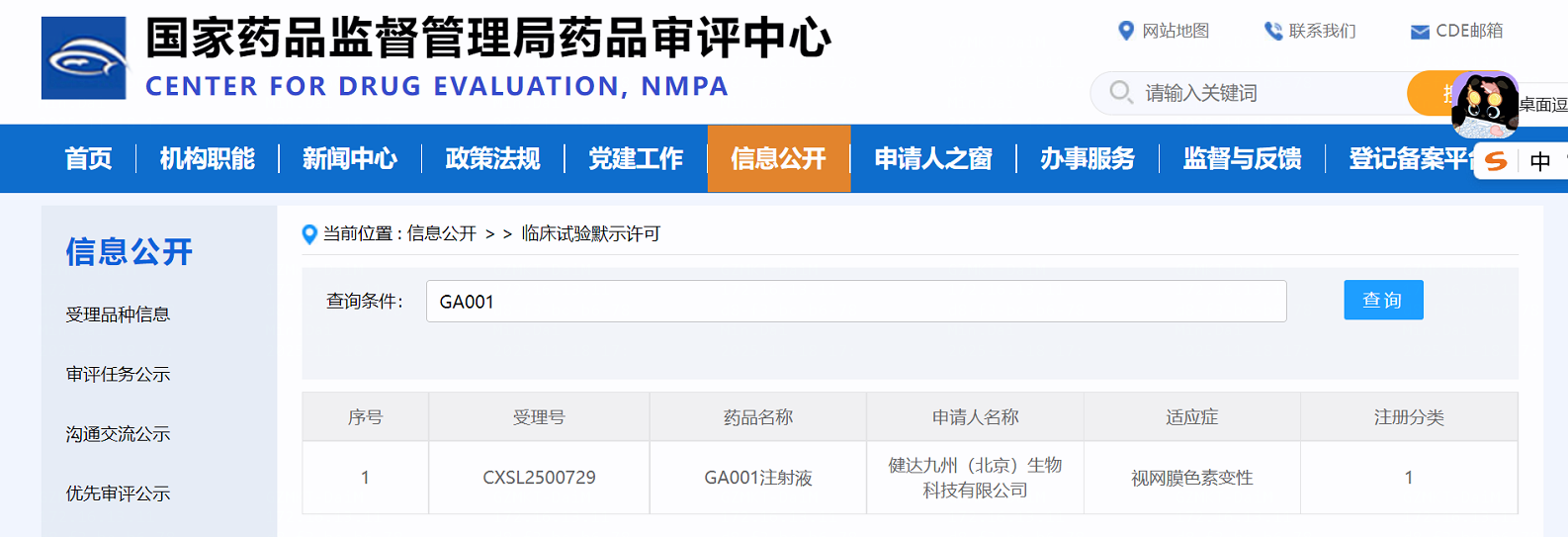
近日,健达九州(北京)生物科技有限公司(以下简称“健达九州”)自主研发的一类创新药——基因治疗药物GA001注射液(受理号:CXSL2500729),正式获得中国国家药品监督管理局药品审评中心(CDE)的临床试验默示许可,获批开展I/II期临床试验。作为战略合作伙伴,派真生物对这一里程碑成果表示诚挚祝贺!
关于GA001注射液
关于健达九州
健达九州由北京脑科学与类脑研究所所长罗敏敏教授创立,致力于开发针对中枢神经系统及眼科疾病的创新基因治疗方案。公司研发管线覆盖多种疾病,包括视网膜色素变性、癫痫、难治性疼痛、抑郁症、神经退行性疾病及恶性脑瘤等,旨在帮助患者恢复持久的神经功能,为患有难治性中枢疾病和眼科疾病的患者提供有效的治疗手段。
健达九州将继续秉持源头创新的理念,不断提升核心竞争力,致力于成为全球脑科学与眼科基因治疗领域的引领者,将生命科学领域的创新成果转化为改善人类健康的力量,为每个生命创造更美好的现在与未来。
关于派真
作为一家专注于AAV 技术十余年,深耕基因治疗领域的CRO&CDMO,派真生物可提供从载体设计、构建到 AAV、慢病毒和 mRNA 服务的一站式解决方案。凭借深厚的技术实力、卓越的运营管理和高标准的服务交付,我们为全球客户提供一站式CMC解决方案,包括从早期概念验证、成药性评估到IIT、IND及BLA的各个阶段。
凭借我们独立知识产权的π-alphaTM 293 细胞AAV高产技术平台,我们能将AAV产量提高多至10倍,每批次产量可达1×10¹⁷vg,以满足多样化的商业化和临床项目需求。此外,我们定制化的mRNA和脂质纳米颗粒(LNP)产品及服务覆盖药物和疫苗开发的各个阶段,从研发到符合GMP的生产,提供端到端的一站式解决方案。

