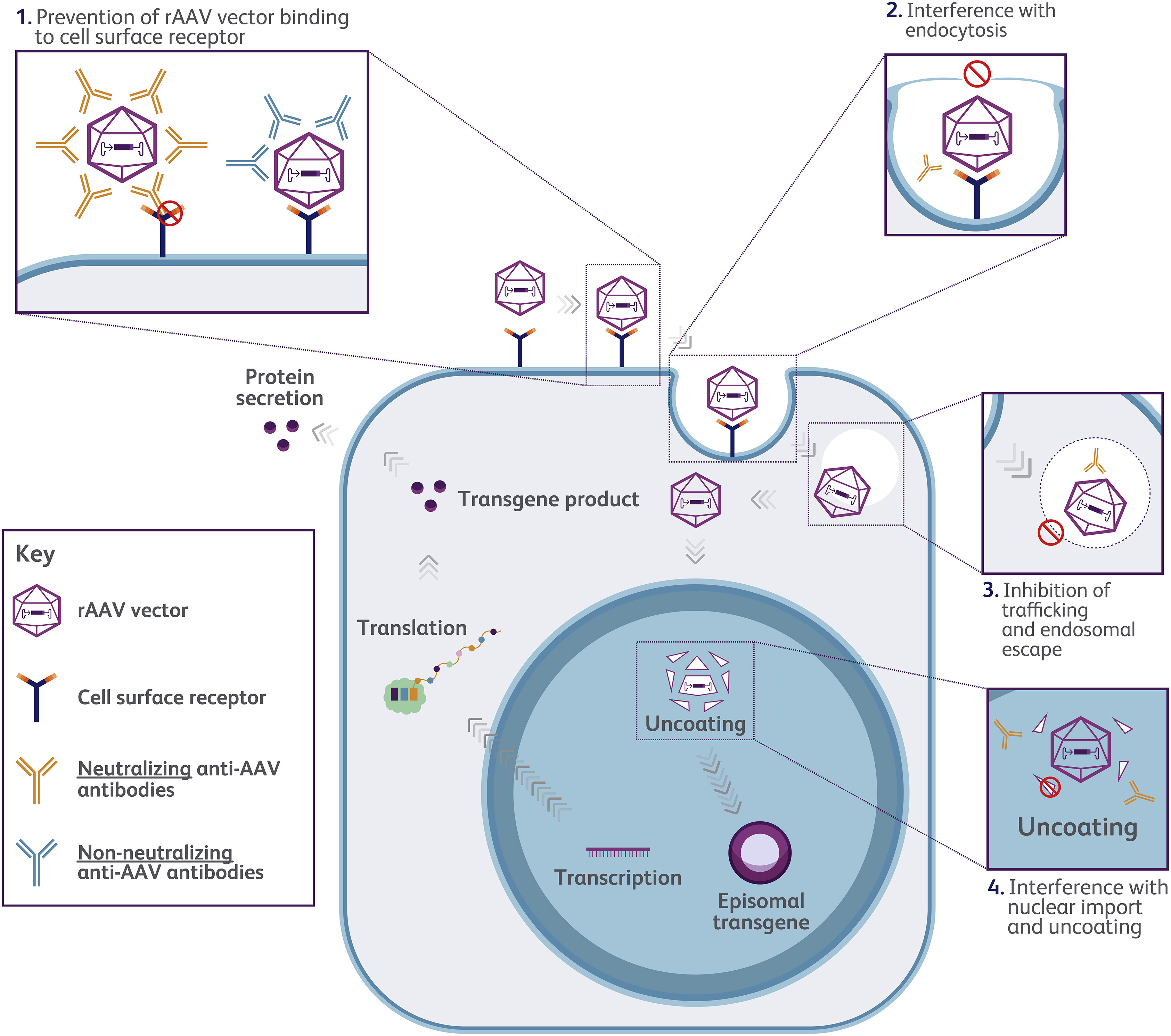
一、AAV抗体检测的基本分类
AAV抗体检测可分为两大类:
- 总抗体 (Total Antibody, TAb) 检测:检测能够与病毒颗粒结合的所有抗体,无论其是否具有中和活性。
- 中和抗体 (Neutralizing Antibody, NAb) 检测:特异性检测能够阻止AAV转导的抗体。
二、主要检测方法速览
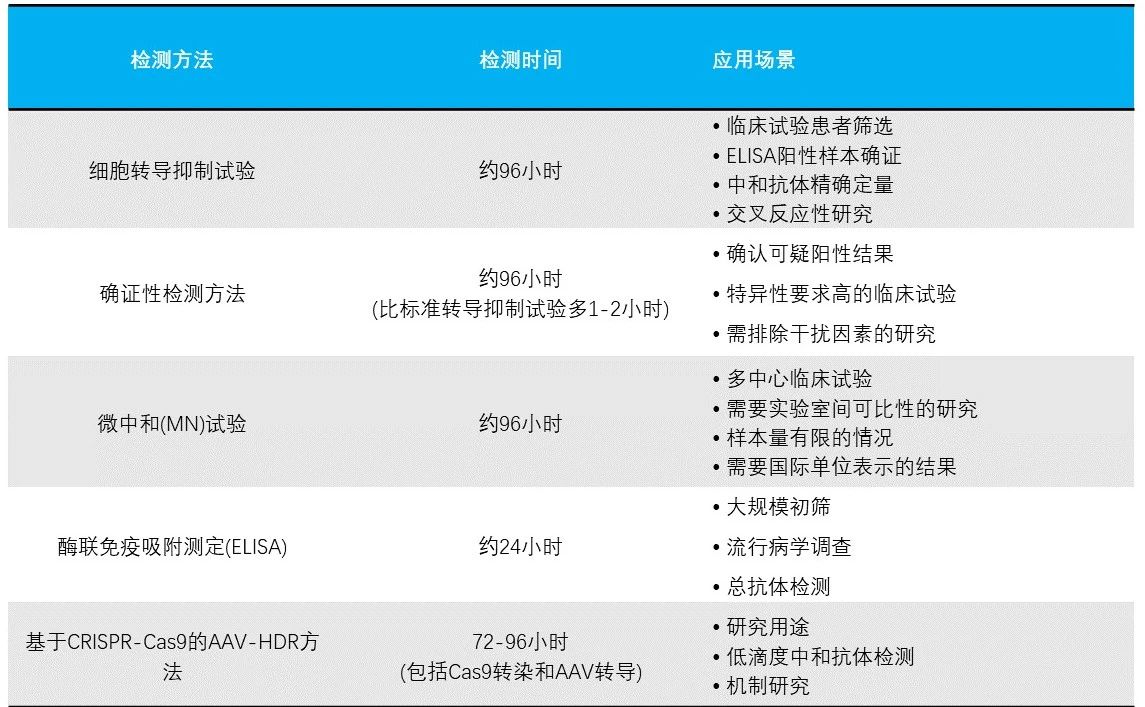
三、各种检测方法详解
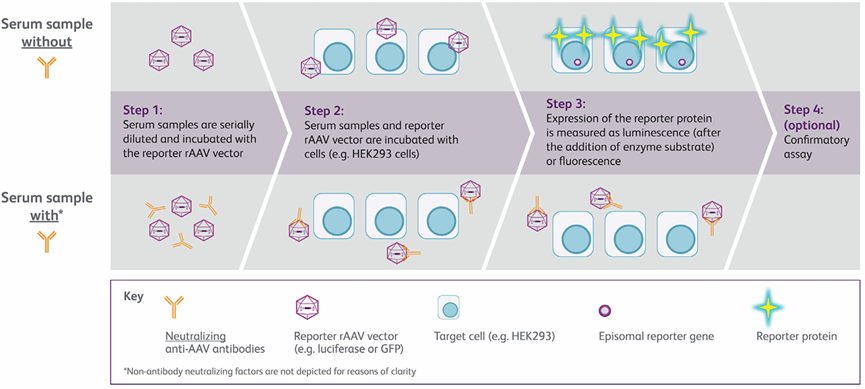
图2细胞转导抑制试验流程示意图[1]
(1)首先对血清样本进行热灭活,并通过离心去除可能的沉淀。随后依次配制不同稀释度的患者样本和对照血清。转导抑制实验一般采用48孔或96孔板,便于高通量样本分析。通常,将报告基因rAAV载体与稀释后的待测血清样本混合。
(2)与目标细胞共同孵育(有时为了提高rAAV转导效率,靶细胞会预先感染腺病毒)。
(3)裂解细胞,通过加底物检测报告基因的表达情况:如使用荧光素酶则测量发光信号,GFP则测量荧光信号。若血清中存在AAV中和抗体,就会影响转导过程,使报告基因的表达低于阴性对照组。
注意:还可以结合确证性步骤进一步判断抑制是否由中和抗体介导,尽管并非每次都必须执行该步骤。确证流程可能包括添加无关的单克隆抗体以评估特异性、去除免疫球蛋白组分、或与空载体(或无关转基因)进行竞争抑制试验等方式。
优点:
- 直接反映抗体的功能性中和能力;
- 临床相关性高,模拟体内情况;
- 可定量分析中和抗体滴度;
- 特异性高,假阳性率低。
局限性:
- 技术要求高,操作复杂;
- 需要活细胞培养,耗时较长(通常约96小时);
- 结果可能受细胞状态、病毒制备批次等因素影响;
- 难以实现高通量筛查;
- 标准化和验证相对困难。
应用场景:
- 临床试验患者筛选;
- ELISA阳性样本的确证性检测;
- 中和抗体滴度的精确定量;
- 研究不同AAV血清型之间的交叉反应。
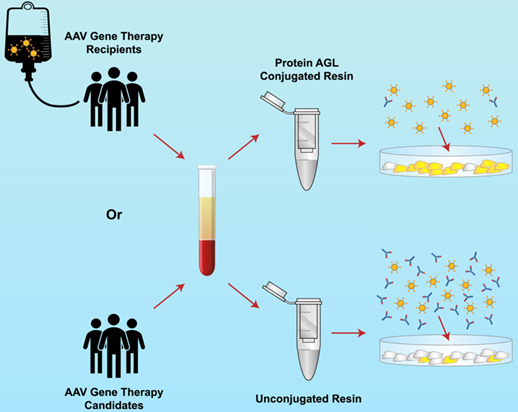
图3 确证性检测方法原理示意图[2]
简要流程:
实验流程与上述转导抑制试验基本相同,不同的地方在于孵育反应时需要设置平行反应体系:组A:常规中和反应(血清 + AAV载体);组B:竞争性抑制反应(血清 + AAV载体 + 过量空壳体)。
空壳体浓度通常为AAV载体的10-100倍(需预先优化)。
优点:
- 特异性显著提高
- 减少假阳性率
- 能区分真正的中和抗体和非特异性转导抑制因素
局限性:
- 需要高质量的空AAV壳体
- 操作步骤更复杂
- 成本增加
应用场景:
- 确认可疑阳性结果
- 对阳性率要求严格的临床试验
- 需要高特异性结果的研究
3. 微中和(MN)试验
简要流程:
(1)样本预处理:将待测的血清或血浆样本在56℃下孵育30分钟,以灭活可能存在的病毒等其他干扰因素。
(2)样本稀释与病毒混合:取50 μL的样本,从1:20开始进行2倍系列稀释。然后将稀释后的样本与2×10⁸vg的rAAV9-EGFP-2A-Gluc病毒在含有0.1%牛血清白蛋白的DMEM培养基中混合,总体积为100 μL,37℃孵育1小时,让样本中的抗体与病毒充分结合。
(3)细胞感染:将20,000个HEK-293-C340细胞加入到96孔板中,然后将上述孵育好的样本与病毒混合液加入到细胞中,每个稀释度设置3个复孔。
(4)孵育与检测:将96孔板置于37℃、5%二氧化碳的培养箱中孵育48至72小时。孵育结束后,使用荧光素酶检测试剂盒,按照说明书操作,检测每个孔中的荧光素酶活性,通过相对荧光单位(RLU)来反映病毒的转导效率。
(5)计算中和抗体滴度:以样本稀释倍数的对数值为横坐标,以转导抑制率(TI)为纵坐标,绘制剂量-反应曲线。通过4参数逻辑回归分析拟合曲线,计算出使病毒转导抑制50%时的抗体滴度,即IC₅₀值。
优点:
- 样本和试剂用量减少;
- 可在多实验室间转移和重复;
- 适合临床试验应用;
- 结果一致性高。
局限性:
- 微量操作需精确控制,对设备和操作技术要求高;
- 需要标准品;
- 实验室间转移需协调和比对;
- 自动化系统成本高;
- 微量操作需精确控制,对设备和操作技术要求高;
- 需要标准品;
- 实验室间转移需协调和比对;
- 自动化系统成本高。
应用场景:
- 多中心临床试验;
- 需要实验室间结果可比性的研究;
- 样本量有限的情况。
4. 酶联免疫吸附测定(ELISA)法
流程.png)
图4 ELISA法检测抗AAV总抗体(TAb)流程。TAb检测可根据所用二级试剂的不同,分为抗原捕获型和桥联型两种格式。根据实验需求(如提升检测选择性、提升抗原耐受力、增强特异性等),TAb实验可以采用共孵育(均相)或顺序孵育(非均相)模式[1]。
(1)rAAV衣壳首先被固定在ELISA板或电化学发光(ECL)微孔板上;
(2)随后加入待测血清,使抗体与衣壳结合;
(3)洗板去除未结合成分后,抗原捕获型步骤中一般加入辣根过氧化物酶或钌标记的抗物种二抗进行检测,而桥联型则加入标记(比如生物素标记或钌标记)的rAAV衣壳。
(4)如果使用钌标记系统,通过加入读板缓冲液后测量发光信号;若为酶标检测,则加入底物显色,检测颜色变化。常用的阳性对照为商业化的血清型特异性抗AAV衣壳单/多克隆抗体或公司自有抗体,阴性对照则为来自TAb阴性供体的血清混合样本。
优点:
- 操作简便,易于标准化和高通量筛查;
- 成本相对较低;
- 检测速度快,通常24小时内可完成;
- 可自动化,适合大规模样本筛查。
局限性:
- 无法区分中和抗体和非中和性结合抗体;
- 可能出现假阳性结果;
- 灵敏度相对较低,可能漏检低滴度但具有中和活性的抗体。
应用场景:
- 初筛大量患者样本;
- 流行病学调查;
- 与中和抗体检测互补使用。
注意:研究表明,ELISA与中和试验结果存在较高的一致性,特别是对于AAV1、AAV8和AAV9血清型。然而,Gardner等人(2022)的研究显示,虽然ELISA可以作为有效的筛查工具,但阳性结果仍需通过功能性中和试验确认[4]。
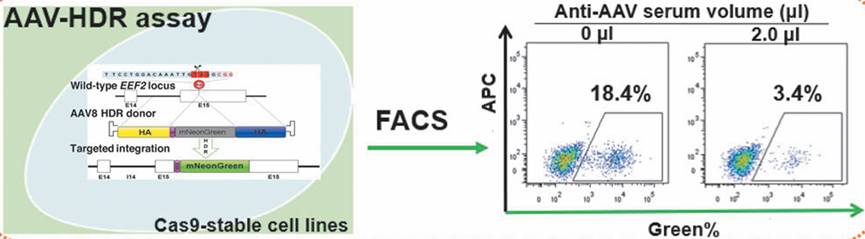
图5 AAV-HDR检测原理示意图[5]
原理:通过CRISPR-Cas9系统在细胞基因组的特定位置诱导DNA双链断裂,然后利用AAV-HDR供体载体通过HDR机制将荧光报告基因整合到断裂位点。通过流式细胞术检测荧光报告基因的表达情况,从而实现对AAV中和抗体滴度的精确检测。
简要流程:
(1)样本和细胞准备
抗AAV血清样本收集:收集血清样本,经过离心、灭活等处理后保存于-80°C备用。
细胞培养和转染:选择稳定表达SpCas9的细胞系(如K562-SpCas9、HeLa-SpCas9或HEK293T-SpCas9)。将细胞培养至适当的密度后,使用电穿孔技术将sgRNA质粒(如sgEEF2)导入细胞中,以实现特异性基因编辑。
(2)AAV-HDR供体载体的制备
AAV-HDR载体设计:构建含有mNeonGreen荧光报告基因的AAV-HDR供体载体,该载体的两端设计有与目标基因(如EEF2)断裂位点相邻的同源臂(HAs)。
AAV生产与纯化:通过三质粒共转染法生产AAV8载体,然后经过碘克沙醇梯度超速离心等步骤纯化AAV载体。
(3)中和抗体处理
血清稀释和预孵育:将待测血清样本进行梯度稀释(通常为2倍梯度),然后将稀释后的血清与AAV-HDR载体在37°C下共孵育2小时,使血清中的中和抗体与AAV载体结合并中和部分AAV颗粒。
细胞共培养:将经过血清预处理的AAV-HDR载体与电穿孔后的SpCas9细胞共培养,使AAV载体能够进入细胞并进行HDR介导的基因整合。
(4)流式细胞术检测
细胞培养和洗涤:在共培养4小时后,移除含有AAV的培养基,用PBS洗涤细胞,然后加入新鲜培养基继续培养。
荧光检测:在转导后2天、3天或4天,使用流式细胞术(FACS)检测mNeonGreen阳性细胞的比例。通过荧光信号的强度和阳性细胞的比例来评估AAV-HDR载体的整合效率。
(5)标准曲线建立和NAb滴度计算
标准曲线建立:使用已知MOI(Multiplicity of Infection,感染复数)的AAV-HDR载体转导细胞,建立mNeonGreen阳性细胞比例与AAV病毒颗粒数的标准曲线。
NAb滴度计算:根据标准曲线,通过比较经过血清处理的细胞中mNeonGreen阳性细胞的比例,计算出被中和的AAV病毒颗粒数,从而得出每毫升血清中能够中和的AAV病毒颗粒数,即NAb滴度。
优点:
- 灵敏度更高;
- 结果一致性好;
- 可能适用于多种AAV血清型。
局限性:
- 技术复杂度高;
- 尚未广泛验证;
- 标准化困难。
应用场景:
- 研究用途;
- 需要高灵敏度的特殊临床应用;
- 其他方法难以检测的低滴度中和抗体。
四、检测方法的选择策略
1. 临床试验患者筛查:
- 初筛:ELISA检测总抗体
- 确证:细胞转导抑制试验或微中和试验
细胞转导抑制试验或者微中和试验,动态监测NAb滴度变化。
3. 流行病学研究
- 大规模人群初筛:ELISA
- 阳性样本确证:细胞转导抑制试验
4. 临床前研究
- 动物模型:体内中和试验
- 细胞模型:细胞转导抑制试验
5. 特殊情况
- 疑似假阳性:确证性方法
- 低滴度NAb精确检测:微中和试验或基于CRISPR-Cas9的AAV-HDR方法
五、临床应用中的关键考量
Cao等人(2023)强调了临床入组检测中NAb界值设定的重要性[6]。临床试验通常采用1:5至1:50的血清稀释度作为筛选界值,但最佳临界值应根据具体的AAV血清型、给药途径、靶器官和治疗目标来确定。
2. 检测方法的标准化与验证
基于细胞的NAb检测方法需要进行严格的生物分析验证,包括特异性、精密度、稳健性和最低稀释度等参数[7]。多实验室间的方法转移和比对也至关重要,Yu等人(2024)的研究提供了一个成功案例[3]。
3. 交叉反应性评估
由于患者可能接触过多种血清型的野生型AAV,评估不同AAV血清型之间的交叉中和十分重要。Schulz等人(2023)的综述强调了这一点,并指出相关血清型(如AAV8和AAV9)之间可能存在高度交叉反应[1]。
六、未来发展趋势
2. 基于多重检测技术的综合评估系统,同时检测多种血清型的NAb;
3. 体外检测结果与体内疗效的相关性研究,建立更具预测性的检测模型;
4. 个性化阈值策略,基于给药途径、剂量和治疗目标确定不同患者的NAb阈值;
5. 基于人工智能的预测模型,综合考虑多种因素预测NAb对治疗的影响。
结论
AAV中和抗体的检测对基因治疗的成功至关重要。ELISA和细胞转导抑制试验是目前最常用的两种互补方法,前者适合大规模初筛,后者适合功能性确证。新兴的确证性方法、微中和试验和基于CRISPR的技术为提高检测特异性和灵敏度提供了新选择。在临床应用中,应根据具体需求选择合适的检测方法,并严格控制方法学验证和标准化,以确保结果的可靠性和可比性。
无论您正在规划动物实验、临床试验入组还是评估给药安全窗,派真生物的细胞转导抑制法(TI)AAV中和抗体检测服务都能为您提供最快速、最可靠的功能性结果。该方法直接测量抗体对AAV转导的真实抑制效应,特异性高、假阳性率低,可精准定量各血清型 NAb 滴度,并在 ≈96 小时内交付数据,助您快速决策。我们的检测覆盖AAV1–AAVrh74等主流及定制血清型,亦可按需提供确证性检测和交叉反应性评估。选择派真生物,一站式获得高灵敏、高一致性的AAV NAb检测,让您的基因治疗项目领先一步!
[5]. Li, G., et al., Leveraging CRISPR-Cas9 for Accurate Detection of AAV-Neutralizing Antibodies: The AAV-HDR Method. Hum Gene Ther, 2024. 35(13-14): p. 490-505.
[6]. Cao, L., et al., Clinical enrollment assay to detect preexisting neutralizing antibodies to AAV6 with demonstrated transgene expression in gene therapy trials. Gene Ther, 2023. 30(1-2): p. 150-159.
[7]. Gorovits, B., et al., Recommendations for the development of Cell-Based Anti-Viral Vector Neutralizing Antibody Assays. AAPS J, 2020. 22(2): p. 24.
关于派真
作为一家专注于AAV 技术十余年,深耕基因治疗领域的CRO&CDMO,派真生物可提供从载体设计、构建到 AAV、慢病毒和 mRNA 服务的一站式解决方案。凭借深厚的技术实力、卓越的运营管理和高标准的服务交付,我们为全球客户提供一站式CMC解决方案,包括从早期概念验证、成药性评估到IIT、IND及BLA的各个阶段。
凭借我们独立知识产权的π-alphaTM 293 细胞AAV高产技术平台,我们能将AAV产量提高多至10倍,每批次产量可达1×10¹⁷vg,以满足多样化的商业化和临床项目需求。此外,我们定制化的mRNA和脂质纳米颗粒(LNP)产品及服务覆盖药物和疫苗开发的各个阶段,从研发到符合GMP的生产,提供端到端的一站式解决方案。