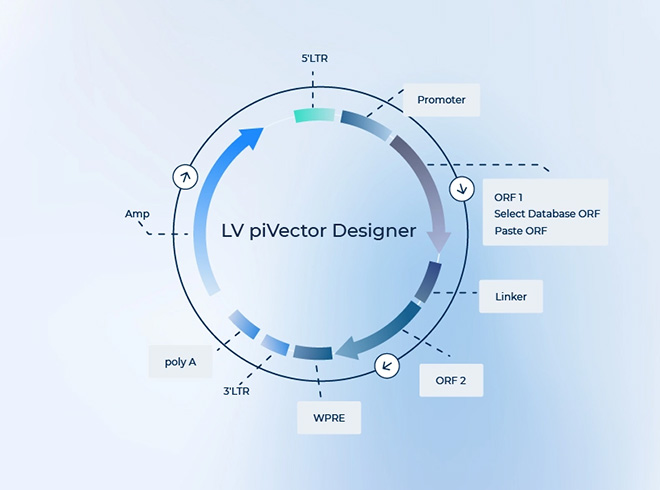
慢病毒包装实验流程是一个高度技术化的操作过程,在生物医学研究中用于生产可以传递遗传信息的病毒粒子。实验的关键是将慢病毒载体(含有目标基因的质粒)与包装质粒共同转染到易感染的宿主细胞(如HEK293T细胞)中,使得这些细胞产生出可以将目标基因有效整合到目标宿主细胞基因组中的慢病毒颗粒。本文将概述这一实验流程的关键步骤。
慢病毒包装实验的关键步骤:
细胞铺板:
选择合适的培养皿,并在实验前一天将宿主细胞种植,达到70-80%的合适融合度。
制备转染混合物:
根据选择的转染试剂(例如Lipofectamine 2000),按照厂商的推荐比例和方法,将慢病毒载体和包装质粒与转染试剂混合。
转染细胞:
将准备好的转染混合物添加至细胞培养皿中,轻柔混合以确保均匀分布。
根据细胞类型设定适当的培养条件(温度、CO2浓度等)。
换媒:
转染4-6小时后,移除含有转染混合物的培养基,并用新鲜的完全培养基替换。
收集病毒颗粒:
在转染后的48-72小时,收集含有病毒颗粒的培养上清。
使用0.45 μm滤膜过滤收集到的上清,除去细胞碎片等大颗粒物质。
病毒浓缩(可选步骤):
如果需要更高滴度的病毒颗粒,可以使用超速离心等方法对病毒上清进行浓缩。
病毒颗粒保存:
将过滤、浓缩(如果有)后的病毒颗粒置于低吸附性的冻存管中,并在-80°C条件下保存。
病毒滴度测定:
在下游应用之前,进行感染功效测试以确定病毒的滴度和感染能力。
注意事项:
转染效率:转染效率对病毒滴度有显著影响,因此需要优化转染条件。
实验操作:严格按照生物安全操作规程进行操作,避免病毒颗粒的泄露和人员污染。
病毒处理:病毒上清应小心处理,避免泡沫生成,因为这可能损害病毒粒子的完整性和感染能力。
通过遵循上述步骤和注意事项,研究人员可以高效地进行慢病毒包装实验,为后续的基因编辑或基因治疗研究奠定基础。
复制内容