
慢病毒载体(Lentivirus vector)是以慢病毒基因组为基础,由所需的目的基因取代部分基因构建而成。目前使用的慢病毒载体多采用HIV-1基因组改造而来。与一般的逆转录病毒载体相比,慢病毒载体对分裂细胞和非分裂细胞均具有感染能力而具有更广的宿主范围。慢病毒载体还可以将外源基因有效地整合到宿主染色体上,从而实现持久表达。在感染能力方面可以有效感染神经元细胞、肝细胞、心肌细胞、肿瘤细胞、内皮细胞、干细胞等多种类型的细胞,又很少引发机体免疫反应。派真生物提供的慢病毒为“自杀”性病毒,即病毒感染目的细胞后不会再感染其他细胞,也不会利用宿主细胞产生新的病毒颗粒。慢病毒中的毒性基因已经被剔除并被外源性目的基因所取代,属于假型病毒。
慢病毒包装是将外源基因载入慢病毒载体,并通过病毒感染的方式将目的基因导入靶细胞的过程。这个过程通常在实验室中用于基因功能研究或基因治疗研究。慢病毒具有感染范围广、整合效率高和相对较低的免疫原性,因此在基因传递中广泛应用。以下是典型的慢病毒包装流程:
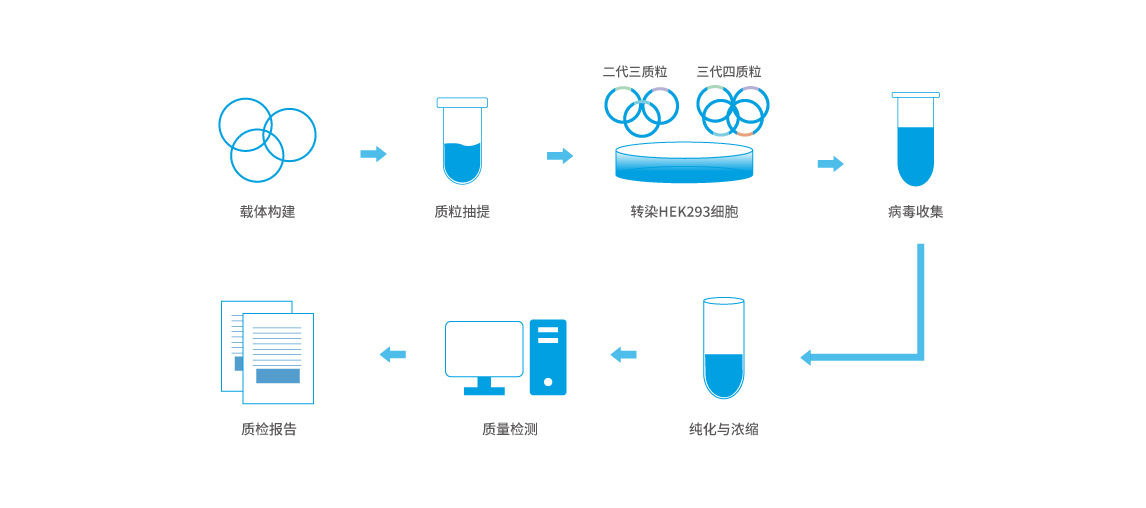
1. 构建慢病毒载体
- 目的基因插入载体:首先,将感兴趣的目的基因(例如,报告基因、功能基因或治疗基因)插入到慢病毒载体的多克隆位点(MCS)中。这个载体通常是包装缺陷型的,即它本身不能独立产生感染性病毒,必须与辅助质粒共同作用。
- 常用的慢病毒载体:如pLenti系列质粒。
2. 转染包装细胞
- 选择包装细胞:常用的包装细胞株是293T细胞,它们具有高效的转染效率和适合病毒包装的特点。
- 共转染质粒:
- 目的基因质粒:含有外源基因的慢病毒载体。
- 辅助质粒:包括慢病毒结构蛋白(如gag、pol)和包膜蛋白(env)。这些质粒通常通过共转染的方式与目的基因质粒一起转入293T细胞中。
3. 病毒颗粒的产生
- 病毒颗粒的组装:在细胞内,目的基因与包装蛋白一起组装成病毒颗粒,并通过细胞外泌方式释放到培养基中。
- 收集上清液:一般在转染48小时和72小时后分别收集细胞培养基中的病毒颗粒(即病毒上清)。
4. 病毒的浓缩和纯化(可选)
- 如果需要更高浓度的病毒,可以对收集到的病毒上清进行浓缩,例如通过超速离心或PEG沉淀等方法。
- 有时也需要进行病毒纯化,如通过层析法或滤过法去除多余的细胞碎片和蛋白质。
5. 病毒滴度测定
- 通过定量PCR(qPCR)或ELISA检测病毒上清中的病毒滴度。
- 也可以通过感染报告基因(如GFP)的靶细胞,观察荧光表达,来间接估算病毒滴度。
关于派真
作为一家专注于AAV 技术十余年,深耕基因治疗领域的CRO&CDMO,派真生物可提供从载体设计、构建到 AAV、慢病毒和 mRNA 服务的一站式解决方案。凭借深厚的技术实力、卓越的运营管理和高标准的服务交付,我们为全球客户提供一站式CMC解决方案,包括从早期概念验证、成药性评估到IIT、IND及BLA的各个阶段。
凭借我们独立知识产权的π-alphaTM 293 细胞AAV高产技术平台,我们能将AAV产量提高多至10倍,每批次产量可达1×10¹⁷vg,以满足多样化的商业化和临床项目需求。此外,我们定制化的mRNA和脂质纳米颗粒(LNP)产品及服务覆盖药物和疫苗开发的各个阶段,从研发到符合GMP的生产,提供端到端的一站式解决方案。

