近期,Richard Jude Samulski在《Molecular Therapy》杂志(影响因子为12.1)上发表了一篇极具影响力的综述文章。该文系统性地回顾了AAV技术在过去40年间的演变历程,并深入探讨了人工智能驱动的衣壳工程、精准递送以及rAAV药物临床试验与商业化等未来发展方向[1]。这篇文章无疑是深入了解AAV行业过去与未来趋势的权威读物。此前,我们我们介绍了AAV药物临床试验进展与现实挑战,本期我们将重点聚焦于AAV载体设计这一关键领域。这篇文章篇幅较长,但内容丰富且极具价值,相信您读完后一定会有所收获。
在过去的几十年中,AAV的载体设计持续围绕三个核心维度展开(图1):
1. 顺式元件(cis-acting elements)优化:如 ITR、启动子、增强子、剪接元件、多聚腺苷酸化序列等;
2. 转基因盒(transgene cassette)设计优化:如密码子优化、移除潜在ORF、去除CpG岛、构建mini或truncated版本;
3. 蛋白修饰策略:如去除FVIII B区、使用Padua突变型FIX等,提升蛋白功能活性与表达效率。
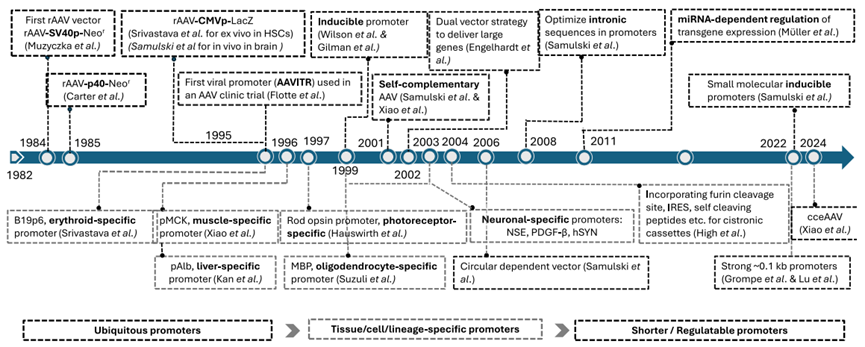
图1 用于优化转基因表达的rAAV表达盒设计与工程化策略及创新。rAAV:重组腺相关病毒;SV40p:SV40 (猿空泡病毒)衍生启动子;Neor:新霉素抗性基因;B19p6:B19 细小病毒启动子;CMVp:巨细胞病毒衍生启动子;LacZ:β‑半乳糖苷酶基因;pMCK:肌酸激酶肌肉特异启动子;ITR:反向末端重复序列;MBP:髓磷脂碱性蛋白启动子;NSE:神经元特异性烯醇化酶启动子;PDGF‑β:血小板源生长因子 β 链启动子;hSYN:人突触素启动子;Cistronic cassettes:单顺反子表达盒;cceAAV:共价闭合末端双链 AAV。
然而,AAV包装容量仅为4.7kb,远小于人类基因组中蛋白编码基因的平均长度(>60kb),这意味着,AAV治疗几乎不可能使用天然基因结构,而只能采用cDNA表达盒进行递送。通常一个cDNA片段大小在0.5~2.5kb之间,适合AAV包装,但现实中处于临床阶段的基因治疗反而多为超大转基因(如DMD:14kb,FVIII:8kb,CFTR:4.4kb),这也推动了设计策略向更极致的方向演化。
早期AAV载体多使用高表达病毒启动子(如CMV)来提升蛋白表达水平。但这类“全能型”设计在需要组织特异性表达的场景下存在显著副作用。
于是,载体设计进入精准调控时代:
- 引入组织/细胞特异性启动子,增强靶向性;
- 引入可调控启动子系统(inducible promoter)实现“按需表达”;
- 利用miRNA元件(如miR-122)在3′UTR实现组织特异性表达沉默;
- 精选内含子结构与剪接位点提高表达效率;
- 加入WPRE等元件增强mRNA稳定性与转导表达;
- 执行密码子优化(包括去除免疫相关CpG位点)提升跨种属表达稳定性。
传统AAV优化路径通常是衣壳工程与表达盒设计各自独立进行,但近期研究发现,衣壳结构会直接影响基因表达效率与染色质状态,具体表现为:不同衣壳与表达盒之间存在协同增强效应;某些衣壳与启动子组合可调控基因沉默、DNA甲基化、染色质可及性;启动子-衣壳匹配性已成为新一代载体设计的重要考量。
目前已有8款AAV药物获得EMA或FDA批准,国内NMPA也于今年批准了1款AAV药物,但挑战仍存:HEMGENIX表达水平在5年内逐渐下降;某些病例中出现血栓性微血管病(TMA)等严重副反应;DMD患者中有不幸的死亡报告,表明载体设计仍有待改善。这些事件说明,AAV载体即使已商业化,仍需要在表达控制、剂量调节、安全性设计方面持续进化。
在AAV表达盒中,启动子是控制转基因表达起点的关键元件,决定了:基因在哪种细胞中被激活(组织/细胞特异性);在什么时间启动转录(应激/炎症响应);以及表达水平是否稳定可控(量效关联性)。过去数十年间,启动子种类从最初的几种病毒启动子,扩展至:
- 强效/广谱的病毒或非病毒启动子;
- 各类组织特异性启动子;
- 结构优化的合成启动子;
- 可调控表达系统。
越来越多研究也通过剪接、截短、增强子添加、顺式元件替换/组合等策略,构建功能更优的合成启动子,甚至应用计算机辅助设计来开发新型表达调控元件。
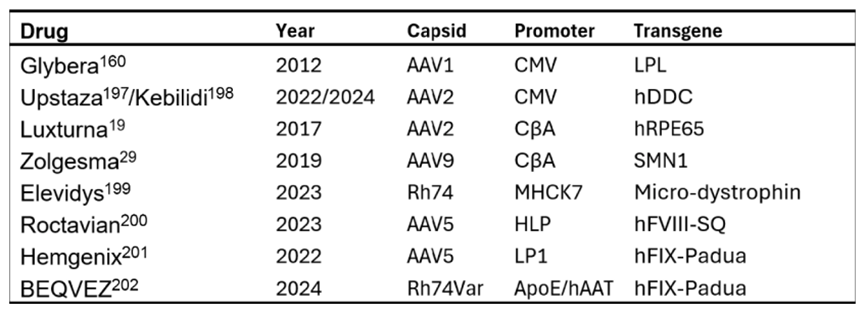
第一个AAV表达载体由Nick Muzyczka实验室构建,使用SV40 p40启动子驱动新霉素抗性基因表达。CMV(人类巨细胞病毒启动子)是经典高效启动子代表,被广泛用于体外/体内/外植组织实验、临床试验以及多个AAV商业化药物中(图2)。如首个EMA批准AAV药物Glybera,使用了AAV1衣壳、LPL S447X基因、CMV启动子与WPRE增强元件;Upstaza/Kebilidi(hAADC表达)也使用了CMV启动子。然而,CMV启动子表达活性会受到多种生理刺激调节(如细胞应激、炎症、细胞因子等),这对于需要稳定表达的治疗场景极为不利。
图2 基因治疗获批药物。美国 FDA 和 EMA 已批准的 AAV 基因药物所采用的启动子。CMV:人类巨细胞病毒启动子;CβA:鸡 β‑肌动蛋白启动子;MHCK7:α‑MHC 增强子 + 2RS5 增强子 + 近端 MCK 启动子;LP1:肝特异启动子 1;HLP:混合型肝启动子;hRPE65:人视网膜色素上皮 65 蛋白基因;SMN1:存活运动神经元蛋白 1 基因;hDDC:人多巴脱羧酶基因;hFIX‑Padua:含 R338L 点突变的人凝血因子 IX(Padua 变体),最早发现于帕多瓦大学;hFVIII‑SQ:去 B 区的人凝血因子 VIII‑SQ 变体。
为实现更稳定、更强效的表达,研究者开发了多个稳定性优于CMV的合成启动子,如CBA(鸡β-肌动蛋白启动子),CAG(CMV增强子 + CBA启动子 + 兔β-globin剪接受体),EF1α(真核延伸因子1α启动子),这些启动子均经过结构删减、增强子嵌合、剪接受体调整等改造,具备高表达、跨组织、高保真性等优势,并已应用于多项临床研究与已上市产品。例如:FDA批准的首款AAV基因治疗药物Luxturna,使用了AAV2衣壳 + CMV增强子 + CBA启动子来表达人RPE65;Zolgensma,首个静脉注射AAV药物,使用了scAAV9 + CMV增强子 + CBA启动子来表达SMN蛋白(图2)。
尽管这些启动子临床上获得成功,但仍存在如下挑战:(1)易受DNA甲基化影响:启动子可被甲基化失活,导致转基因表达降低或丢失;(2)表达“过强”可能干扰细胞功能:某些研究认为,高水平转基因表达可能扰乱内源基因表达网络,诱导代谢失衡或免疫应答;(3)最大的问题:组织/细胞非特异性,强启动子普遍缺乏靶向性,难以应用于对表达位置有严格要求的治疗策略。
回顾AAV表达载体发展的第一个十年(1984–1995)(图1),病毒启动子是当时研究得最清楚的顺式元件,且表现出色,自然成为首选。但随着对表达调控复杂性的认识加深,组织特异性与表达稳定性正成为启动子选择的新标准。
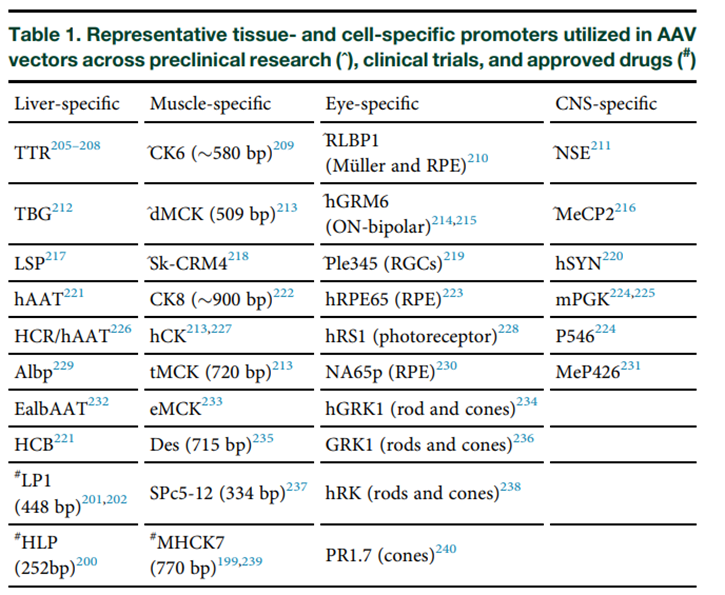
在AAV基因治疗设计中,如何避免脱靶表达是一个亟需解决的问题。而最直接有效的策略之一,就是使用组织/细胞特异性启动子来精准调控转基因的表达范围(表1)。相比强启动子带来的广谱表达与潜在毒性,组织特异性启动子可在目标组织中实现高效表达,从而降低免疫激活、非靶器官毒性以及对内源基因网络的干扰,提高安全性与长期表达稳定性。
注:TTR:转甲状腺素蛋白启动子;TBG:甲状腺素结合球蛋白启动子;LSP:肝特异性启动子,由α1‑微球蛋白/bikunin增强子 + TBG 启动子构成;hAAT:人α‑1‑抗胰蛋白酶基因启动子;HCR/hAAT:载脂蛋白E基因的肝脏调控区 + 人α‑1‑抗胰蛋白酶启动子;HCB:肝脏组合型启动子,由HNF1转录因子结合位点 + 缩短的Abp序列增强子 + 合成核心启动子(SynO)组成;Albp:白蛋白启动子;EalbAAT:人白蛋白增强子 + 人α‑1‑抗胰蛋白酶启动子;LP1:肝启动子1(截短的HCR/hAAT混合型启动子);HLP:混合型肝启动子(截短的HCR/hAAT混合型启动子);CK6:肌酸激酶启动子 + 2RS5增强子;dMCK:含双MCK增强子的肌酸激酶启动子;SK‑CRM4:MYLPF基因启动子中的转录因子结合位点簇;CK8:肌酸激酶增强子 + 启动子;hCK:人肌酸激酶启动子;tMCK:三串联MCK增强子的肌酸激酶启动子;eMCK:肌酸激酶启动子;Des:解聚素启动子;Spc5‑12:由4个肌肉特异性转录因子结合位点(TEF1、SRE、MEF1、MEF2)+ 鸡骨骼肌α-肌动蛋白核心启动子组成;MHCK7:α‑MHC增强子 + 2RS5增强子 + MCK近端启动子;RLBP1:视黄醛结合蛋白1启动子;RPE:视网膜色素上皮细胞;hGRM6:人GRM6基因启动子;Ple345:来源于神经丝轻链的合成启动子;RPE65:视网膜色素上皮细胞特异性启动子(65 kDa蛋白),约1.4 kb;hRS1:人网膜分裂素启动子;NA65p:优化版人RPE65启动子(约750 bp);hGRK1:人视紫红质激酶启动子;GRK1:G蛋白偶联受体激酶1;hRK:视紫红质激酶启动子;PR1.7:1.7 kb的L‑视蛋白启动子;NSE:神经元特异性烯醇化酶启动子;MeCP2:甲基‑CpG结合蛋白2启动子;hSYN1:人突触素1基因启动子;mPGK:小鼠磷酸甘油酸激酶启动子;P546:截短的MeCP2启动子;MeP426:MeCP2核心启动子 + 调控元件;RGCs:视网膜神经节细胞。
例如,在杜氏肌营养不良症(DMD)、肢带型肌营养不良症和庞贝病的临床试验中,已经采用了多种肌肉特异性启动子(如在NCT03368742中使用了CK8,在NCT05881408中使用了MHCK7,在NCT04281485中使用了tMCK);神经元特异性启动子(如UniQure在颞叶癫痫的1/2期临床试验中采用了hSyn1启动子,AviadoBio在额颞叶痴呆的临床试验中也使用了hSyn1启动子);以及肝脏特异性启动子(例如TBG启动子,已用于MPS VI和晚发型OTC缺陷的1/2期临床试验,LSP启动子则被用于庞贝病的1/2期临床试验)。此外,肝特异性启动子的变体如LP1(来源于载脂蛋白E/C-I基因位点的肝脏调控区与人α-1抗胰蛋白酶的紧凑型嵌合启动子)和HCR/hAAT,作为驱动FIX转基因表达的重要顺式作用元件,已被应用于Hemgenix(etranacogene dezaparvovec-drlb)中。Roctavian(Valoctocogene roxaparvovec-rvox),一种基于AAV5的载体,旨在引入编码去B区人凝血因子VIII(hFVIII‑SQ)功能性拷贝的转基因,使用了肝特异性启动子。针对FIX缺乏症,BEQVEZ(Fidanacogene elaparvovec)使用Rh74var衣壳,载体中含有人FIX Padua cDNA,并由改良的肝特异性启动子驱动表达。Elevidys则采用AAV rh74型衣壳,载体基因组编码微型肌营养不良蛋白(micro-dystrophin),其表达受MHCK7启动子(α‑心肌重链/肌酸激酶嵌合型启动子)调控,从而将表达限定在骨骼肌和心肌细胞中。
尽管AAV基因治疗已取得商业化成果,目前所有已上市AAV药物(如图2A所示),无一使用可诱导/可抑制(inducible/repressible)启动子设计。调控型表达系统,虽然早在20年前已在动物模型中验证有效,但至今仍未进入人体临床试验阶段。
在以下场景中,持续表达反而成为安全隐患:
- CRISPR等基因编辑系统:表达时间长可能导致脱靶、毒性;
- 癫痫等神经疾病:仅在发作时需要短时表达;
- 毒性蛋白表达/免疫干预:需可控、限时开启。
因此,实现“按需表达”的可调控启动子系统,正逐渐成为AAV领域下一步的重要方向。
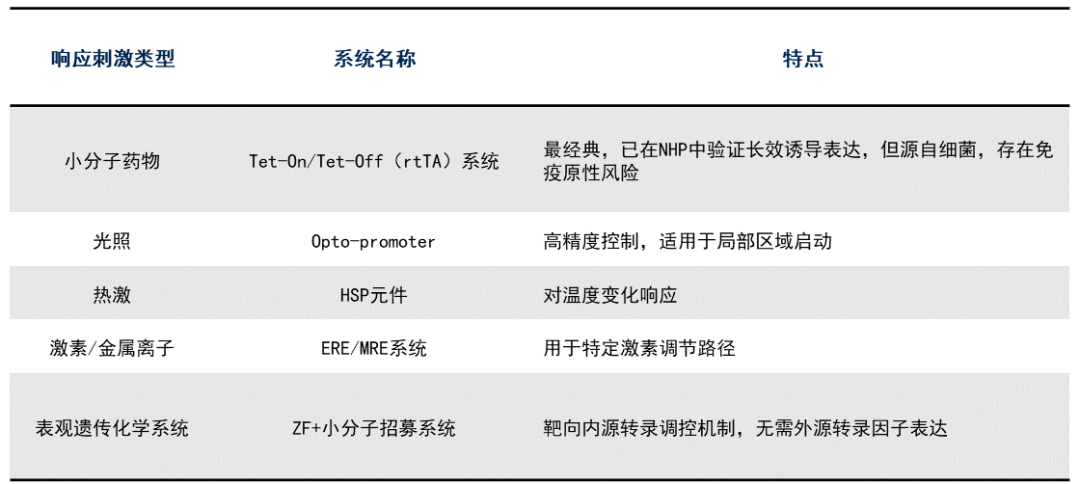
当前已开发的调控型启动子系统包括:
最近Samulski团队报道了一个小巧、表达强效、药物可控(对FDA已批准药物敏感)的新型肝脏启动子,该启动子经AAV8/AAV9递送后在小鼠体内的表达诱导倍数 > 5,000倍,表达峰值为CMV启动子的10倍,创下目前已知诱导型启动子最高活性记录。
在AAV载体设计中,载体包装容量受限(约4.7kb)始终是一项核心挑战。尤其在递送大基因(如CFTR、CRISPR系统、DMD基因)时,如何“挤出”更多空间用于转基因成为设计优化的重点。早在AAV治疗囊性纤维化(CF)的探索阶段,Flotte等人发现:AAV2的ITR本身具有启动子活性,能够驱动基因表达(体内+体外)。第一项人体AAV临床试验中,就采用了“ITR-CFTR表达盒”,即用ITR驱动CFTR表达。Rubenstein 等在兔肺中验证了ITR-CFTR可实现CFTR mRNA及蛋白表达。后续研究将这一表达活性定位于A/D区域的37个核苷酸序列。虽然未发现经典TATA盒,但多个研究报告ITR序列中存在多个转录起始位点(TSS)。其它血清型的ITR也被报道有活性,如AAV5 的ITR也被证实具有启动子功能。Kay等团队比较了AAV1–6的ITR对CMV-GFP表达的影响,结果显示:在强启动子背景下,ITR差异对转导效率影响不大;Lauriel 等在体外和floxed-luciferase小鼠模型中使用无启动子载体系统分析了ITR1、2、3、4、7,结果表明:ITR本身可驱动表达,且不依赖于TATA盒结构。Chai等报道了两个微型启动子(仅84bp和135bp),其表达水平可媲美CAG启动子。然而,这种表达依赖于其邻近的AAV2 ITR序列,提示:ITR可能作为“顺式增强子”,协同微型启动子提升表达活性。值得注意的是,若对左侧ITR的RBE区域进行12bp缺失改造,会显著降低其增强活性,这提示在设计AAV表达盒时,对ITR序列的完整性要格外谨慎。
最后,有研究报道指出,ITR可与宿主蛋白,包括转录因子,发生相互作用。基于软件的转录因子结合位点分析显示,ITR序列中存在大量潜在的转录因子结合位点,提示其可能具备一定的调控功能。Dong-Soon 等人鉴定并解析了涉及 ITR 的DNA-蛋白复合物,证实ITR序列具备与宿主调控因子结合的能力。此外,研究还发现宿主蛋白如 FKBP2 和 RFX 转录因子家族成员可与 ITR 的 D 元件结合,并参与 AAV 第二链合成及转录过程。因此,深入探索 AAV ITR 的结构特征、与蛋白的互作关系以及其潜在的转录调控位点,对于优化AAV载体的整体设计具有重要意义。
5. 如何管理ITR的转录活性?AAV载体设计中容易被忽视的重要细节
虽然已有大量研究证明AAV ITR具备启动子/增强子功能,但这一特性在实际载体设计中仍未受到足够重视。尤其在大基因载体(如CFTR、DMD、CRISPR等)设计中,利用ITR的表达调控能力反而成为一个“节省空间、提升表达”的潜在策略。然而,ITR序列的双向启动子活性也可能带来潜在问题。例如,Shao 等人观察到,AAV感染可能激活MDA5这一双链RNA(dsRNA)感应蛋白,而该蛋白主要识别长度超过2000个核苷酸的dsRNA产物。这一现象被认为与ITR在环状外源表达状态下的启动子活性有关,可能导致负链RNA的积累,并与正链RNA形成双链RNA结构,从而通过dsRNA通路触发先天免疫反应,可能引发不良效应。令人遗憾的是,已有多起AAV基因治疗相关死亡案例被报道,其原因可能包括源自病毒衣壳的先天免疫应答,或因高剂量而导致的其他机制。尽管目前尚无明确证据将这些事件与dsRNA诱导的先天免疫反应直接关联,但这一现象凸显了降低先天免疫反应对于保障AAV基因治疗安全性与有效性的关键性。
6. 未来的发展方向与挑战:挖掘载体遗传元件与衣壳-启动子/ITR互作的潜力
治疗性基因载体的设计通常涉及将启动子、增强子、UTR(非翻译区)、polyA尾以及其他调控元件等多个模块组装在一起。要实现高效的载体工程化,深入理解这些调控元件之间的相互作用至关重要。此外,除了调控元件外,蛋白编码区在人体细胞中也可能成为转录因子的结合位点。因此,尽管编码序列优化已成为常规操作,但它同时也引入了影响载体性能的新变量。
近年来,去除CpG二核苷酸的策略逐渐被采纳,但实际上,这往往只是另一种形式的密码子优化,对CpG在AAV生物学中作用的改变微乎其微。值得注意的是,与其他细小病毒相比,AAV的基因组结构本身就呈现出类似CpG岛的特征。野生型AAV通常具有较高的GC含量(>50%)和较高的CpG出现频率(观测值/期望值比率 >70%)。因此,简单地去除CpG序列可能违背了AAV进化过程中对这些元素的保留,这种策略是否合理仍值得商榷。未来,有关去除与否的临床试验将有助于厘清这一争议。
不论如何,必须全面考量各类遗传元件的组合效应,以尽可能降低潜在的非预期后果。除了遗传元件之间的互作外,过去十年的研究也加深了我们对启动子与衣壳之间复杂互作关系的理解。
传统上,AAV的细胞趋向性被认为主要由VP3衣壳蛋白决定,因此早期的衣壳工程主要集中在VP3。然而,已有研究表明,VP1和VP2也具有独特的N端结构(VP3中不存在),这些结构同样对细胞特异性表达产生影响。
传统观点认为,当AAV衣壳将携带的基因成功递送进入细胞并完成解包后,其使命即告完成,接下来的转基因表达主要由细胞特异性的启动子或增强子来决定。然而,已有研究发现,一些AAV衣壳突变体尽管完成了感染的所有步骤(包括解包),但其mRNA表达水平却明显低于野生型衣壳,这提示AAV衣壳可能在顺式调控基因组转录中发挥一定作用。
近期,科学家首次明确证实并描述了AAV衣壳与载体基因组之间的相互作用。研究表明,衣壳、启动子及二者之间的互作共同决定了载体在细胞中的特异性转导能力。例如,在2002年的一项研究中,研究人员使用CMV启动子驱动基因表达,通过AAV载体递送以治疗癫痫,结果取得了显著的细胞特异性表达效果和良好的治疗效果。然而,当他们在最小CMV启动子前添加一个调控元件(类似“开关”)时,结果却截然相反,不但未能改善癫痫,反而加重了症状。进一步分析发现,尽管使用的是相同的衣壳和基因,仅仅在启动子序列中加入一个小的顺式调控元件,就导致了基因在抑制性神经元中高表达,而不是预期中的兴奋性神经元。这一发现再次强调了衣壳与启动子之间复杂而关键的互作关系,对AAV载体的精确设计具有重要启示意义。
这些出人意料的结果表明,虽然衣壳对两种细胞类型都具有趋向性,但转基因的表达选择性依赖于载体基因组中的顺式作用元件。过去20年来,启动子序列中微小差异为何会导致不同的表达模式,以及这种差异如何影响AAV在体内的治疗适用性,一直是未解之谜。不过,一项在大鼠中开展的实验提供了新的线索。在该研究中,研究人员发现,当AAV2衣壳携带CBA或CBh启动子时,均可在神经元中实现转导。然而,当换成AAV9衣壳时,表达模式却出现了显著差异:CBA启动子依然主要在神经元中表达,而CBh启动子则在少突胶质细胞中高表达。进一步研究表明,这种表达差异并非由单一的衣壳或启动子决定,而是由两者之间的互作所致。
为了深入探究这种互作机制,研究人员在AAV9的VP1/VP2区段插入了6个丙氨酸,构建出AAV9AU变体。当AAV9AU与CBA启动子结合使用时,仍能在神经元中表达;但与CBh启动子结合时,表达则从原本的少突胶质细胞重新转回神经元。这种表达转变并不是因为CBh启动子或AAV9AU衣壳对某一细胞类型具有限制性,因为两者本身对两种细胞类型都是兼容的。该结果表明,改变衣壳特定区域(本例中为VP1/VP2的N端)即可显著影响其与启动子的互作,进而改变转基因的表达谱。在更近期的大鼠和非人灵长类动物研究中,这一现象被进一步验证并扩展至CBA、CBh以外的其他启动子(如Jet 1启动子)。研究发现,虽然衣壳本身具有逆向转运能力,但真正决定基因表达位置的,是衣壳与不同启动子之间的互作关系。
这些研究不仅揭示了衣壳与启动子之间的互作在决定细胞特异性表达中的关键作用,也为我们理解AAV在不同细胞类型或物种中可能存在的潜伏现象提供了新的视角。研究指出,衣壳上的特定位点(例如AAV9衣壳中VP1/VP2的N端区域,或可能存在于所有中枢神经系统适用型衣壳中的关键区域)可能在这种互作中发挥重要作用。
鉴于ITR本身具有启动子活性,且通常位于启动子附近,研究其是否参与了这种互作,以及具体以何种方式参与,是一个亟待解决的问题。同时,进一步识别在这一过程中的宿主细胞因子也非常关键。目前,全球只有极少数研究团队致力于揭示ITR的生物学功能及其与宿主因子的潜在互作关系。这一知识空白可能正是导致AAV在体内治疗中需要高剂量、从而影响其安全性和疗效的核心原因之一。
破解这些谜题,或将为AAV载体的优化设计和临床治疗效果带来实质性突破。
参考资料:
1. Lester Suarez-Amaran, Liujiang Song, Anna P. Tretiakova, et al. AAV Vector Development, Back to the Future. Molecular Therapy. 2025; 33(5): 1903 – 1936. https://doi.org/10.1016/j.ymthe.2025.03.064