近期,Richard Jude Samulski在《Molecular Therapy》杂志(影响因子为12.1)上发表了一篇极具影响力的综述文章。该文系统性地回顾了AAV技术在过去40年间的演变历程,并深入探讨了人工智能驱动的衣壳工程、精准递送以及rAAV药物临床试验与商业化等未来发展方向[1]。这篇文章无疑是深入了解AAV行业过去与未来趋势的权威读物。前面两期我们分别介绍了AAV药物临床试验进展与现实挑战,AAV载体设计,本期我们将介绍AAV的分子进化路径,包括衣壳工程的进展和定向进化平台。文章有点长,但是真的值得你读完。
一、AAV衣壳:分子层面的杰作
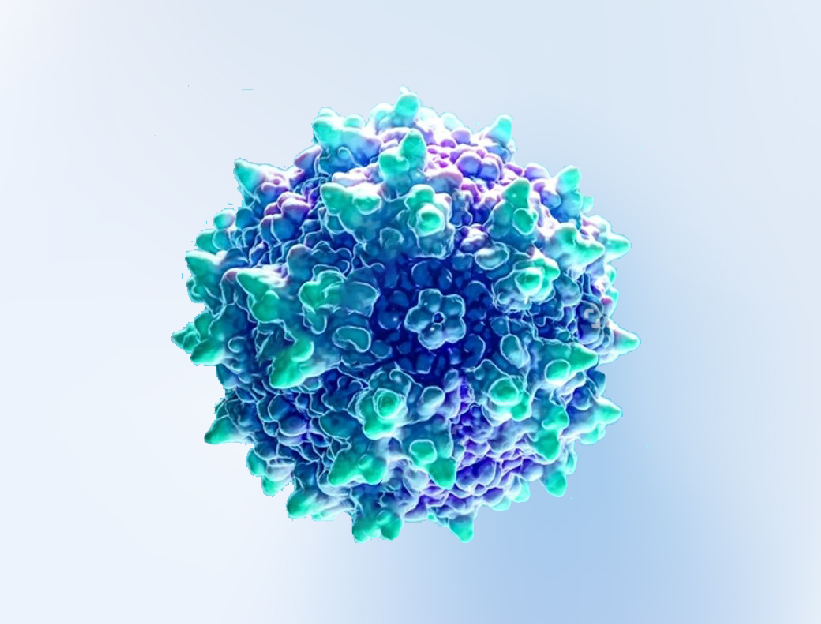
AAV的衣壳结构高度对称(图1),是其完成整个病毒生命周期各个关键步骤的核心组件,从附着宿主细胞、进入胞内、基因组释放到免疫逃逸,AAV衣壳都发挥着不可替代的作用。它不仅保护病毒基因组不被降解,还承担着引导病毒识别细胞、穿越细胞屏障、启动感染过程等任务。因此,AAV衣壳不仅在病毒学领域具有研究价值,更是AAV作为治疗性基因递送平台的核心所在。
![图1 aav的衣壳结构示意图[2]](https://www.packgene.cn/wp-content/uploads/2025/07/图1-AAV的衣壳结构示意图2.png)
图1 AAV的衣壳结构示意图[2]。
衣壳表面呈现出特有的突起和凹陷结构,可与特定宿主细胞的受体或辅助受体结合,进而决定AAV的组织嗜性(tropism)、细胞摄取能力与转导效率。
然而,仅有VP3的衣壳虽然可以高效合成,但缺乏VP1和VP2提供的关键功能,导致其转导活性不足,无法满足真正的治疗应用。例如,VP1独有的N端区域(uVP1)包含一个磷脂酶A2(PLA2)结构域,该结构在病毒通过胞吞进入细胞后,通过酸性内体环境激活,帮助病毒破坏内体膜,实现病毒基因组释放。如果该区域缺失或突变,会显著降低病毒感染能力,说明其在病毒生命周期中至关重要。不仅如此,最新研究还发现,uVP1具有蛋白酶活性,可能在病毒穿越内涵体、进入细胞核等阶段参与降解宿主细胞蛋白,重塑胞内环境,进一步增强AAV的转导效率。
尽管VP2并不是AAV衣壳形成所必需的蛋白,但研究发现其存在显著提升病毒的感染效率,说明VP2在病毒生命周期中发挥着辅助性支持作用。当VP2缺失时,AAV的转导效率会明显下降,提示VP2对于衣壳功能的优化和细胞内运输具有重要影响。
目前普遍认为,VP2可与VP1协同作用,一方面稳定衣壳结构,另一方面促进病毒颗粒的核内转运。虽然VP1因其酶活性(如PLA2功能)而被视为必不可少,但VP2通过提升整体转导效率,体现出与VP1之间的协同机制。两者共同保障了AAV衣壳的功能完整性和感染效率。
二、AAV衣壳工程化的新方向:从VP3到uVP1/VP2的功能拓展
1. 从VP3开始的衣壳优化之路
在过去多年,AAV载体的工程优化工作主要集中于VP3序列的改造。研究者通过对VP3的理性设计、定向进化等方式,成功开发出具备更强免疫逃逸能力、更高转导效率与组织特异性的AAV新型衣壳,尤其是在AAV2、AAV8、AAV9等经典血清型中已取得显著成果。这些改造有效降低了中和抗体的影响,提升了载体在临床应用中的表现。
近年来,科学界的关注已逐渐从VP3延伸至VP1与VP2的N端区域(统称为uVP1/VP2)。越来越多的研究表明,这一区域不仅影响衣壳结构的稳定性,还对宿主细胞的识别与感染路径具有重要调控作用。例如,工程化衣壳AAV-XV、AAV2.5T、AAV5.2在uVP1/VP2区域引入了特定突变,展现出新的功能特性。尤其是AAV5.2可绕过GPR108进入因子的依赖性,为在特定细胞类型中突破感染障碍提供了新路径,也为未来组织靶向设计开辟了新策略。
早在20多年前,Haberman等人在大脑中观察到AAV转导行为存在异常特性,提示可能存在衣壳与启动子之间的特殊互作。直到近年来,Powell等人首次明确证实:AAV9的uVP1/VP2区域的结构修改,会显著影响体内的细胞转基因表达水平,揭示了AAV衣壳结构对启动子活性的调节作用。
这是首次在体内层面上发现,AAV衣壳结构不仅影响组织嗜性和转导效率,还可能通过与宿主转录调控机制互作,调控基因表达。这一发现为未来衣壳—启动子协同设计的AAV载体策略提供了理论支持。
随后研究进一步发现,将AAV8的VP1 N端换入禽类AAV DA-1等非哺乳动物源病毒中,能够恢复其在哺乳动物细胞中的感染能力,进一步证实了VP1 N端在转录激活中的关键作用。
研究推测,这一现象可能与:染色质开放程度(chromatin accessibility)、组蛋白甲基化修饰、宿主因子在物种特异性基础上的结合与调控等机制密切相关,为AAV衣壳与宿主染色质环境之间的相互作用提供了新的研究视角。
在一项关于灵长类特异性血清型 AAV-LK03 的研究中,研究者通过在其VP3区域插入一个氨基酸,意外发现该变异可在小鼠中增强所递送基因的表观遗传激活。这一改造促进了活性表观遗传标记(如组蛋白修饰)在载体染色质上的积累,显著提升了AAV在小鼠中的转导效率,同时又不影响其在人类细胞中的表达性能。这些发现强调:AAV衣壳不仅决定病毒的感染能力,更会调控转基因启动子的活性,影响整个基因组表达的“开启”效率。特别是在uVP1/VP2区域的精细修饰,已被证实可直接影响AAV递送基因的转录活性。这种影响在不同物种中表现出明显差异,体现出AAV衣壳与宿主细胞之间复杂的表观遗传互作机制。
因此,未来在设计新一代AAV载体时,若能将衣壳调控转录表达的能力纳入理性设计或文库筛选流程,将有望开发出更高表达效率、组织特异性更强的载体平台,大幅提升基因治疗的临床效果与持久性。
6. AAV内部结构:被忽视的“黑匣子”
尽管目前对AAV表面结构(特别是VP3)已有深入了解,但其衣壳内部结构以及与基因组之间的相互作用仍然知之甚少。AAV基因组在衣壳中的精确排布方式,VP1和VP2在衣壳内部的空间定位与功能贡献,至今仍是AAV研究领域的一块“黑匣子”,有待进一步破解。当前我们对衣壳的理解,仍多停留在静态三维结构层面,而实际上它是一个动态调控平台。
在AAV功能复杂性的探索中,翻译后修饰(Post-translational Modifications, PTMs)正逐渐成为决定性因素:
- 磷酸化、糖基化、泛素化等PTMs,不仅影响衣壳的稳定性和免疫逃逸能力,还可调节其在细胞内的运输路径与基因释放效率;
- 不同血清型、生产工艺、存储条件甚至细胞内转导状态,都会导致PTMs的多样性与可变性;
因此,深入解析PTMs的类型与动态变化规律,将成为推动AAV治疗向更高层次进化的关键一步。
未来的AAV衣壳工程将融合多种前沿技术,迈向更高层次的智能化设计与个性化递送平台。这些技术包括:
- 冷冻电镜(Cryo-EM):用于解析衣壳的原子级结构;
- 基于质谱的蛋白质组学(MS Proteomics):揭示衣壳蛋白的翻译后修饰(PTMs);
- 分子动力学模拟(MD Simulations):预测衣壳在不同环境中的行为;
- 人工智能与机器学习算法(AI/ML):构建可预测衣壳功能的模型。
借助这些工具,科研人员可模拟并分析衣壳在不同宿主、生产体系、缓冲体系及物种背景下的行为变化,全面预测其稳定性、免疫逃逸能力、组织靶向性及治疗效果。这些技术融合将推动AAV从“标准工具”演进为高度智能、精准可调的治疗平台,为基因治疗树立新的技术标杆,开启精准医疗新时代。
三、AAV:进化工程的蓝图模板
天然AAV血清型虽具有良好的治疗潜力,但也存在诸多限制,例如:对某些细胞类型的转导效率低,组织分布过广(缺乏靶向性),容易被中和抗体清除。为突破这些瓶颈,科学界已建立三大主要策略来优化AAV衣壳:(1)定向进化(Directed Evolution);(2)理性设计(Rational Design);(3)组合式生物工程(Combinatorial Bioengineering)——融合以上两种策略。三者均旨在提升AAV载体的性能,但在方法学、应用范围和适配性方面各有特色。
病毒文库的理念可追溯至20世纪50年代,Walter Harm通过“标记拯救(marker rescue)”实验,奠定了病毒重组与进化机制的研究基础。随后,分子生物学的飞跃性进展——包括限制性内切酶的发现、抗生素抗性基因的应用、DNA测序技术、基于质粒的克隆方法等,极大加速了病毒DNA操作技术的发展,并于1982年促成AAV2基因组的首次成功克隆,标志着AAV载体研究进入新纪元。
1985年,George P. Smith发明了划时代的 “噬菌体展示(Phage Display)”技术,使科学家可将外源肽段展示在病毒表面,极大提升了靶向筛选与蛋白工程的效率。同年,Wells等人引入了寡核苷酸引导的理性饱和突变策略,首次实现在目标位点引入所有可能的氨基酸突变。该方法后来被进一步优化(如用NNG/C代替NNN减少终止密码子),并被广泛用于病毒文库构建。这些技术在20年后被引入AAV衣壳文库领域,推动该领域的快速发展。
直到1999年,Samulski团队通过插入突变筛选,系统分析了AAV2衣壳蛋白区域的耐受性,发现了一批仍能组装、包装并感染靶细胞的突变体,为AAV衣壳结构与功能的认知提供了重要基础。同年,Girod等人将携带整合素结合序列(RGD基序)的L14肽段插入AAV2衣壳的六个表面环区(I-261、I-381、I-447、I-534、I-573、I-587),并发现I-587突变体(VR-VIII区)能成功转导野生型AAV2难感染的细胞株。这项研究首次验证了AAV2衣壳可接受非病毒配体的功能性插入,明确了VR-VIII区是衣壳重定向的关键位点,并首次确认了RGD基序在AAV感染中的重要性。这不仅推动了理性设计与进化策略在AAV工程中的结合,也为开发特异性靶向载体开辟了新路径。
同年7月,Luca Perabo 和 Hildegard Büning 发表开创性研究,首次通过NNB密码子随机化构建出一个7肽文库,并将该文库插入AAV2衣壳的VP3 VR-VIII超变区,系统筛选出具备更高细胞特异性和感染效率的变体。这项研究首次验证了rAAV衣壳文库可用于精准提高递送效率与靶向性。
仅一个月后,Oliver J. Müller 和 Felix Kaul 也发表了类似思路的研究,使用NNK密码子随机化策略构建7肽文库,同样插入AAV2 VP3的VR-VIII环区。他们的做法通过NNK(N = 任意碱基,K = G或T)方式,最大限度提高了氨基酸多样性,同时避免引入终止密码子,拓展了构建功能型衣壳突变体的工程工具箱。
这两项开创性研究证明了饱和突变法在AAV衣壳文库构建中的高度可行性,奠定了理性设计AAV载体文库的理论与方法基础,也极大推动了AAV载体在精准治疗、跨物种递送、视网膜给药等领域的应用。直到今天,基于AAV2文库的探索依然不断带来突破性成果,例如:AAV2.GL 与 AAV2.NN 等先进血清型,展现出跨物种转导能力和优异的玻璃体内递送效率,广泛用于眼科疾病的基因治疗研究。这些成果不仅展现了文库策略的强大生命力,也证明了 “高通量筛选 × 精准设计”在AAV基因治疗领域的持久价值。
2003年AAV2文库技术成功之后,饱和突变策略迅速被推广至其他AAV血清型,并融合更复杂的筛选策略,进一步丰富了文库构建体系与选择机制。这也揭示出:AAV载体骨架的选择对实验结果有深远影响。例如,早在1999年,研究人员便将RGD整合素结合基序引入AAV2衣壳中,实现了精准的细胞重定向。2003年,这一结构被进一步用于AAV2文库中进行扩增筛选。近年来,该基序被用于AAV9骨架中,显示出强烈的体内肌肉靶向性(myotropic phenotype),成为设计肌肉靶向型AAV的关键策略之一。
近年来涌现出多个重塑AAV文库工程格局的先进技术平台,包括:
- CREATE
- M-CREATE
- iTransduce
- BRAVE
- TRACER
- TRADE
- DELIVER
- SEBIR(M34公司开发,尚未公开)
下滑查看技术平台详情介绍👇
同年,另一个具有开创性的文库平台BRAVE(Barcoded Rational AAV Vector Evolution)问世。该平台同样采用了Cre/loxP系统,但不同于前述平台,其基于AAV2骨架,并通过整合:源于病毒及内源蛋白的功能肽序列,条形码标记策略与计算辅助筛选算法,显著提升了文库设计效率与筛选精度。在筛选出的25种合成AAV2衣壳变体中,MNM008 和 MNM004尤其突出,展现出高度逆行感染能力,能够高效靶向神经元,拓展了AAV在神经环路追踪与靶向递送中的应用潜力。
与CREATE平台类似,BRAVE与iTransduce平台也依赖Cre/loxP系统,即需搭配转基因动物模型或额外Cre辅助元件,这在一定程度上限制了其跨物种应用与临床转化潜力。为突破这一局限,AAV定向进化领域的科研人员开始开发不依赖Cre系统的新一代筛选平台,使AAV文库筛选策略更具通用性、灵活性与临床可行性,同时也推动其在更广泛的科研与治疗场景中应用。
同年,Nakai H.团队推出了另一项重要创新平台——TRADE(TRAnscription-dependent Directed Evolution)。这是一个完全不依赖Cre系统的AAV文库筛选体系,以目标细胞的mRNA表达水平作为评估标准,选出最具转导能力的衣壳变体。TRADE平台基于AAV9文库构建了26个变体(HN1–HN26),其中,AAV-HN1在中枢神经系统展现出显著优于AAV9的转导能力;更重要的是,AAV-HN1在小鼠与非人灵长类动物中都表现出卓越性能,充分展示了其临床转化前景。
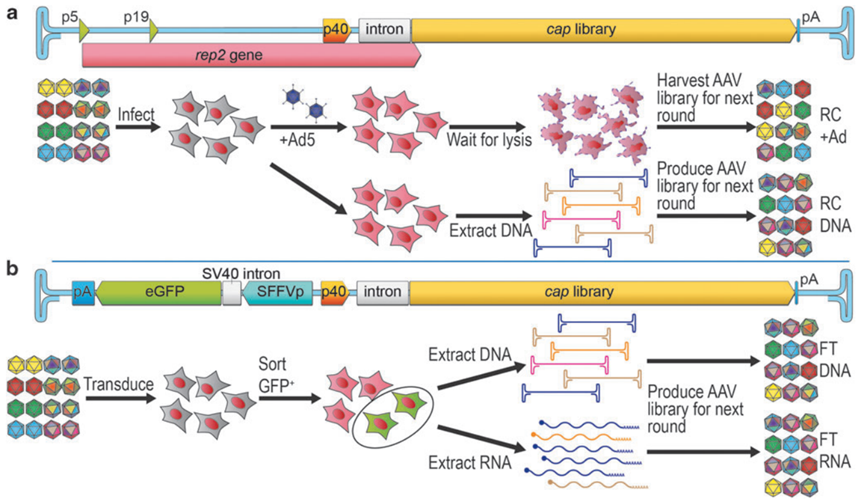
图2 AAV-p40平台[3]。(a)常规复制型(RC)平台。该平台以野生型 AAV2 基因组为骨架,在 cap2 位点插入衣壳文库。筛选流程为:先用 RC 衣壳文库感染靶细胞,再叠加感染野生型腺病毒,收集含已复制 AAV 变体与腺病毒的细胞裂解液(RC + Ad),直接进入下一轮筛选。另一种做法是,仅用 AAV 衣壳文库感染细胞而不进行叠加感染;随后从感染细胞提取 DNA,对 cap 基因进行 PCR 扩增并重新包装,以进行下一轮筛选(RC‑DNA)。(b)功能转导(FT)平台。该平台保留 Rep2‑p40 启动子以驱动衣壳文库表达,并将 p40 启动子上游的 rep2 序列替换为报告基因盒,如反向插入的 SFFV 启动子‑GFP 报告基因,与 p40‑cap 共同构成双向 SFFVrv‑p40 杂合启动子。在筛选过程中,先用 FT 衣壳文库转导靶细胞,再依据 GFP 荧光强度流式分选成功转导的细胞;随后从 GFP 阳性细胞的 DNA (FT‑DNA)和/或 mRNA (FT‑RNA)中回收衣壳编码基因,用于制备 AAV 载体以进行下一轮筛选,或克隆最终筛选得到的 AAV 候选体。AAV :腺相关病毒;Ad :腺病毒;FT:功能转导;GFP:绿色荧光蛋白;PCR:聚合酶链式反应;RC:复制型;SFFVp:病灶形成病毒启动子。
虽然AAV工程长期聚焦于VR-VIII超变区(如PHP、MYO系列的设计),但“AAV工程不是魔戒,不存在‘一突变统治所有’的神技”。实际上,AAV衣壳的多维复杂性要求研究者从更宏观的角度出发,构建更具结构层次与多区域协同优化的设计策略。
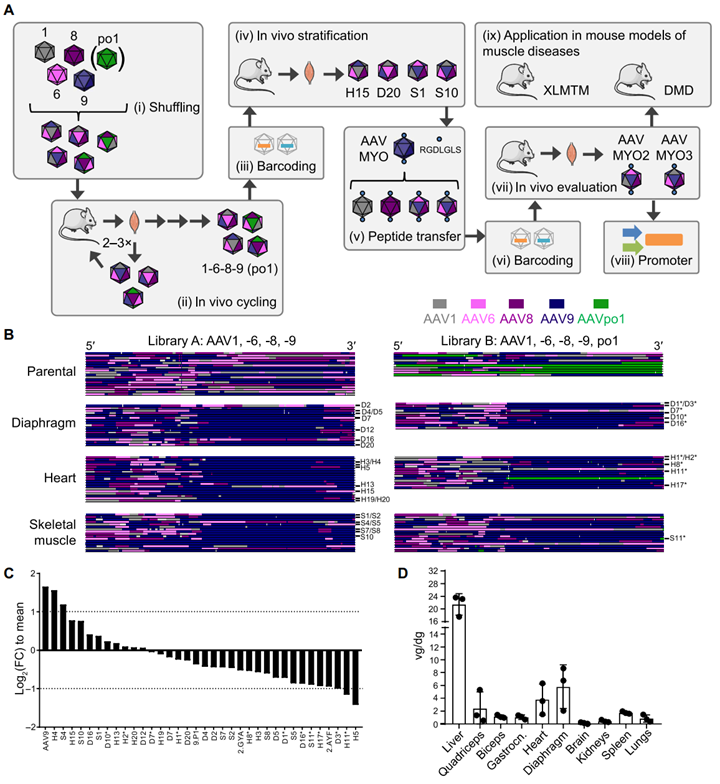
图3 半理性组合式工程方法AAV 衣壳文库的构建、体内进化与验证概览[4]。(A) 九步工作流程:(i)文库创建:对多种 cap 基因进行 DNA 家族重组,构建并生产两套 AAV 衣壳文库;(ii)体内筛选/循环:将文库经尾静脉注射入小鼠;从膈肌、心脏和骨骼肌回收载体基因组,扩增后再克隆生成二级文库并重复注射。(iii-iv)条形码标记与分层:为文库添加分子条形码,分析不同变体在小鼠体内的富集情况;(v)P1 肽嫁接:将肌肉靶向 P1 肽定向插入优选的重组衣壳;(vi)二次条形码标记:对新获得的工程化衣壳及基准对照再次赋码;(vii)野生型小鼠验证:评估各衣壳的肌肉特异性和转导效率;(viii)最佳组合筛选:将表现最优的两种衣壳(AAVMYO2、AAVMYO3)分别与两种肌肉高表达启动子配对;(ix)疾病模型应用:在两种人类肌肉疾病的小鼠模型中进行疗效评估。(B) 重组文库的序列分析。亲本来源:文库 A 由 AAV1、6、8、9 组成;文库 B 在此基础上新增 po1。可视化方式:每一行代表一个克隆,展示不同亲本片段在重组衣壳中的拼接分布。(C) 二级条形码文库组成。纵轴为各变体相对文库平均值的 log₂ 倍数变化(log₂ FC)。虚线标示 ±2 倍阈值:负值表示该变体比例下降,正值表示富集。FC 为 fold change。(D) 文库在多器官的病毒 DNA 分布。采用3 只C57BL/6J 小鼠(每点代表一只,注射剂量 1 × 10¹² vg/只,感染1 周后处死),检测各组织中每二倍体基因组对应的载体拷贝数(vg/dg,均值 ± SD)。载体基因组用 EYFP 探针定量,并以 RPP30 基因为内参。Gastrocn:腓肠肌;Quadriceps:股四头肌。
早在DNA重组技术正式提出前,已有学者尝试构建嵌合衣壳:2003年,Hauck与Xiao将AAV1与AAV2的衣壳区进行结构域互换,用于研究组织嗜性与抗原决定簇;2007年,Mark Kay团队系统性地将AAV2与AAV8衣壳进行重组,用于探索肝脏转导效率的结构基础;2021年,Mavis Agbandje-McKenna团队则通过不同血清型之间的uVP1或uVP1+VP1/2区段互换,开发出一系列感染力增强的AAV6嵌合变体,再次推动该策略向功能优化演进。
在传统“湿实验”之外,科学家也开启了“虚拟重组”的路径:2014年,Marsic D.团队提出“虚拟家族重组”策略,专注于对AAV2衣壳表面可变区(VRs)进行体外信息学组合,仅通过修改这些关键区段,即可构建大规模功能性文库;基于此平台,研究团队开发出一个AAV2衍生衣壳变体,在小鼠肝脏中实现比野生型AAV2高20倍的转导效率,性能接近AAV8。
近年来,随着对AAV衣壳功能的深入研究,科学家发现其作用远不止于受体识别与基因组递送。越来越多的证据表明,AAV衣壳还能影响其基因组的转录活性,甚至可能参与ssAAV基因组的修复过程,而这些机制尚处于研究初期。研究发现,病毒基因表达受三维染色质结构调控。病毒在细胞核内转录或修复其DNA时,必须适应宿主染色质环境。2018年,Christine Neuveut 团队发表重要研究,揭示了DNA病毒进入宿主染色质的三维结构存在特定倾向性,病毒更倾向于与处于转录活跃状态的染色质区域接触,并通过独特策略“接入”宿主的三维基因组网络。这项发现为理解病毒如何适应核内环境并实现精准表达打开了全新视角。
1. Lester Suarez-Amaran, Liujiang Song, Anna P. Tretiakova, et al. AAV Vector Development, Back to the Future. Molecular Therapy. 2025; 33(5): 1903 – 1936. https://doi.org/10.1016/j.ymthe.2025.03.064.
2. Lopez-Gordo E, Chamberlain K, Riyad JM, et al. Natural Adeno-Associated Virus Serotypes and Engineered Adeno-Associated Virus Capsid Variants: Tropism Differences and Mechanistic Insights. Viruses. 2024; 16(3):442. https://doi.org/10.3390/v16030442
3. Adrian Westhaus, Marti Cabanes-Creus, Timo Jonker, et al. AAV-p40 Bioengineering Platform for Variant Selection Based on Transgene Expression. Human Gene Therapy. 2022;33: 11-12. https://doi.org/10.1089/hum.2021.278
4. Jihad El Andari et al.Semirational bioengineering of AAV vectors with increased potency and specificity for systemic gene therapy of muscle disorders. Sci. Adv. 2022;8, eabn4704. DOI:10.1126/sciadv.abn4704
关于派真
作为一家专注于AAV 技术十余年,深耕基因治疗领域的CRO&CDMO,派真生物可提供从载体设计、构建到 AAV、慢病毒和 mRNA 服务的一站式解决方案。凭借深厚的技术实力、卓越的运营管理和高标准的服务交付,我们为全球客户提供一站式CMC解决方案,包括从早期概念验证、成药性评估到IIT、IND及BLA的各个阶段。
凭借我们独立知识产权的π-alphaTM 293 细胞AAV高产技术平台,我们能将AAV产量提高多至10倍,每批次产量可达1×10¹⁷vg,以满足多样化的商业化和临床项目需求。此外,我们定制化的mRNA和脂质纳米颗粒(LNP)产品及服务覆盖药物和疫苗开发的各个阶段,从研发到符合GMP的生产,提供端到端的一站式解决方案。