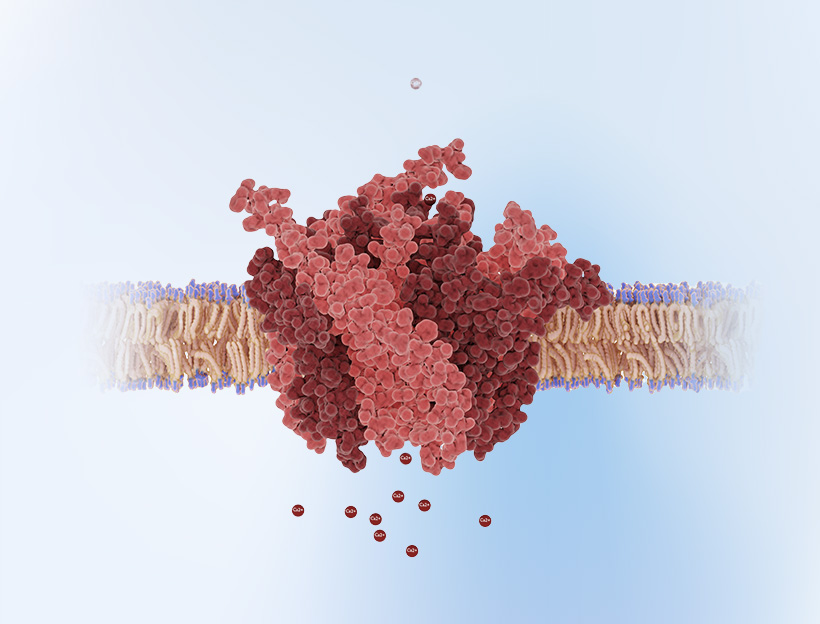
在基因功能研究的工具箱里,Cre-LoxP系统无疑是那把最锋利的“瑞士军刀”。但如何才能真正驾驭它?当它与腺相关病毒(AAV)这个高效的“快递员”相遇,又将释放出怎样的潜力?无论您是初识Cre-LoxP的新手,还是希望优化实验方案的资深研究者,本文都将为您提供一份从原理到实践的详尽指南。
一、什么是Cre-LoxP?
1.Cre和LoxP:系统的两大核心元件
- Cre重组酶(Cyclization recombination)
Cre重组酶(38kDa)是一种源自于P1噬菌体的“分子剪刀”(蛋白酶),可以特异性识别并催化LoxP位点间的DNA重组,其特点是不需要辅助因子,能在多种细胞类型和物种中高效工作。
- LoxP位点(Locus of X-over in P1)
一段34bp的DNA序列,包含两个13bp的反向回文序列,中间夹着一个8bp的间隔区(决定方向性)。它就像是贴在DNA上的“剪切在此”的标签,为Cre“剪刀”指明工作位置。
2. 重组机制
Cre重组酶通过以下步骤催化DNA重组:
重组结果取决于两个LoxP位点的相对方向和位置(图1):
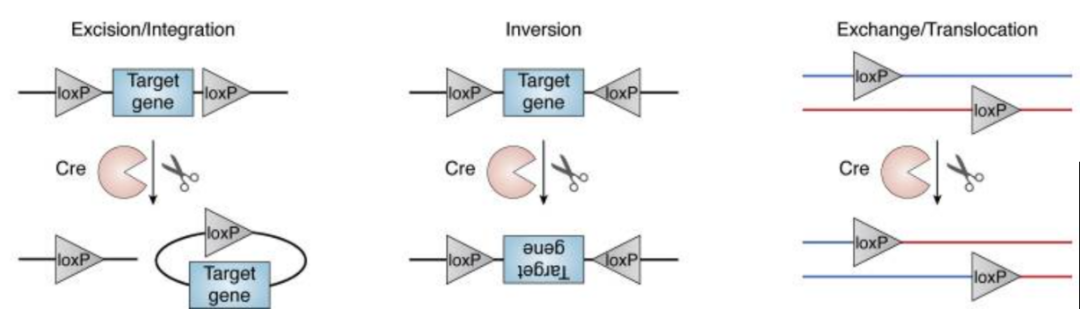
图1 Cre-LoxP四种经典重组模式示意图[1]
3. 常用策略
LSL系统(Lox-Stop-Lox)
在实际应用中,LSL策略(图2)应用最为广泛。
- 结构:在目标基因前插入被同向LoxP位点包围的转录终止序列
- 初始状态:终止序列阻断下游基因表达
- Cre介导重组后:终止序列被删除,目标基因得以表达
- 应用:条件性基因激活,如肿瘤模型中的致癌基因激活
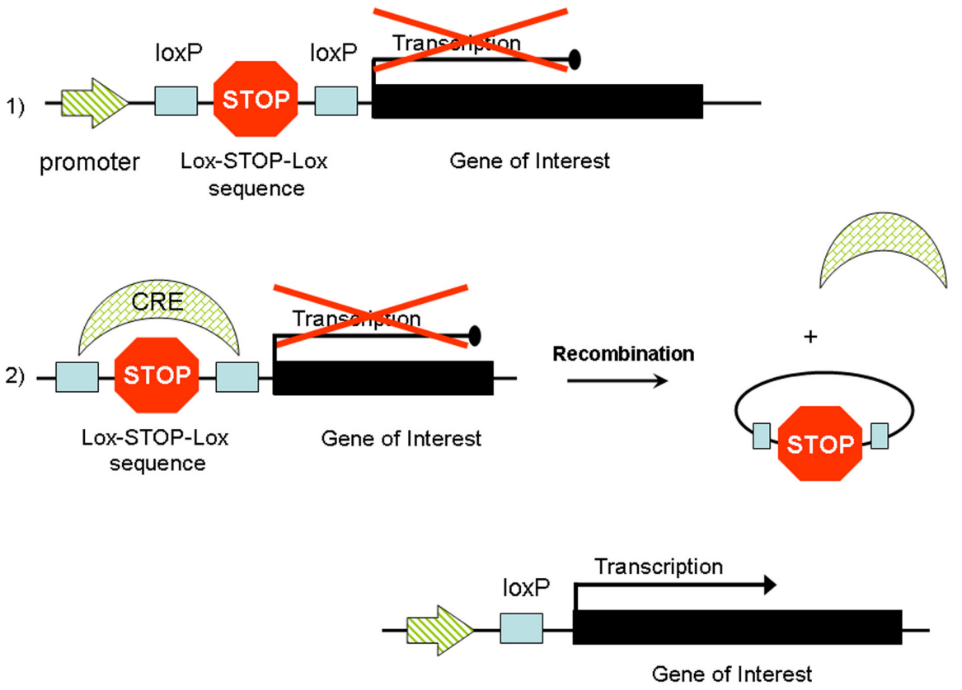
图2 CRE重组酶介导的Lox-Stop-Lox基因激活[2]
DIO(Double-floxed Inverse Orientation)系统
DIO提供更严格的基因表达控制(图3)。
- 结构:目标基因以反向构建在两对反向排列的LoxP位点之间
- 初始状态:反向插入的基因不产生功能性蛋白
- Cre介导重组过程:1) 无Cre存在时,反向插入的基因不产生功能性蛋白;2)Cre存在时,先通过一次重组将基因翻转至正确方向;3)第二次重组后,基因被”锁定”在正确方向,实现稳定表达
- 优势:显著降低背景表达,特别适用于神经科学等需要高度特异性的研究
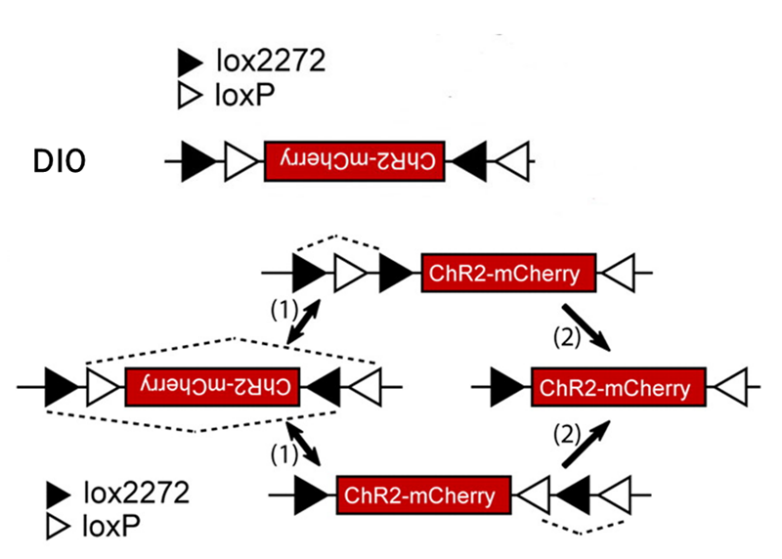
图3 DIO系统实现Cre依赖不可逆基因表达的示意图[3]
二、强强联合:为什么用AAV递送Cre-LoxP
传统上,要让Cre酶和LoxP位点在小鼠体内相遇,需要通过繁琐的转基因小鼠杂交,过程漫长且成本高昂。而AAV的出现,彻底改变了游戏规则。
AAV是一种安全、高效的病毒载体,像一个“快递员”,可以把我们想要的基因(比如Cre基因)精准地“派送”到特定组织、特定细胞中。
相比传统杂交,用AAV递送Cre-LoxP具有显著优势,可总结为“快、准、省”:
- 快:节省数月的实验周期
传统杂交:获得理想的实验动物至少需要3-6个月。
AAV递送:只需2-4周,即可在现成的floxed小鼠上开展实验。
- 准:实现前所未有的时空精度
时间精准:可在动物的任何发育阶段(如成年后)进行注射,避免胚胎期基因敲除可能带来的发育问题或致死效应。
空间精准:通过脑立体定位注射、局部给药等方式,可以实现对特定脑区、甚至单侧组织的精准基因编辑,另一侧则可作为完美的自身对照。
- 省:大幅降低成本和动物使用量
无需维持和繁育大量的转基因鼠群,显著节约了饲养成本和宝贵的实验动物资源。

三、AAV-Cre vs. AAV-LoxP,我该怎么选?
在实验设计中,一个常见的问题是:我应该用AAV递送Cre,还是递送LoxP?这取决于你手头已有的“材料”。
实验一:已有Floxed小鼠,选择AAV-Cre
你的小鼠:基因组的特定基因两侧已经被插入了LoxP位点(我们称之为Floxed小鼠)。这个基因目前是正常的。
你的工具:选择AAV-Cre。
工作流程:
1)选择一个合适的AAV血清型(决定病毒的组织亲和性)。
2)选择一个合适的启动子(决定Cre酶在哪些细胞类型中表达)。
3)将包装好的AAV-Cre病毒注射到Floxed小鼠的目标组织(如海马体、肝脏)。
4)AAV感染细胞后,表达出Cre“剪刀”,对带有LoxP的基因进行“剪切”(敲除或激活),从而实现组织特异性的基因编辑。
实验二:已有Cre小鼠,选择AAV-DIO/FLEX
你的小鼠:能在特定细胞类型中(例如,多巴胺能神经元)表达Cre酶(我们称之为Cre driver小鼠)。
你的工具:选择包含AAV-DIO-基因X或AAV-FLEX-基因X的载体。
工作流程:
1)设计一个AAV载体,其中你的目标基因X(如ChR2、EGFP)被DIO或FLEX结构“锁住”。
2)将此AAV病毒注射到Cre小鼠的目标组织。
3)只有在那些表达Cre酶的细胞里,这个被“锁住”的基因X才会被“解锁”和翻转,并开始表达。在其它没有Cre的细胞里,则完全没有表达。
这种策略实现了极高的细胞类型特异性,是神经环路研究、细胞功能研究的利器。
四、如何定制你的专属“快递”?AAV设计三步法
一个成功的AAV-Cre/LoxP实验,离不开精心的载体设计。以下“三步法”将帮助你做出关键决策:
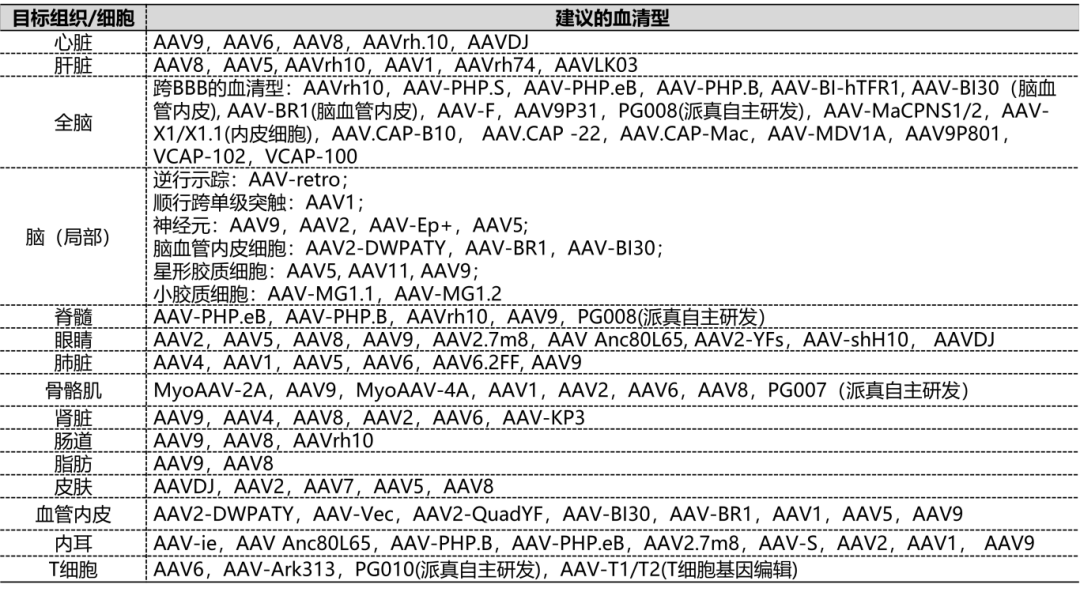
第一步:选择血清型——决定“去往何处”
AAV有多种不同的“外壳”,即血清型,它们决定了病毒更容易感染哪些组织(组织嗜性)。
派真生物可以为您提供以下AAV血清型:
第二步:选择启动子——决定“在哪里”表达
启动子是基因表达的“开关”,它决定了Cre酶或你的目标基因在哪种类型的细胞中表达。
广谱启动子 (CAG, CMV):表达强,几乎在所有细胞中都表达。适用于需要高效重组的场景。
组织特异性启动子 (TBG-肝脏, cTnT-心脏):只在特定器官中开启表达。
细胞类型特异性启动子 (hSyn-神经元):实现更精细的细胞定位,是神经科学研究的首选。
策略:优先选择文献中已验证过的“血清型+启动子”组合。同时注意启动子的大小,确保能被AAV载体(容量约4.7kb)装下。
派真生物可以为您提供以下组织/细胞特异性启动子:

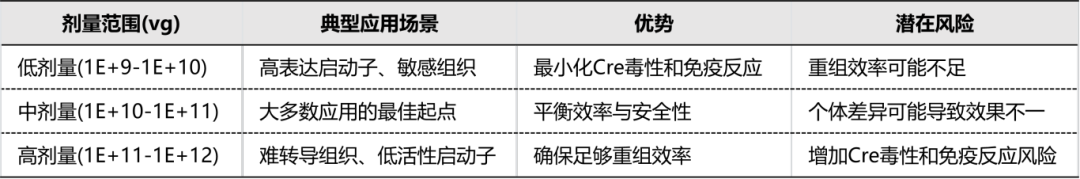
第三步:优化病毒剂量——平衡“效率”与“安全”
病毒剂量不是越高越好。过高的Cre表达可能对细胞产生毒性。
低剂量 (1E+9-1E+10 vg):适用于表达效率高的启动子或敏感组织,能最小化毒性。
中高剂量 (1E+10-1E+12 vg):适用于大多数常规实验,是平衡效率与安全性的理想起点。
策略:建议进行预实验,从小剂量开始,通过报告基因(如EGFP)评估不同剂量下的重组效率和细胞毒性,找到最佳的“窗口”。
五、应用实例:见证AAV-Cre/LoxP的力量
1. 神经元稀疏标记(sparse labeling)

实验设计与原理:
AAV-hSyn-Cre:在神经元中表达 Cre 重组酶,由 hSyn(人突触素启动子)驱动,特异性靶向神经元。
AAV-hSyn-DIO-tdTomato:含有双重倒置开放阅读框(DIO),只有在 Cre 存在时,tdTomato 红色荧光蛋白才会被表达。
两者联合使用时,只有共感染了 Cre 和 DIO-tdTomato 的神经元才会发出红色荧光,实现稀疏、清晰、单个神经元级别的标记。
实验操作:
将AAV-hSyn-Cre(0.05 μL,滴度为1–1.25×1013 vg/mL)与AAV-hSyn-DIO-tdTomato(0.05 μL,滴度为2.9×1012 vg/mL)混合后,通过脑立体定位注射至小鼠双侧内侧前额叶皮层(mPFC)(原文图5)。感染后约 4 周,取脑切片,观察 II/III 层锥体神经元的树突结构。使用高分辨率共聚焦显微镜成像,定量分析树突棘密度和形态。
实验结果:
- Mef2cL35P+/- 小鼠的蘑菇状和总树突棘密度显著低于野生型(WT)小鼠。
- 经过 AeCBE 碱基编辑治疗后,树突棘密度显著恢复,接近 WT 水平。
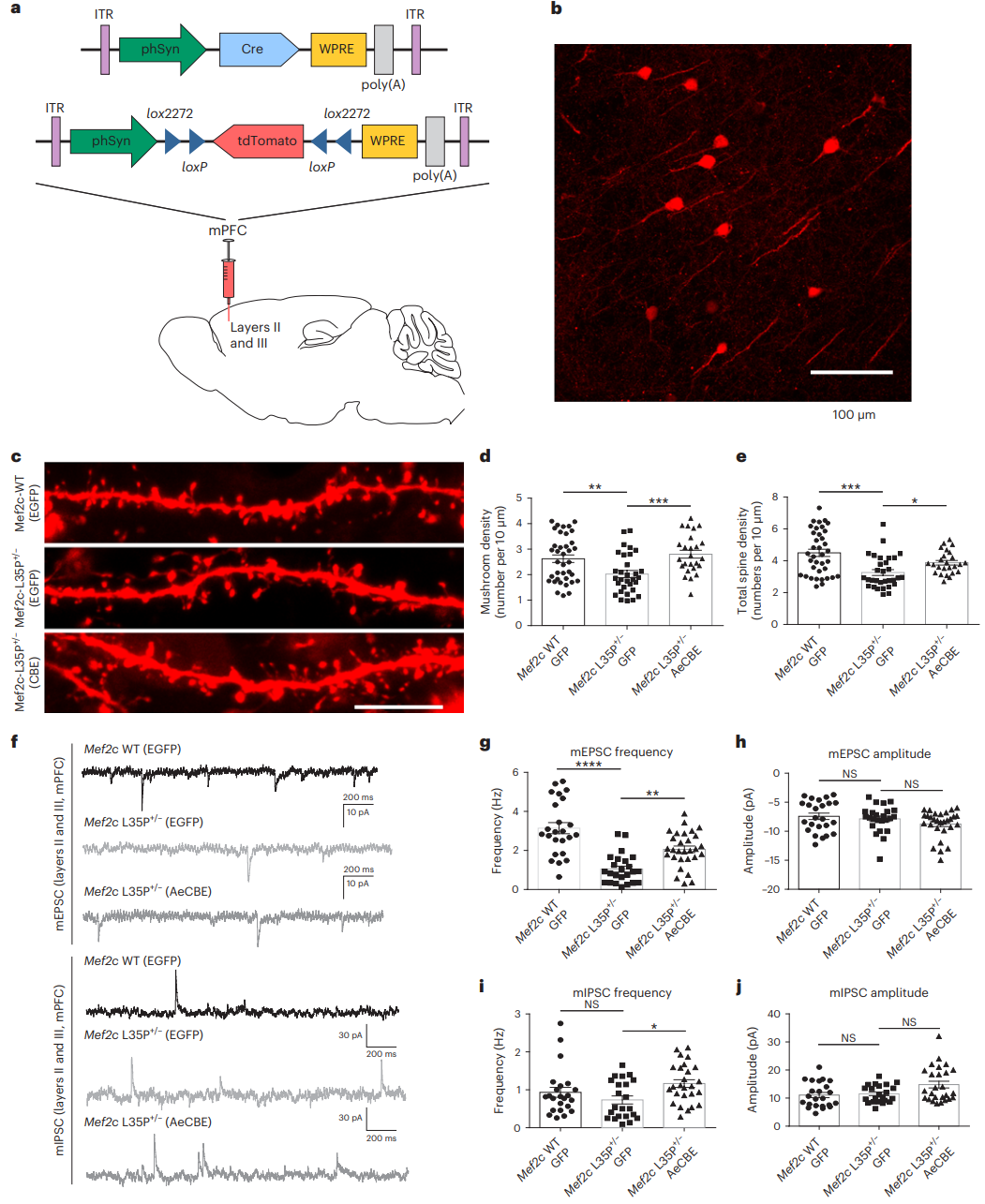
原文图5 在 AeCBE 编辑后,Mef2cL35P+/− 小鼠内侧前额叶皮层II/III 层神经元树突棘密度及突触传递功能的恢复情况。a 示意图:通过立体定位注射对Mef2c 野生型(WT)或 L35P+/− 小鼠 mPFC II/III 层锥体神经元进行稀疏标记。b 稀疏标记后 mPFC II/III 层锥体神经元的代表性图像。c AAV-EGFP 处理的 Mef2c WT 小鼠以及分别注射 EGFP 或 AeCBE 的 Mef2cL35P+/− 小鼠的原代皮层神经元树突代表性图像。d、e mPFC II/III 层锥体神经元主树突的蘑菇状(d)及总树突棘密度(e)定量分析。f mPFC II/III 层神经元微小兴奋性突触后电流(mEPSC)与微小抑制性突触后电流(mIPSC)的代表性电生理记录迹线。g mEPSC 频率定量。h mEPSC 振幅定量。i mIPSC 频率定量。j mIPSC 振幅定量。
2.用于操控神经元活动

在这篇文章中,研究者使用了AAV-retro-Cre-mCherry(逆行病毒)+ AAV-CAG-DIO-GtACR1(ArchT 类光抑制病毒)进行光遗传学抑制实验,以研究AHNVgat+神经元在焦虑和防御行为中的因果作用,特别是在面对陌生物体或高架十字迷宫开放臂这类“潜在威胁”情境下,AHNVgat+神经元是否是驱动回避行为所必需的[5]。
实验设计:
病毒注射:将AAV-retro-Cre-mCherry注入 AHN(目标脑区),用于标记投射到 AHN 的 vSub 神经元;将AAV-CAG-DIO-GtACR1注入 vSub(腹侧下托),通过这种组合,只有那些投射到 AHN 的 vSub 神经元才会被 retro-Cre 标记,从而驱动 GtACR1 表达,实现对这些特定投射神经元的光遗传抑制。
光纤植入:在 AHN 上方植入光纤,用于蓝光(473 nm)照射,实时抑制 AHNVgat+神经元活动。
行为测试:开放场 + 陌生物体实验观察小鼠是否因 AHNVgat+神经元被抑制而减少对陌生物体的回避。
高架十字迷宫(EPM)实验:观察小鼠是否因 AHNVgat+神经元被抑制而减少对开放臂的回避。
实验结果:
抑制 AHNVgat+神经元后,小鼠显著减少对陌生物体的回避行为(更多时间靠近物体)(原文图7)。在高架十字迷宫中,小鼠显著增加进入开放臂的时间和探索行为。
神经元可减少焦虑样回避行为.png)
原文图7 抑制投射至AHN的腹侧下托(vSub)神经元可减少焦虑样回避行为。a 示意图:采用逆向标记策略,双侧抑制投射至AHN的 vSub 神经元。b 代表性图像:vSub 中 GtACR1 表达(上),AHN 中 retro-Cre 表达(下)。c、d 代表性记录(c)与定量(d):蓝光脉冲(473 nm,20 ms,20 Hz)可急性且可逆地抑制表达 GtACR1 细胞的放电。e–h 开放场实验中,抑制投射至 AHN 的 vSub 神经元。i–k 高架十字迷宫(EPM)实验中抑制投射至 AHN 的 vSub 神经元。
3. 用于条件性基因敲除

在这篇文章中,研究者使用 AAV2-hSyn-mCherry-2A-Cre-WPRE-SV40A 病毒对背侧中缝核(DRN)中雌激素受体2(Esr2)进行了条件性敲除,以研究Esr2对情绪行为的性别差异调控作用[6]。
实验设计:
将 AAV2-hSyn-mCherry-2A-Cre-WPRE-SV40A 病毒直接注射到 Esr2fl/fl小鼠的DRN(原文图3),利用病毒携带的 Cre 重组酶在局部切除Esr2基因的第三外显子,从而实现该脑区Esr2的条件性敲除;对照组则注射不含 Cre 的 AAV2-hSyn-mCherry 病毒,仅表达红色荧光蛋白。病毒注射后 3 周,所有动物依次接受开放场(OF)、高架十字迷宫(EPM)和尾悬吊(TST)三项行为学测试。
实验结果:
在开放场测试中,Cre 病毒介导的 DRN-Esr2缺失使雌性小鼠在中心区域停留的时间显著减少,提示焦虑水平升高;而雄性小鼠的中心停留时间未受影响,表明该效应具有雌性特异性。在高架十字迷宫实验里,无论雌雄,敲除Esr2均不改变小鼠在开放臂的探索时间,提示 DRN-Esr2 对主动回避情境下的焦虑行为影响有限。尾悬吊实验则显示,DRN-Esr2缺失显著缩短了小鼠的不动时间,呈现抗抑郁样作用,且这一效应在雄性个体中更为明显。
综上,该研究利用 AAV-Cre 病毒精准敲除 DRN-Esr2,揭示了其在雌性中发挥抗焦虑功能、在雄性中则主要发挥抗抑郁作用,从而阐明了雌激素受体调控情绪行为的性别差异机制。
Esr2的条件性敲除.png)
原文图3 针对背侧中缝核(DRN)Esr2的条件性敲除。A 病毒注射策略示意图。B 行为测试时间线及实验分组示意图。C 代表性图像显示注射指定病毒后,不同基因型动物 DRN 内 mCherry 的表达情况(上图)。D DRN内病毒扩散体积的定量分析。E Cre 介导的 Esr2 缺失示意图,并标注用于检测缺失事件的 PCR 引物。F 使用引物对 p1 和 p5 对 DRN 脑区提取的基因组 DNA 进行 PCR 分析。G 高倍镜下展示图 C 中白框区域:mCherry(红色)与 Esr2 RNAscope 信号(绿色)共定位,并用 DAPI(蓝色)复染。H mCherry⁺细胞中 Esr2 与 mCherry 双阳性细胞百分比统计。
结语
AAV-Cre/LoxP系统是现代基因功能研究的基石,它将基因编辑的精度和灵活性提升到了一个前所未有的高度。通过理解其核心原理,掌握AAV的设计策略,科研人员就能够根据自己的实验需求,设计出最精准、高效的实验方案,从而加速对生命奥秘的探索。
常见“张冠李戴“误区及澄清
1. 误区:认为AAV-Cre携带LoxP位点
澄清:AAV-Cre仅携带Cre基因,LoxP位点存在于宿主基因组
2. 误区:认为AAV-LoxP递送Cre酶
澄清:AAV-LoxP携带被LoxP包围的目标基因,依赖宿主细胞内源Cre
3. 误区:混淆Cre依赖性表达载体(如AAV-DIO)与AAV-Cre
澄清:前者携带被LoxP修饰的目标基因,后者携带Cre基因本身
派真生物重组酶系列AAV现货产品列表(部分)


[3] Atasoy, D., et al., A FLEX switch targets Channelrhodopsin-2 to multiple cell types for imaging and long-range circuit mapping. J Neurosci, 2008. 28(28): p. 7025-30.
[4] Li, W.K., et al., Whole-brain in vivo base editing reverses behavioral changes in Mef2c-mutant mice. Nat Neurosci, 2024. 27(1): p. 116-128.
[5] Yan, J.J., et al., A circuit from the ventral subiculum to anterior hypothalamic nucleus GABAergic neurons essential for anxiety-like behavioral avoidance. Nat Commun, 2022. 13(1): p. 7464.
[6] He, J., et al., Sexually dimorphic effects of estrogen receptor 2 deletion in the dorsal raphe nucleus on emotional behaviors. J Neuroendocrinol, 2023. 35(2): p. e13195.
关于派真
作为一家专注于AAV 技术十余年,深耕基因治疗领域的CRO&CDMO,派真生物可提供从载体设计、构建到 AAV、慢病毒和 mRNA 服务的一站式解决方案。凭借深厚的技术实力、卓越的运营管理和高标准的服务交付,我们为全球客户提供一站式CMC解决方案,包括从早期概念验证、成药性评估到IIT、IND及BLA的各个阶段。
凭借我们独立知识产权的π-alphaTM 293 细胞AAV高产技术平台,我们能将AAV产量提高多至10倍,每批次产量可达1×10¹⁷vg,以满足多样化的商业化和临床项目需求。此外,我们定制化的mRNA和脂质纳米颗粒(LNP)产品及服务覆盖药物和疫苗开发的各个阶段,从研发到符合GMP的生产,提供端到端的一站式解决方案。