血脑屏障(BBB)是脑血管内皮细胞形成的高度选择性屏障,能有效防止外源物质进入中枢神经系统(CNS),保护大脑免受潜在有害物质的侵害。然而,这种保护机制也成为了CNS基因治疗的主要障碍,使得大多数药物和治疗载体难以到达大脑。目前,要实现有效的CNS基因递送,通常需要采用侵入性的鞘内或脑室内注射,或使用极高剂量的静脉注射,这些方法存在明显的安全隐患和技术挑战。
腺相关病毒(AAV)载体是目前基因治疗领域应用最广泛的递送系统,已有多款AAV基因治疗产品获批上市。然而,天然AAV衣壳跨越BBB的效率极低,限制了其在CNS疾病治疗中的应用。例如,唯一获批的静脉注射CNS基因治疗产品Zolgensma(用于治疗脊髓性肌萎缩症)需要使用高达1×1014 VG/kg的剂量,且仅限于2岁以下婴儿使用。
近期,《Molecular Therapy》杂志发表了一项突破性研究,Voyager Therapeutics公司的研究团队发现并鉴定了一种高度保守的脑血管受体ALPL(组织非特异性碱性磷酸酶),该受体可介导经过特殊设计的AAV衣壳VCAP-102高效跨越BBB,实现CNS的高效基因递送。这项发现不仅显著提高了AAV载体的CNS转导效率,更重要的是,该受体在从啮齿类到灵长类的多种物种中高度保守,为CNS基因治疗提供了一种可能的通用解决方案。

一、VCAP-102的发现:RNA引导的AAV定向进化
传统的AAV衣壳改造策略通常受限于种属特异性,在啮齿类动物中表现良好的改造型AAV,往往在灵长类动物中效果不佳,反之亦然。这种”种属壁垒”严重制约了AAV载体从动物模型到临床应用的转化。
Voyager Therapeutics公司的研究团队利用其专有的TRACER(Translationally Optimized Capsid Evolution via RNA)技术平台,在食蟹猴体内进行了AAV9衣壳的定向进化筛选。他们首先构建了AAV9″热点”文库,系统评估了AAV9衣壳表面不同位点对随机6肽插入的耐受性,发现位于衣壳三重轴尖峰的VR-IV区域(可变区域IV)高度适合肽插入,且不显著影响衣壳的组装和转导能力。基于这一发现,研究团队构建了针对VR-IV区域的随机肽插入文库,并经过在食蟹猴体内进行多轮筛选,最终分离获得了两个高性能变体:VCAP-101和VCAP-102(图1)。令人惊喜的是,这两个在灵长类动物中筛选出的变体,在小鼠中同样展现出优异的BBB穿透能力,这与以往的经验(啮齿类与灵长类之间存在种属特异性)形成鲜明对比。
这两个变体共享一个关键的氨基酸模体:丝氨酸-脯氨酸-组氨酸(SPH),位于插入位点的456-458位,后面跟随一个带正电荷的氨基酸(赖氨酸K或精氨酸R)。冷冻电镜结构分析证实,这一插入肽位于AAV9衣壳VR-IV区域的顶端,形成了一个突出的结构域。
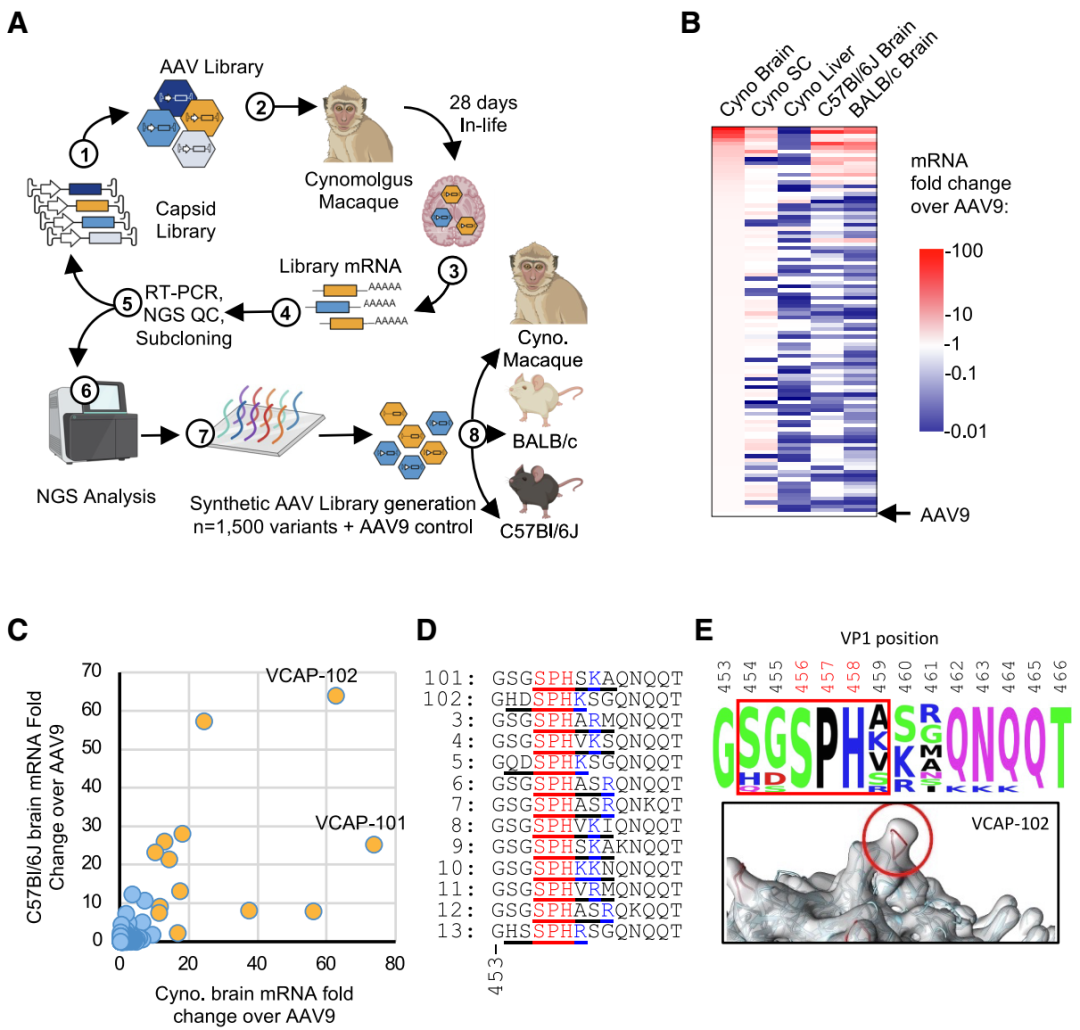
图1. 基于TRACER的体内筛选设计及最佳候选衣壳
(A) TRACER-NHP定向进化流程示意图。(B) 步骤(8)中在食蟹猴脑部富集度最高的100种衣壳的热图。色阶表示这100种衣壳在所示组织内相较于AAV9的mRNA富集分数。SC:脊髓。(C) 1,500种衣壳在食蟹猴和C57Bl/6J小鼠脑中的表现对比。在猕猴脑中相对AAV9富集度>10倍的衣壳以橙色突出显示。(D) 来自(C)中富集程度最高的衣壳的VR-IV肽插入序列。6氨基酸插入位置以下划线标示;保守的SPH基序及邻近带正电的残基分别以红色和蓝色突出显示。(E) 富集程度最高的衣壳插入肽的位置与序列保守性。上图:由(C)中前13条序列得到的共有序列。红色标注的456–458位对应保守的SPH基序。下图:VR-IV环在VCAP-102中的冷冻电镜三维结构。插入的6氨基酸肽以红色高亮,对应于上图方框中的454–459位。
派真生物可提供与TRACER平台类似的体内定向进化筛选服务,利用我们成熟的AAV衣壳展示文库和高通量测序分析平台,可以在您指定的动物模型中,为您筛选具有特定组织靶向性(如靶向CNS、肌肉、肝脏等)的新型AAV衣壳。无论您的目标是提高靶向效率,还是降低脱靶效应,我们都能为您提供从文库构建、体内筛选到候选衣壳鉴定的一站式解决方案,加速您的AAV基因治疗项目研发进程。
二、VCAP-102在啮齿类和灵长类动物中表现优异
1. VCAP-102在小鼠中的表现
研究团队通过静脉注射方式(1×1013 VG/kg)向BALB/c小鼠递送携带报告基因的VCAP-102,并与标准AAV9进行对比。结果显示,VCAP-102在整个大脑和脊髓中均呈现广泛分布,其病毒DNA生物分布和转基因RNA表达水平比AAV9高出约20-40倍(图2)。
更值得注意的是,VCAP-102在肝脏中的表达显著降低,相比AAV9减少了14倍,这对降低肝脏毒性、提高治疗安全窗口具有重要意义。
剂量梯度研究表明,VCAP-102呈现良好的剂量依赖性响应,在最高剂量(1×1014 VG/kg)下,能转导皮层中高达40%的细胞,且在神经元和星形胶质细胞之间分布均匀。
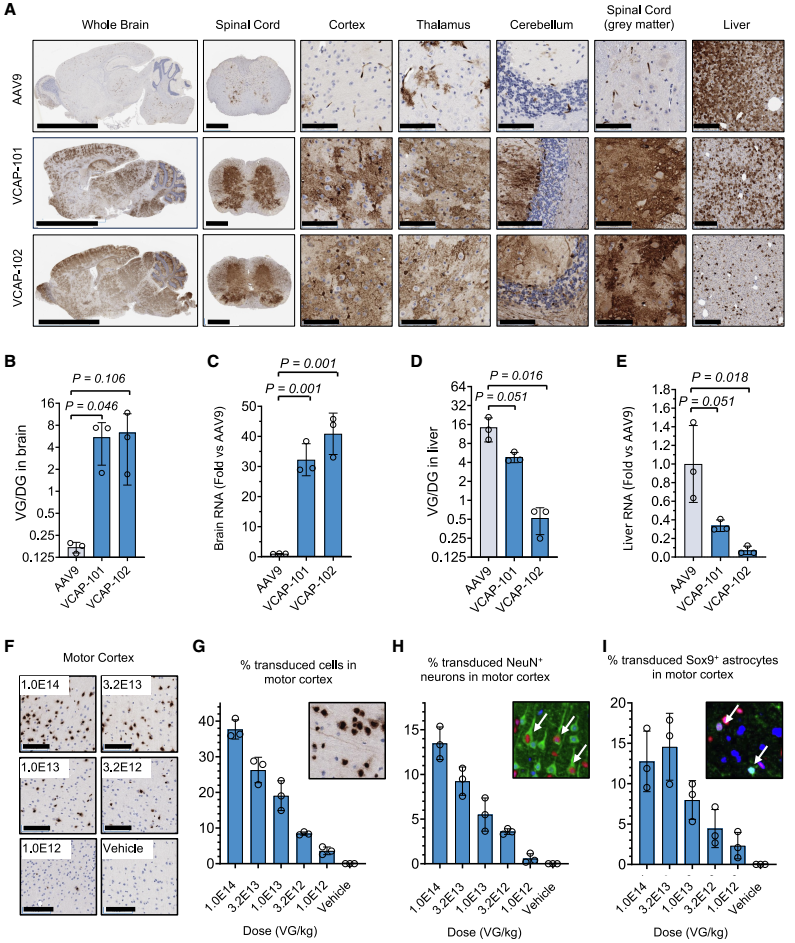
图2. VCAP-101 和 VCAP-102 在小鼠脑部表现出更强的中枢神经系统趋向性。
(A) BALB/c 小鼠中枢神经系统及肝脏的转导。将携带自互补CAG-ZsGreen-HA转基因的衣壳以 1×10¹³ VG/kg 的剂量经尾静脉注射。注射后 28 天,用抗-HA 抗体对组织进行染色。 (B 和 C) 脑组织中转基因的 qPCR 定量。DNA 数值以每二倍体基因组的病毒基因组数(VG/DG)表示;RNA 数值以 AAV9 为基准进行归一化。(D 和 E) 肝脏中转基因的 DNA 和 RNA 水平。(F) 经尾静脉注射携带单链CAG-H3F3-HA转基因的VCAP-102后,小鼠运动皮层的剂量依赖性转导。(G) 通过抗-HA 与苏木素共定位,从 (F) 中测得的皮层转导细胞百分比。(H 和 I) 分别通过 HA/NeuN 或 HA/Sox9 共定位测得的转导神经元 (H) 或星形胶质细胞 (I) 百分比。(G–I) 中的插图显示免疫组化和免疫荧光染色示例;箭头指示双标细胞。每个数据点代表一只独立小鼠,所有图示数值均为均值 ± 标准差(n = 3)。
2. VCAP-102在灵长类动物中的表现
为评估VCAP-102在灵长类动物中的性能,研究人员向非洲绿猴静脉注射1×1013 VG/kg的AAV9或VCAP-102。结果表明,VCAP-102在多个脑区每个细胞平均递送1-2个病毒基因组,比AAV9高4-24倍,转基因RNA表达提高16-186倍(图3)。
高通量分析显示,VCAP-102能转导大脑中高达50%的细胞,包括星形胶质细胞和神经元。与小鼠中的观察结果不同,在灵长类动物中,VCAP-102对Sox9阳性星形胶质细胞的偏好性高于神经元。
研究团队还在另一种灵长类动物——狨猴中进行了验证,结果更为惊人:VCAP-102比AAV9递送的病毒基因组增加高达280倍,转基因RNA表达提高500倍。
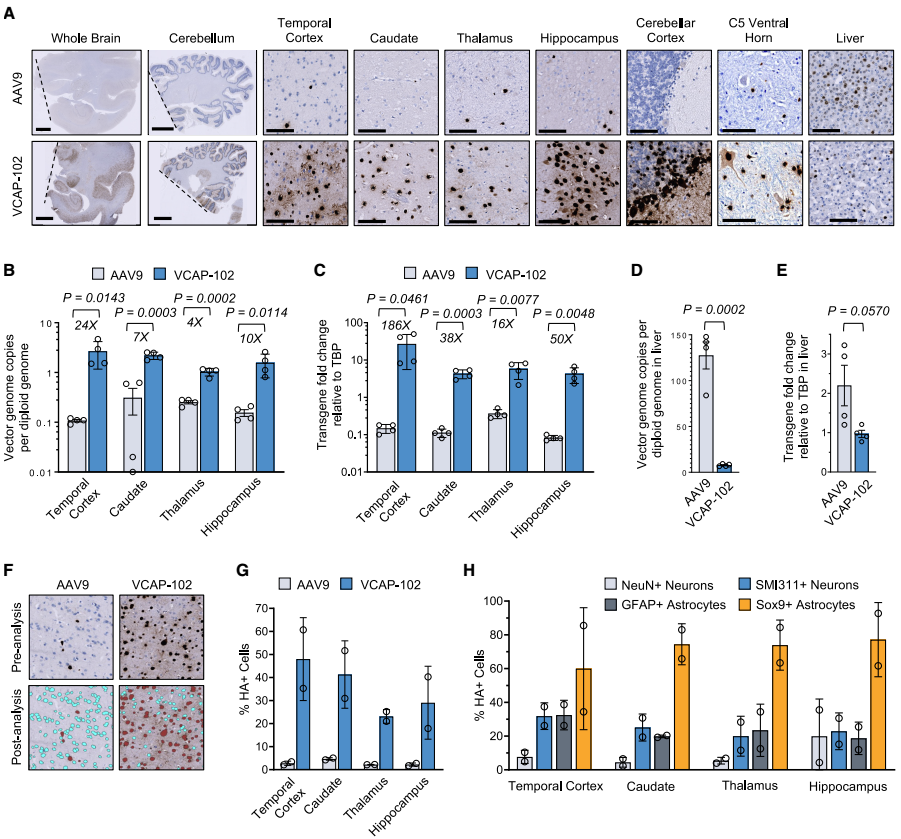
图3. VCAP-102 在非洲绿猴中表现出增强的中枢神经系统靶向性。
(A) 灵长类中枢神经系统转导的代表性图像。非洲绿猴经尾静脉注射 1×10¹³ VG/kg 携带自互补 CAG-H2B-HA 转基因的 AAV9 或 VCAP-102 衣壳,28 天后用抗-HA 标签抗体染色。全脑及小脑图中的虚线表示正中矢状切开轴。(B) 用 ddPCR 测定所示脑区中的病毒 DNA。(C) 转基因 mRNA 在脑中的表达量,以管家基因 TBP 为参照进行归一化。(D) 肝脏中的病毒基因组 (VG) 定量。(E) 肝脏中的转基因 mRNA 表达量。(F) 通过核 H2B-HA 与苏木素共定位,采用自动化高通量方法定量转导细胞。(G) 所示脑区中 HA⁺细胞核的定量。(H) 在 VCAP-102 给药猴子中,HA⁺细胞占各指示标志物阳性细胞的百分比。(G) 和 (H) 中的数据为每只猴子的单一脑片(n = 2)。
三、ALPL:VCAP-102跨BBB的关键受体
为了理解VCAP-102穿透BBB的分子机制,研究人员采用了两种互补的策略:Retrogenix细胞微阵列筛选人类表面蛋白,以及使用慢病毒人类ORFeome文库的转导筛选。两种方法均鉴定出ALPL(碱性磷酸酶,又称组织非特异性碱性磷酸酶TNAP)作为最特异的相互作用分子。
ALPL是一种高度保守的GPI锚定细胞表面蛋白,在肝脏、骨骼、肾脏和大脑等多种组织中表达。在大脑中,ALPL主要表达于内皮细胞,这支持其在BBB转运中的潜在作用。
1. ALPL是VCAP-102的主要受体
通过一系列实验,研究人员证实了ALPL确实是VCAP-102的主要受体:
- 在HEK293T细胞中过表达人类ALPL,特异性增加了VCAP-101和VCAP-102的转导效率;
- 在自然表达ALPL的HeLa细胞中,用小干扰RNA敲低ALPL表达,显著降低了VCAP-102的转导;
- 表面等离子体共振(SPR)分析表明,VCAP-102在pH 7.4下直接与ALPL相互作用,亲和力(KD)约为20 nM;
- 抗ALPL抗体预孵育HeLa细胞,显著降低VCAP-102的转导,而对AAV9无影响;
- 使用GPI切割酶PI-PLC移除膜相关GPI锚定蛋白,对VCAP-102转导产生负面影响。
这些实验数据共同支持ALPL作为VCAP-102的主要细胞表面附着受体的角色。
2. ALPL介导VCAP-102跨BBB转运
为了证明ALPL能够介导VCAP-102跨越内皮细胞屏障,研究人员建立了一个MDCK(犬肾上皮细胞)细胞Transwell迁移模型。在这个模型中,外源表达人类ALPL诱导VCAP-102的转胞吞作用显著增加(>100倍),而对AAV9迁移无明显影响。
值得一提的是,研究人员观察到VCAP-102与ALPL形成的复合物在pH 5.5时迅速解离,这暗示了一种可能的释放机制:当衣壳被内吞后,随着内体酸化,衣壳从受体解离并释放到内皮细胞的基底侧。这一特性与其他已知的BBB转运受体配体(如转铁蛋白受体抗体)相似。
3. ALPL在体内影响VCAP-102的CNS转导
研究发现,ALPL在小鼠脑血管上的表达随年龄增长而增加。为验证ALPL表达水平是否会影响VCAP-102的转导效率,研究人员比较了年轻(6-8周龄)和年老(约18月龄)C57Bl/6J小鼠接受VCAP-102后的转导情况(图4)。
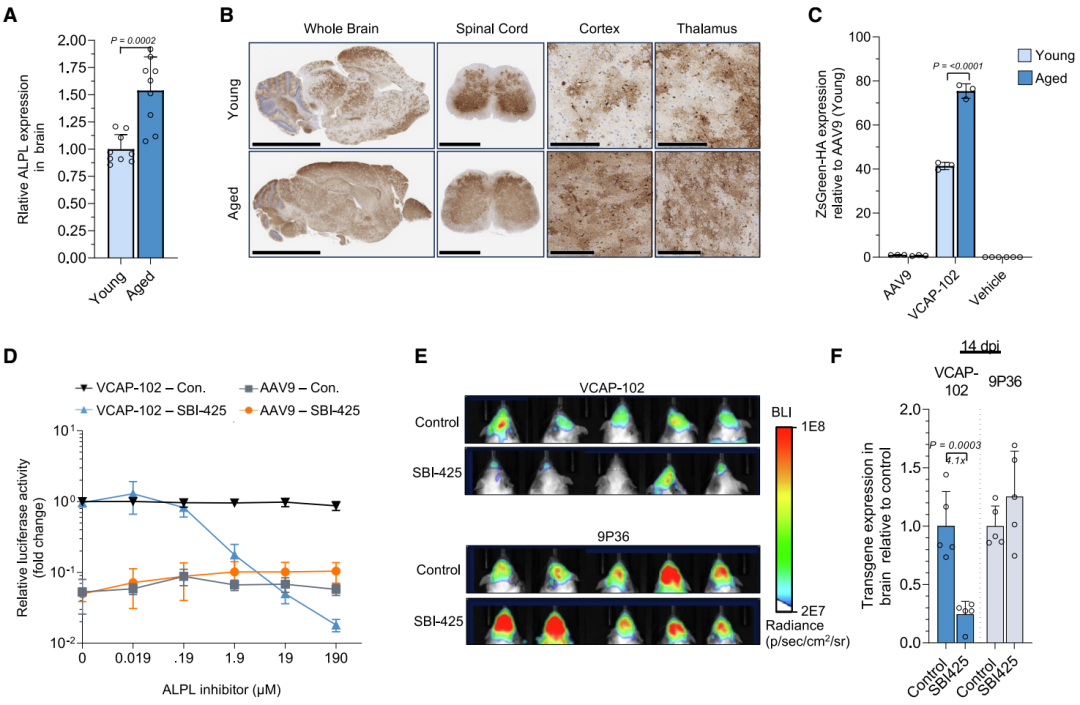
图4. ALPL在体内对 VCAP-102 脑转导效率的影响。
(A) ALPL 在幼龄(6 周)与老龄(18个月)小鼠中的表达量,以 mTBP 管家基因作为内参。数据为平均值 ± 标准差(n = 9),并以幼龄小鼠数据归一化。(B 与 C) VCAP-102 在幼龄和老龄小鼠中的中枢神经系统转导效率。(B) 经 1×10¹³ VG/kg 携带 scAAV-CAG-zsGreen-HA 的 VCAP-102 转导后 28 天,脑组织进行抗-HA 染色。(C) 幼龄和老龄小鼠脑内转基因 mRNA 表达水平。(D) HeLa 细胞经 ALPL 抑制剂 SBI-425 处理后,再用 1×104 VG /细胞的AAV9或VCAP-102-荧光素酶感染。(E) 给予 35 mg/kg ALPL 抑制剂 SBI-425 的小鼠脑转导情况。携带荧光素酶转基因的VCAP-102或9P36衣壳以2×10¹³ VG/kg 静脉注射。注射后 7 天,体内成像检测脑内荧光素酶活性。(F) 来自 (E) 的小鼠脑内转基因 mRNA 水平。
结果表明,相比年轻小鼠,年老小鼠的ALPL mRNA表达提高1.5倍,病毒转基因表达在整个大脑和脊髓中增加1.8倍,支持ALPL表达水平与VCAP-102的CNS转导效率直接相关。
研究人员还利用ALPL小分子抑制剂SBI-425研究了ALPL抑制对VCAP-102转导的影响。体外实验显示,SBI-425显著抑制了VCAP-102的转导。体内实验进一步证实,SBI-425预处理导致小鼠脑部VCAP-102-荧光素酶信号减少2.5倍,而使用已知通过CA4受体跨BBB的对照衣壳9P36不受影响。这再次支持ALPL在VCAP-102高效BBB转运和CNS转导中的核心作用。
四、ALPL:一种高度保守的跨物种BBB转运载体
ALPL在哺乳动物中高度保守,研究人员证实VCAP-102能与人类、猕猴、小鼠和猪的ALPL在体外发生功能性相互作用。这一发现具有两方面重要意义:
- 临床转化前景广阔:VCAP-102载体很可能在人类患者中具有良好的有效性,为CNS基因治疗提供了一个有力的候选载体;
- 研究模型的便利性:VCAP-102可在常见动物模型中有效使用,无需替代载体或人源化转基因动物,极大简化了未来CNS靶向治疗的研发过程。
ALPL的跨物种保守性使VCAP-102成为一种真正的”通用型”CNS基因递送载体,有望克服以往AAV载体在种属间转化面临的挑战。
此外,鉴定ALPL作为受体的另一个关键优势是能够预测患者群体中的基因递送水平。研究观察到VCAP-102转导与ALPL表达水平之间存在强相关性,如在ALPL表达水平较高的狨猴和老年小鼠中表现出惊人的高转导效率。
五、VCAP-102在基因治疗领域的应用前景
VCAP-102在多种动物模型中展现的优异性能,为CNS基因治疗开辟了广阔前景:
1. 提高治疗安全窗口
相比AAV9,VCAP-102显著提高了CNS转导效率,同时降低了肝脏转导。这一特性有望在较低剂量下实现临床有效的CNS基因转移,同时最小化肝脏毒性,从而提高治疗安全窗口。
VCAP-102在1×1013 VG/kg剂量下即能有效转导大量脑细胞,这一剂量远低于AAV9基因治疗产品Zolgensma使用的1×1014 VG/kg剂量,且完全在公认的AAV治疗安全范围内。
2. 适用于各类基因治疗策略
研究表明,VCAP-102无论携带单链基因组还是自互补基因组,都能实现高效转导,这意味着它适用于各类治疗策略,包括基因替代、基因沉默和基因编辑等。
3. 覆盖广泛的细胞类型
VCAP-102能有效转导脑内多种细胞类型,包括神经元和星形胶质细胞,使其可用于针对不同类型CNS疾病的治疗,如神经退行性疾病、代谢性疾病和脑发育障碍等。
4. ALPL作为BBB转运载体的广泛应用
除了AAV载体,ALPL还可能被用于改善其他非病毒递送模式的BBB穿透能力,如抗体、纳米抗体、肽和适配体等。这为开发新一代CNS靶向生物治疗剂提供了新途径。
六、结论与展望
VCAP-102的发现及其受体ALPL的鉴定代表了AAV载体开发领域的一项重大突破。这种跨物种CNS靶向AAV载体为克服血脑屏障这一长期挑战提供了新的解决方案,有望推动CNS基因治疗进入新时代。
尤其值得注意的是,ALPL作为一种高度保守的膜锚定受体,能够高效转运大分子复合物跨越BBB,这一特性不仅适用于AAV载体,还可能被用于改善各类生物治疗剂的CNS递送。
从“新星”到“利器”:我们为您的创新加速
一个优秀的AAV衣壳变体,从实验室的筛选成功到最终成为能用于临床前研究的可靠工具,离不开稳定、高效、规模化的病毒包装生产工艺。
我们拥有多年的AAV生产经验和完善的质量控制体系,可为您提供高质量的AAV包装服务,无论是您通过定向进化筛选得到的新型衣壳,还是已发表的各种改造衣壳,我们都能为您提供从质粒构建、病毒包装纯化到功能验证的全套服务。让我们专业的服务,为您扫除从“想法”到“产品”的障碍,让您的创新研究如虎添翼。
关于派真
作为一家专注于AAV 技术十余年,深耕基因治疗领域的CRO&CDMO,派真生物可提供从载体设计、构建到 AAV、慢病毒和 mRNA 服务的一站式解决方案。凭借深厚的技术实力、卓越的运营管理和高标准的服务交付,我们为全球客户提供一站式CMC解决方案,包括从早期概念验证、成药性评估到IIT、IND及BLA的各个阶段。
凭借我们独立知识产权的π-alphaTM 293 细胞AAV高产技术平台,我们能将AAV产量提高多至10倍,每批次产量可达1×10¹⁷vg,以满足多样化的商业化和临床项目需求。此外,我们定制化的mRNA和脂质纳米颗粒(LNP)产品及服务覆盖药物和疫苗开发的各个阶段,从研发到符合GMP的生产,提供端到端的一站式解决方案。