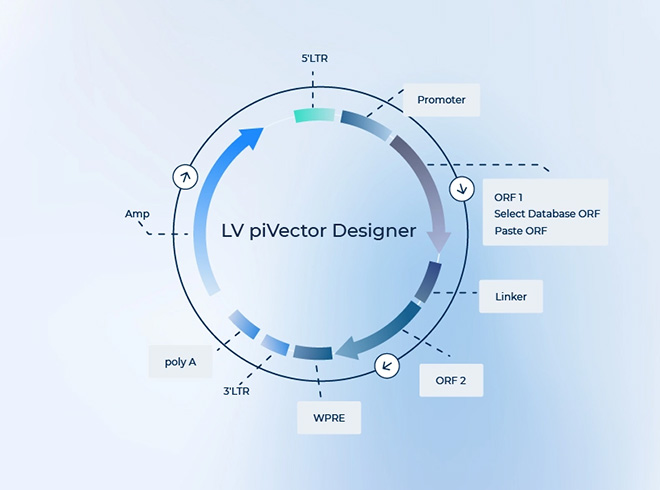
设计过表达慢病毒(Lentivirus)载体是基因转导和基因治疗研究中的常见操作,通常用于研究基因功能、疾病模型的构建以及潜在的治疗策略。以下是设计过表达慢病毒的基本步骤:
1. 选择合适的慢病毒载体
选择合适的慢病毒载体是设计过程中的第一步。慢病毒载体通常由几个基本部分组成:
-
LTR (Long Terminal Repeat):长末端重复序列,负责慢病毒基因组的转录调控。
-
gag-pol基因:编码慢病毒的结构和复制酶(例如,逆转录酶、整合酶等)。
-
env基因:编码外壳糖蛋白(例如,VSV-G),用来让病毒颗粒进入目标细胞。
-
CMV启动子或其他启动子:用于启动外源基因的表达。
常见的慢病毒载体如pLenti系列载体,能够在宿主细胞中高效表达外源基因。载体可能已经预设计了可供插入的多克隆位点(MCS),方便插入目标基因。
2. 设计外源基因
设计过表达慢病毒时,首先要确定目标基因,并设计适合的表达框架:
-
选择目标基因:选择希望过表达的基因。这可以是任何与研究相关的基因。
-
编码序列(cDNA):如果目标基因的编码序列没有做过改造,确保它是以正确的阅读框存在。常常使用商业合成的cDNA或者通过PCR扩增基因。
-
启动子选择:选择一个强启动子(如CMV启动子、EF1α启动子、U6启动子等)用于驱动目标基因的过表达。
3. 插入目标基因到慢病毒载体
将目标基因插入到慢病毒载体中,通常插入的位置是在多克隆位点(MCS),这些位点设计允许容易插入外源基因。关键步骤如下:
-
PCR扩增目标基因:使用特异性引物扩增目标基因的编码序列,并加上合适的限制性酶位点以便于后续克隆。
-
限制性酶消化和连接:使用限制性酶对慢病毒载体和扩增的目标基因进行消化,然后进行DNA连接,完成目标基因的插入。
-
转化和筛选:将构建好的重组载体转化到大肠杆菌中,通过抗性筛选获得含目标基因的重组质粒。
4. 载体包装和病毒产生
慢病毒载体本身不能自我传播,因此需要包装细胞来生产病毒颗粒。常见的包装系统是使用HEK293T细胞。包装的过程包括:
-
包装细胞的转染:将重组的慢病毒载体和包装所需的辅助质粒(如gag, pol, env基因)一起转染到HEK293T细胞中。辅助质粒提供病毒粒子包装所需的其他功能。
-
病毒收集和纯化:转染后,病毒颗粒将在细胞中产生并分泌到培养基中。一般24-72小时后收集培养上清液并通过超速离心或其他方法纯化病毒颗粒。
5. 转导靶细胞
最终,将纯化的慢病毒颗粒转导到目标细胞中:
-
病毒转导:将慢病毒颗粒加入目标细胞培养中,通常在病毒颗粒浓度较高的情况下进行转导。
-
筛选和验证:转导后,常使用抗生素选择标记基因(例如,GFP或抗性基因)来筛选成功转导的细胞。也可以通过Western blot、RT-qPCR等方法验证目标基因的过表达。
6. 过表达分析
一旦成功转导目标细胞,并且选出阳性克隆,可以通过一系列方法检测目标基因的过表达情况:
-
Western blot:检测目标蛋白的表达水平。
-
RT-qPCR:检测目标基因mRNA的表达水平。
-
流式细胞术或荧光显微镜:如果使用了荧光标签,如GFP,可以用流式细胞仪或荧光显微镜检测目标基因的表达。
注意事项
-
病毒安全性:慢病毒是活病毒,需要在适当的生物安全等级(如BSL-2或BSL-3)环境中操作。
-
载体的选择:不同的慢病毒载体具有不同的特点,选择适合的载体对实验效果有很大影响。
-
靶细胞选择:不同的细胞类型对慢病毒的转导效率有所不同,选择合适的细胞系对成功率很重要。
关于派真
作为一家专注于AAV 技术十余年,深耕基因治疗领域的CRO&CDMO,派真生物可提供从载体设计、构建到 AAV、慢病毒和 mRNA 服务的一站式解决方案。凭借深厚的技术实力、卓越的运营管理和高标准的服务交付,我们为全球客户提供一站式CMC解决方案,包括从早期概念验证、成药性评估到IIT、IND及BLA的各个阶段。
凭借我们独立知识产权的π-alphaTM 293 细胞AAV高产技术平台,我们能将AAV产量提高多至10倍,每批次产量可达1×10¹⁷vg,以满足多样化的商业化和临床项目需求。此外,我们定制化的mRNA和脂质纳米颗粒(LNP)产品及服务覆盖药物和疫苗开发的各个阶段,从研发到符合GMP的生产,提供端到端的一站式解决方案。