近日,派真生物研发团队在预印本平台bioRxiv发表重磅研究成果《Decoupling Efficacy from Toxicity: Engineering Spatial Control in AAV-Mediated Gene Therapy》。该研究通过新型肌肉靶向衣壳AAV.eM + microRNA精准调控 + 局部递送的组合策略,在小鼠淋巴瘤模型中实现了剂量降低10倍而疗效不减。这一突破,为解决AAV基因治疗的”剂量相关的肝毒性”这一行业痛点提供了完整解决方案。

一、行业挑战:当“救命药“遇到“肝脏危机“
基因治疗的临床转化正面临一个致命的 “剂量矛盾”:为了让药物到达全身肌肉或神经,我们必须加大注射剂量;但剂量越高,肝脏受到的毒性冲击就越呈指数级上升。这一矛盾在近期引发了多起惨痛案例:2022年,诺华(Novartis)的SMA基因疗法 Zolgensma 导致两名患者死于急性肝衰竭;2025年11月,FDA紧急叫停了 Sarepta 公司的DMD基因疗法 Elevidys,原因同样是三例致命性肝衰竭。
为什么受伤的总是肝脏呢? 这源于AAV载体天然的 “肝脏陷阱”效应。当我们通过静脉注射AAV时,肝脏就像一块巨大的“海绵”,会吸附血液中90%以上的病毒颗粒。即便我们的治疗目标是肌肉或神经,绝大部分药物却被迫滞留在了肝脏。这种“错误富集”会通过三种机制引爆肝衰竭:
(1)免疫系统的“误伤”:肝细胞吞噬病毒后,会被免疫系统(T细胞)标记为“被感染的敌人”并进行攻击,导致肝细胞大面积坏死。
(2)细胞工厂的“过载”(内质网应激):肝细胞被迫处理数以亿计的病毒颗粒,导致细胞内的蛋白折叠机制“交通瘫痪”,最终引发细胞凋亡。
(3)外源蛋白的“毒性”:本该在肌肉中发挥作用的蛋白,如果在肝脏中过量产生,反而可能变成损伤肝脏的毒素。
二、派真生物的“三维突围“策略
面对这一难题,派真生物研发团队没有选择单一路径,而是构建了多层次、可组合的解决方案矩阵:
策略1:肌肉靶向衣壳AAV.eM——让载体“认路“
派真生物自主研发的AAV.eM衣壳(详见团队前期已发表的工作:新型AAV衣壳实现肌肉精准靶向与高效肝脏脱靶)通过理性设计实现了:
- 肝脏去靶向:肝脏转导效率比AAV9显著降低100倍以上
- 肌肉增强靶向:在骨骼肌和心肌中富集能力提升10倍以上
- 跨物种验证:在食蟹猴和DMD小鼠模型中均表现出优异的治疗窗口
策略2:microRNA精准调控——让表达“分区“
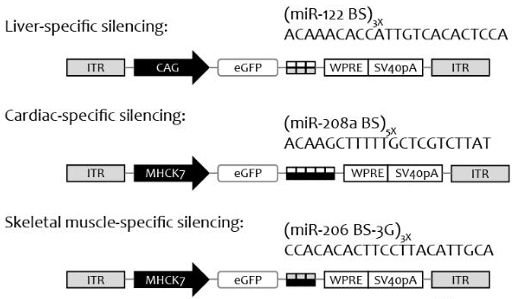
对于AAV.eM这种”泛肌肉”亲和的载体,如何进一步区分心肌与骨骼肌?团队创新性地引入组织特异性microRNA结合位点(图1):
- miR-208a(心脏特异性):在转基因3′UTR插入5个miR-208a结合位点,即可在心肌中沉默表达达90%,而不影响骨骼肌
- miR-206(骨骼肌特异性):反向操作实现心肌保留、骨骼肌沉默
这种策略的临床意义在于:允许同一载体在不同疾病场景下”按需定制”表达模式。
策略3:肌内递送——让给药“局部化“
相比静脉注射,肌内注射具有天然优势:(1)绕过肝脏首过效应:载体主要滞留在注射部位肌肉;(2)耐受预存抗体:即使NAb滴度≥1:160,仍可保持有效转导(静脉注射在1:10即失效);(3)支持再给药:可更换血清型重复注射。
三、核心数据:一个“艰难的平衡“
治疗靶标:αCD19αCD3双特异性T细胞衔接器(BiTE,类似临床药物blinatumomab)
疾病模型:人源化B-NDG小鼠移植Raji淋巴瘤
难点:BiTE需要从肌肉持续分泌到血液,达到足够浓度才能激活T细胞杀伤肿瘤——这对载体的表达效率、蛋白分泌能力、安全性都是极限考验
关键发现1:静脉注射——AAV.eM-MHCK7完胜AAV9-MHCK7组
疗效更优:AAV.eM-MHCK7-αCD19αCD3组显著抑制了肿瘤生长,小鼠生存期大幅延长,而 AAV9-MHCK7-αCD19αCD3 组小鼠因肿瘤失控全部死亡(图2)
表达更高:AAV.eM-MHCK7 组血清中的治疗蛋白浓度是 AAV9-MHCK7 组的 2.5倍(图3)
更安全的分布:qPCR结果显示,AAV.eM 在肝脏中的病毒基因组残留显著低于 AAV9,但在骨骼肌和心脏中的表达量却高达 AAV9 的 10倍(图3)
以上结果表明,仅依赖组织特异性启动子(MHCK7)无法克服AAV9的肝嗜性,而AAV.eM通过衣壳层面的去肝靶向,实现了”高疗效+低毒性”的平衡。

图2 在人源化淋巴瘤模型中,对静脉注射AAV载体双特异性抗体疗法的评估

图3 在人源化淋巴瘤模型中,静脉注射AAV-双特异性抗体的药代动力学、安全性及生物分布特征
关键发现2:microRNA调控——不损失疗效的“精准沉默“
在载体 3’UTR 区域引入了心脏特异性 miR-208a 结合位点后,结果显示心肌转基因mRNA水平下降90%(Western Blot证实蛋白同步下降),而骨骼肌中的表达丝毫不受影响,疗效依然强劲(图4)。
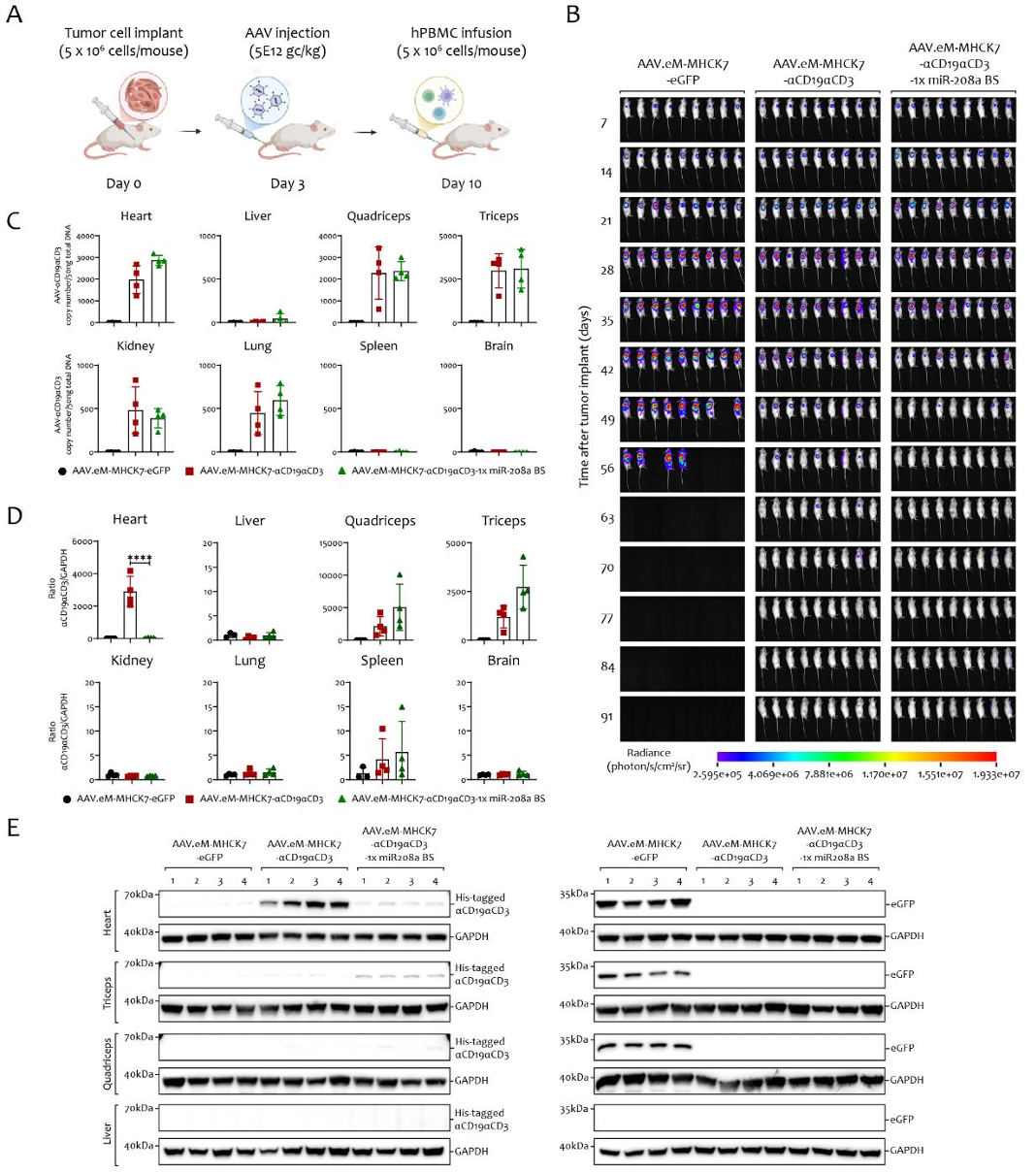
图4利用miR-208a结合位点实现AAV.eM-MHCK7驱动αCD19αCD3表达的心脏沉默及其对治疗疗效与安全性的影响
关键发现3:肌内注射——剂量降低10倍的“降本增效“
在肌肉注射(IM)模式下,高剂量时(5E+12 vg/kg),AAV.eM 和 AAV9 都能清除肿瘤;当剂量降低 10倍时(5E+11 vg/kg),AAV9 组疗效大幅下降,肿瘤复发;而 AAV.eM 组依然能够强效清除肿瘤(图5)。这意味着,使用 AAV.eM 衣壳,仅需传统 AAV9 十分之一的剂量,即可达到同等疗效。

图5 在人源化淋巴瘤模型中,肌肉注射AAV.eM与AAV9载体的疗效比较
四、总结与展望:赋能基因治疗商业化
这项发表于 bioRxiv 的最新研究,不仅证实了派真生物 AAV.eM 衣壳在“去肝强肌”方面的卓越性能,更展示了其巨大的商业转化价值:
- 降低成本:实现 10倍剂量缩减,意味着同样的生产批次可以治疗多达10倍的患者,大幅降低昂贵的AAV生产成本。
- 提升安全性:更低的给药剂量 = 更低的免疫反应风险 + 更轻的肝脏负担,直接解决临床痛点。
- 平台可扩展性:结合 microRNA 调控技术,该平台可精确适配杜氏肌营养不良(DMD)、庞贝病(Pompe)等多种神经肌肉罕见病的复杂治疗需求。
派真生物创始人李华鹏博士表示:”我们这项工作的核心不是单一技术的优化,而是系统性地重构了AAV基因治疗的‘剂量-疗效-毒性‘三角关系。通过AAV.eM衣壳、microRNA调控和局部递送的协同作用,我们首次实现了在显著降低剂量的同时,不仅保持疗效,甚至超越野生型AAV的治疗窗口。这为解决AAV基因治疗的临床安全性瓶颈提供了可落地的工程化路径。”
派真生物(PackGene) 致力于通过持续的技术创新,为全球基因治疗合作伙伴提供更高效、更安全、更具成本优势的 AAV 载体解决方案。
参考资料:
1. Pan Y, et al. Engineering novel AAV capsids by global de-targeting and subsequent muscle-specific tropism in mice and NHPs. bioRxiv 2025. https://www.biorxiv.org/content/10.1101/2025.05.19.654800v1 (AAV.eM衣壳开发)
2. Fan Y, et al. Decoupling Efficacy from Toxicity: Engineering Spatial Control in AAV-Mediated Gene Therapy. bioRxiv 2025. https://www.biorxiv.org/content/10.64898/2025.12.26.696588v1 (本文)
关于派真
作为一家专注于AAV 技术十余年,深耕基因治疗领域的CRO&CDMO,派真生物可提供从载体设计、构建到 AAV、慢病毒和 mRNA 服务的一站式解决方案。凭借深厚的技术实力、卓越的运营管理和高标准的服务交付,我们为全球客户提供一站式CMC解决方案,包括从早期概念验证、成药性评估到IIT、IND及BLA的各个阶段。
凭借我们独立知识产权的π-alphaTM 293 细胞AAV高产技术平台,我们能将AAV产量提高多至10倍,每批次产量可达1×10¹⁷vg,以满足多样化的商业化和临床项目需求。此外,我们定制化的mRNA和脂质纳米颗粒(LNP)产品及服务覆盖药物和疫苗开发的各个阶段,从研发到符合GMP的生产,提供端到端的一站式解决方案。