长期以来,我们对脑卒中(中风)有个误解:以为只要血管一堵,脑细胞(神经元)就会因为“断粮”而默默饿死,是一群无辜的受害者。但真相远比这更残酷。这些濒死的神经元并没有“坐以待毙”,相反,它们在临死前按下了“自毁按钮”!
在缺氧的极度恐慌中,神经元会疯狂地向外发送某种“死亡信号”。这个信号不仅没能求救,反而成了“猪队友”——它主动攻击了保护大脑的防线(血脑屏障),把血管炸开了缺口,引来了更大的洪水猛兽(脑水肿、脑出血)。
那么,这个由神经元亲自释放、导致大脑“自我毁灭”的神秘信号,究竟是谁?
近日,中国科学家不仅成功“揪”出了潜伏在神经元内的“内鬼”——Dickkopf相关蛋白2(DKK2),还找到了封锁它的方法。这项重磅发现由中国科学院深圳先进技术研究院马寅仲团队与南方医科大学附属东莞医院石铸团队、南方医科大学南方医院黄凯滨团队、吉林大学第一医院畅君雷团队合作完成,研究成果以题为“Dickkopf-related protein 2 impairs neurovascular Wnt signalling and worsens stroke outcome”的论文发表在心血管领域国际权威期刊《European Heart Journal》(IF=39.3) 上。该研究首次系统性揭示了DKK2在缺血性脑卒中中的关键致病作用,并证实DKK2通过抑制神经血管单元中的经典Wnt信号通路(Wnt/β-catenin信号通路),加剧血脑屏障破坏与神经元凋亡,而靶向抑制DKK2则能有效改善卒中预后,为其作为新型治疗靶点与预后生物标志物提供了坚实证据。

一、为什么是 DKK2?答案来自“家族筛查”,而不是预设结论
Wnt/β-catenin 信号通路是维持脑血管稳态和 BBB 完整性的核心通路,而其拮抗因子 Dickkopf(DKK)家族(DKK1–4)在多种病理状态下均可能被激活。因此,该研究并未一开始就锁定某一个候选分子,而是从一个更稳妥的起点出发:系统性比较卒中后 DKK 家族成员的动态变化特征。
在小鼠 tMCAO 模型中,研究发现:
- DKK2 在缺血后 6 h 即开始升高,24 h 达峰,并持续至 48 h;
- 相比之下,DKK1 上调更晚、持续时间更短;
- 在血清中,仅 DKK2 水平与梗死体积和神经功能缺损评分呈显著相关。
空间定位进一步显示,DKK2 主要表达于缺血周边区(peri-ischaemic area)的 NeuN⁺ 神经元(图1),而 DKK1 则更多定位于 GFAP⁺ 星形胶质细胞。这一清晰的细胞来源差异,为后续聚焦 DKK2 提供了坚实依据。
换言之,DKK2 并不是“被选中”的分子,而是在家族比较中“自己走到了台前”。
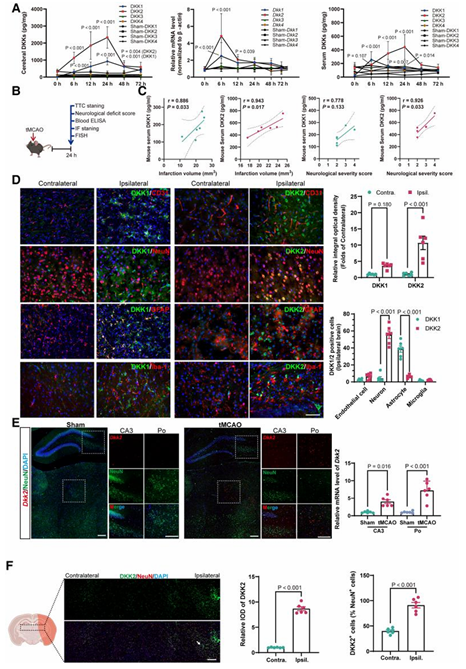
图1 卒中后 DKK 家族成员的动态变化及 DKK2 的突出特征
二、从相关性到因果性:神经元 DKK2 本身是否足以驱动损伤?
表达升高只能说明“发生了什么”,却无法回答真正关键的问题:神经元 DKK2 的变化,是否本身就足以导致 BBB 失稳和组织损伤扩展?
围绕这一问题,研究者构建了一个明确的因果验证框架:在体内、特异性地双向操控神经元 DKK2 水平,并观察系统性结局的变化。
当神经元内 DKK2 被上调时,小鼠卒中模型中出现了一系列高度一致的病理改变:BBB 通透性显著增加(IgG 渗漏升高),神经元凋亡加重,梗死体积扩大,神经功能评分明显恶化,48 h 生存率由 78.9% 降至 55.0%。
相反,当内源性神经元 DKK2 被敲低后,上述变化均得到显著缓解,BBB 完整性恢复,神经元存活增加,卒中结局明显改善。
更重要的是,研究者并未依赖单一操控策略来推断因果关系,而是通过多层次、不同空间尺度的干预设计 来反复验证 DKK2 的作用来源与靶向位置。
在体内实验中,研究者不仅在卒中模型背景下调控神经元 DKK2 水平,还在未造模条件下 直接于脑内或外周递送 DKK2过表达腺病毒,以区分“卒中继发效应”与“DKK2 本身的直接作用”。结果显示,即便在缺乏大面积缺血损伤的情况下,单纯提高神经元 DKK2 水平也足以诱发血脑屏障通透性增加和内皮功能异常,而外周递送并不会产生同等效应(图2)。
这些来自不同给药路径与模型条件下的一致结果,共同指向一个结论:DKK2 的关键作用并非源于外周循环或继发炎症,而是由脑内神经元释放、在局部神经血管单元中发挥效应。正是在这一多重验证框架下,DKK2 才被从一个与卒中进展“相关”的分子,明确提升为驱动血脑屏障失稳和损伤扩展的因果节点。
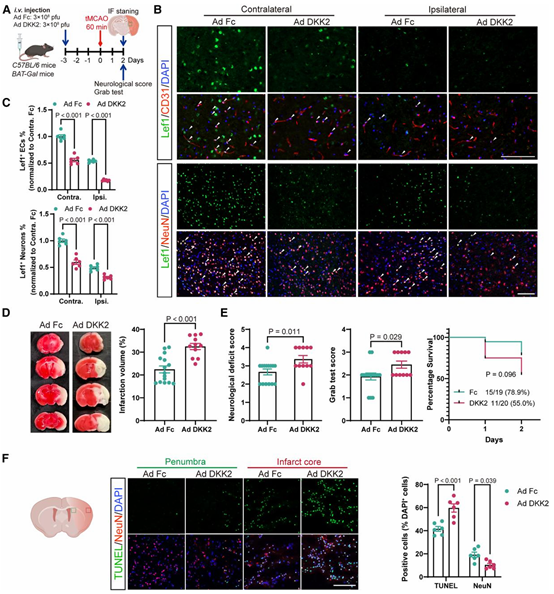
图2 神经元 DKK2 双向操控对 BBB 稳定性与卒中结局的因果影响
三、神经元如何影响血管?——一条被精确点名的信号通路
机制层面的核心问题是:神经元内发生的变化,如何被“翻译”为血管与屏障层面的结构破坏?
通过体外缺氧/复氧(OGD/R)模型,研究者发现,应激状态下的神经元会释放某种分泌因子,使脑内皮细胞中的Wnt/β-catenin信号显著受抑。关键实验在于,当在该体系中加入DKK2中和抗体后,这一抑制效应被完全逆转。
这一设计逻辑非常清晰:
神经元应激 → 条件培养基 → 内皮Wnt信号下降 → 抗体特异性阻断。
随后的一系列实验表明,Wnt信号受抑将直接导致紧密连接蛋白(如Claudin-5)下降,并伴随跨胞转运增强(Caveolin-1上调、Mfsd2a下调),最终造成BBB “门户洞开”(图3)。
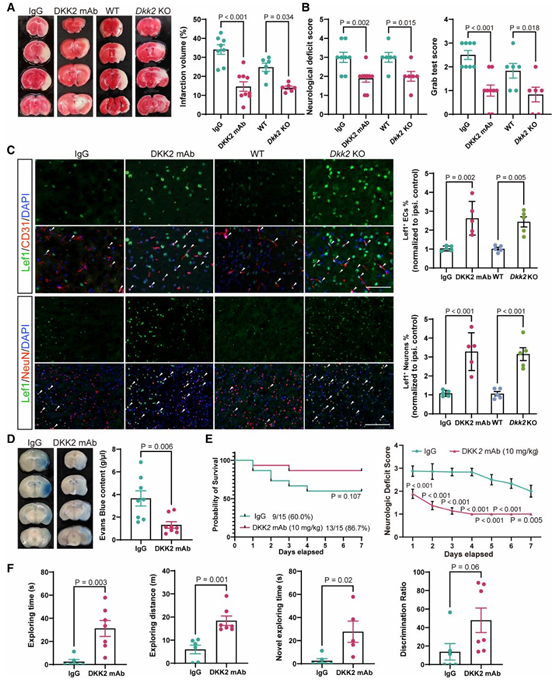
图3 神经元–内皮互作模型中DKK2介导的BBB功能破坏
四、机制如何闭合?RXRα 把“缺氧应激”转化为 DKK2 上调
缺血/缺氧并非随机刺激。研究进一步追问:DKK2的上调是否受特定转录程序调控?
通过启动子分析与 ChIP-seq 数据库交叉验证,研究锁定了 RXRα 这一关键转录因子。在缺氧条件下,神经元中 RXRα 与 DKK2 表达呈现高度一致的时间动态。
药理学和分子生物学证据进一步证实:
RXRα 激动剂可增强 Dkk2 转录,而 RXRα 抑制剂(Ro 41-5253)或 siRNA 敲低 RXRα,则可显著阻断缺氧诱导的 DKK2 上调。体内抑制 RXRα 同样能够降低神经元 DKK2 水平,改善 BBB 损伤并缩小梗死体积(图4)。
至此,一条完整且自洽的机制链条得以闭合:
缺血/缺氧 → RXRα 转录重塑 → 神经元 DKK2 分泌 → Wnt 信号受抑 → BBB 失稳与损伤扩展
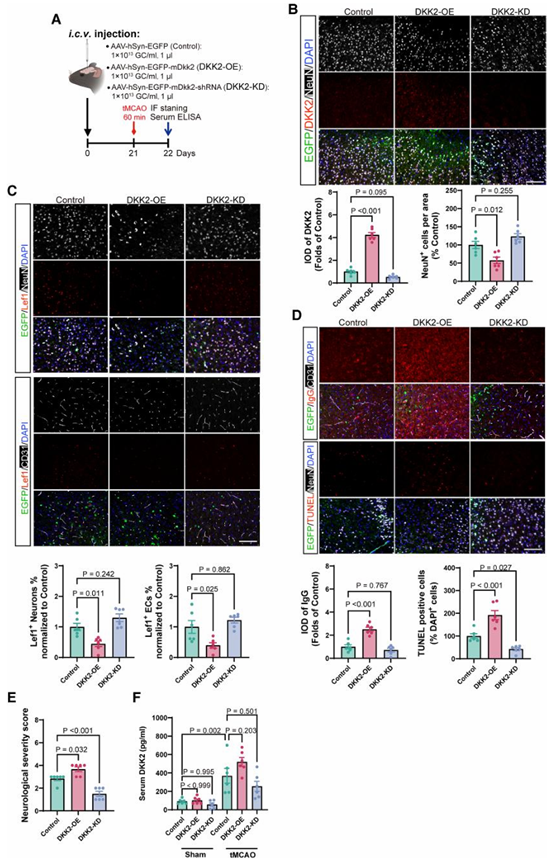
图4 RXRα–DKK2 轴在卒中后的机制闭环
五、回到临床:DKK2 在真实再灌注卒中中的意义
在前瞻性纳入的 34 例接受血管内治疗(endovascular thrombectomy, EVT)的缺血性卒中患者中,研究系统分析了血清 DKK2 的动态变化特征。结果显示,72 h 时点的血清 DKK2 水平与梗死体积呈显著正相关(r = 0.380, P = 0.004),且在发生出血性转化的患者中明显升高(图5)。
值得注意的是,这一相关性并未出现在 24 h 影像学评估时点。作者对此提出了具有生物学合理性的解释:24 h 的影像学指标主要反映早期缺血水肿和结构性损伤,而 72 h 的 DKK2 水平更可能对应不可逆神经元损伤的累积规模及其对神经血管单元的继发放大效应。这也使 DKK2 成为一个“滞后但稳定”的损伤关联信号。
更重要的是,这一发现为理解 DKK2 与既往临床研究中 DKK1 表现差异 提供了关键线索。已有多项研究报道,在永久性缺血卒中或未再通患者中,DKK1 往往在急性期升高,随后逐渐下降。然而,在本研究所纳入的 EVT 成功再灌注患者队列中,DKK1 水平在早期即呈下降趋势,并未表现出稳定的损伤相关性。
这一差异并非矛盾,而是反映了病理背景的本质不同:EVT 显著改变了缺血脑组织的结局轨迹,再灌注成功后,部分可逆损伤得以恢复,急性应激相关的 DKK1 信号随之减弱;相比之下,DKK2 更可能来源于缺血损伤进程中的神经元,尤其是位于缺血半暗带、尚未完全坏死但已进入应激状态的神经元群体。其表达和释放具有相对延后的时间特征,使其更容易在再灌注后的中后期被检测到,并与最终组织结局建立稳定关联。
这一结果与既往研究中以星形胶质细胞为主要来源的 DKK1 形成鲜明对照:在再灌注背景下,DKK1 更像是反映急性胶质应激的短暂信号,而 DKK2 则由缺血半暗带内的神经元释放,标记的是神经元损伤进程及其对神经血管单元的持续影响。
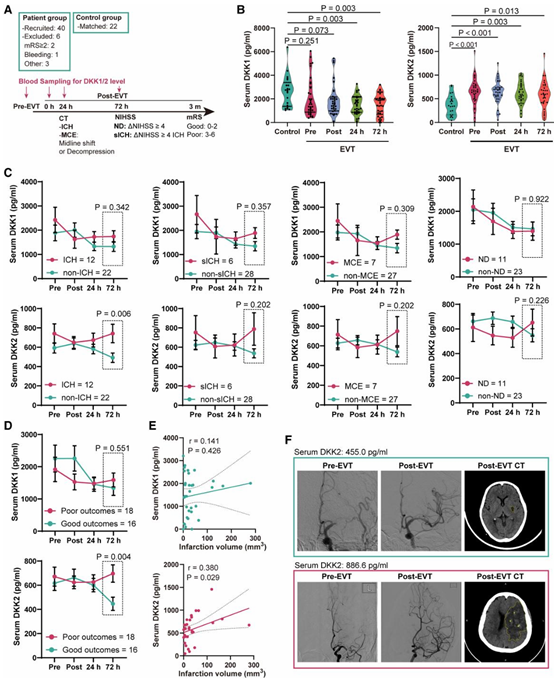
图5 再灌注性缺血性卒中患者中血清 DKK2 的动态变化
六、这篇研究告诉了我们什么?
如果暂时放下具体分子名称,这项工作真正展示的是一种值得借鉴的研究范式:从候选家族的系统筛查出发,通过体内双向操控建立因果关系,再将“缺氧应激”这一宏观概念逐步压缩为可验证的转录—分泌—结构闭环,最终回到真实的临床再灌注场景中进行检验。
对于关注神经血管单元、卒中机制或转化研究的研究者而言,这或许比记住“DKK2”本身更重要。
派真助力——AAV包装
文章通讯作者简介:
马寅仲,中国科学院深圳先进技术研究院副研究员、硕士生导师。长期从事脑血管疾病的创新药物研发与转化医学研究,围绕脑卒中后急性损伤向慢性进行性脑损害转化的内在机制,逐步形成了以「病理机制解析 — 关键靶点确立 — 干预策略验证」为核心的系统性研究框架。以第一或通讯作者在 European Heart Journal、Pharmacological Research 等国际高水平期刊发表论文二十余篇,相关成果系统涵盖卒中动物模型构建、神经血管损伤机制解析、内皮脂质代谢与转运异常,以及基于生物材料的创新溶栓策略研发。主持多项国家及省市科研项目,拥有多项发明专利。近年来在脑卒中发病机制及干预靶点研究方面持续取得具有原创性和转化潜力的进展。
参考资料
Zhu Shi, Jinrui Li, Ziying Feng, Cheng Fang, Yueqing Wang, Linhui Qiu, Jingjing Liu, Feng Wang, Zhen-Ni Guo, Yi Yang, Kaibin Huang, Junlei Chang, Yinzhong Ma, Dickkopf-related protein 2 impairs neurovascular Wnt signalling and worsens stroke outcome, European Heart Journal, 2025;, ehaf959, https://doi.org/10.1093/eurheartj/ehaf959
关于派真
作为一家专注于AAV 技术十余年,深耕基因治疗领域的CRO&CDMO,派真生物可提供从载体设计、构建到 AAV、慢病毒和 mRNA 服务的一站式解决方案。凭借深厚的技术实力、卓越的运营管理和高标准的服务交付,我们为全球客户提供一站式CMC解决方案,包括从早期概念验证、成药性评估到IIT、IND及BLA的各个阶段。
凭借我们独立知识产权的π-alphaTM 293 细胞AAV高产技术平台,我们能将AAV产量提高多至10倍,每批次产量可达1×10¹⁷vg,以满足多样化的商业化和临床项目需求。此外,我们定制化的mRNA和脂质纳米颗粒(LNP)产品及服务覆盖药物和疫苗开发的各个阶段,从研发到符合GMP的生产,提供端到端的一站式解决方案。