
中枢神经系统被称为我们身体的“控制中心”,它不仅功能关键,而且能量消耗极大,但由于本身较为脆弱,且无法储存能量物质,因此需要持续不断的血液供应。大约四分之一的血液流量都用于供养大脑。然而,血液中常含有可能危害大脑的有害物质。为了保护大脑免受这些潜在的损害,血脑屏障(blood-brain barrier, BBB)成为抵御有害物质入侵的第一道防线。
血脑屏障位于血液与脑组织之间,由连续的脑毛细血管内皮细胞、细胞间的紧密连接、基底膜、周细胞和星形胶质细胞共同构成。这道屏障通过选择性地允许中枢神经系统所需的成分进入,同时阻隔有害物质,从而在维持大脑内部环境稳定方面起到了关键作用。然而,血脑屏障的存在也显著限制了治疗中枢神经系统疾病的药物传递,因为绝大多数药物和治疗分子无法穿过这一屏障。因此,研发能有效穿越血脑屏障的药物递送策略已成为亟待解决的难题。
近年来,基因治疗作为一种新兴疗法,为许多遗传性脑部疾病带来了新的希望。腺相关病毒(AAV)因其低免疫反应性和持久稳定的基因表达能力而备受关注,成为基因治疗的重要载体。然而,传统的AAV血清型在穿越血脑屏障方面存在一定的局限性。为了克服这一问题,科学家们通过工程化改造和筛选,成功开发出一系列能有效跨越血脑屏障的AAV血清型,以便更高效地治疗中枢神经系统疾病。
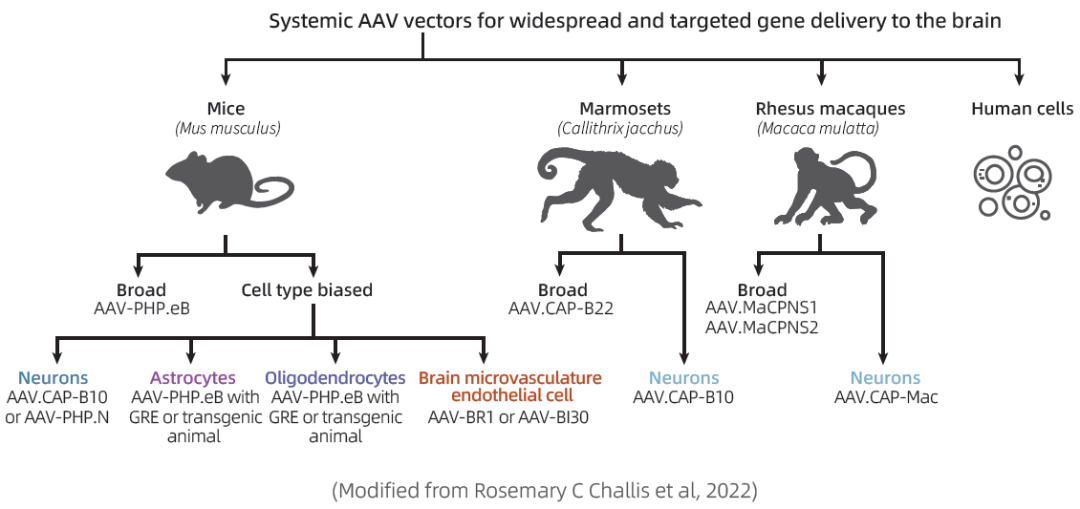
AAV9 和 AAV-rh10 都是目前已知可以穿过BBB的天然AAV血清型,在小鼠模型和非人灵长类动物中均显示出有效的基因传递能力,然而,它们的跨BBB的穿透性较低,需要高剂量的AAV才能到达靶细胞,且大量的载体会被其他组织吸收,导致不同程度的不良反应。
AAV-PHP.B/AAV-PHP.eB、AAV-PHP.S
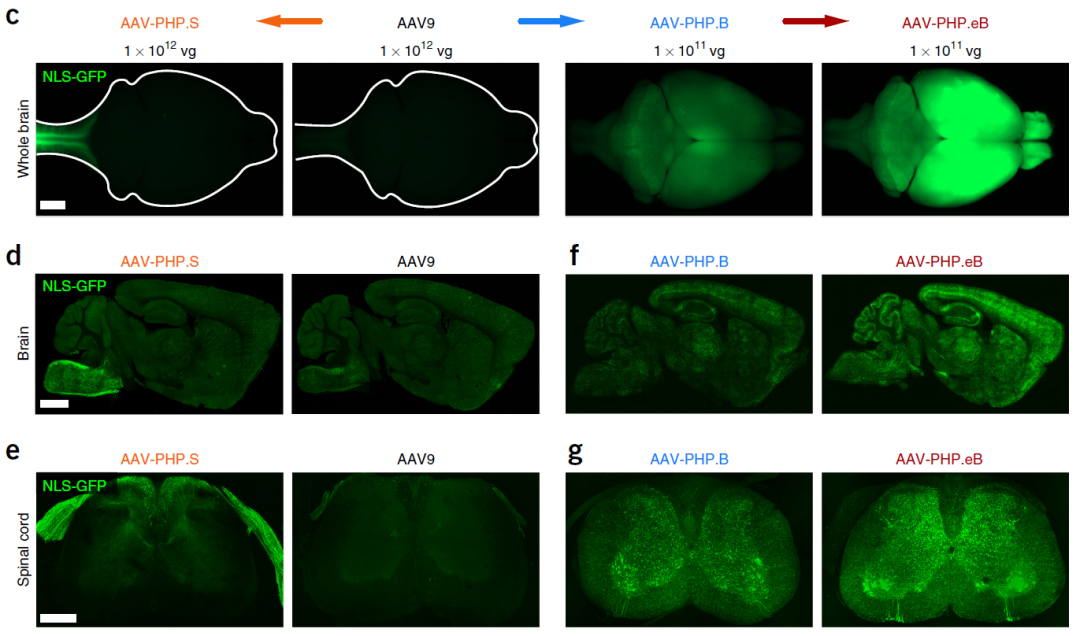
加州理工学院的Viviana Gradinaru团队与合作者基于AAV9改造,开发出了PHP.S、PHP.B和PHP.eB,其中,AAV-PHP.B和AAV-PHP.eB可以通过静脉注射穿越血脑屏障感染全脑,且PHP.eB表现出更高的BBB穿透效率,因此也是目前优选的应用于全脑感染的血清型。然而,该血清型的问题在于在肝脏有明显富集,因此在实际应用中存在肝毒性的风险,可用特异启动子实现大脑特异表达,同时,PHP.eB在其他品系小鼠及非人灵长类上测试的结果暂不明确。
AAV.CAP-B10& AAV.CAP-B22
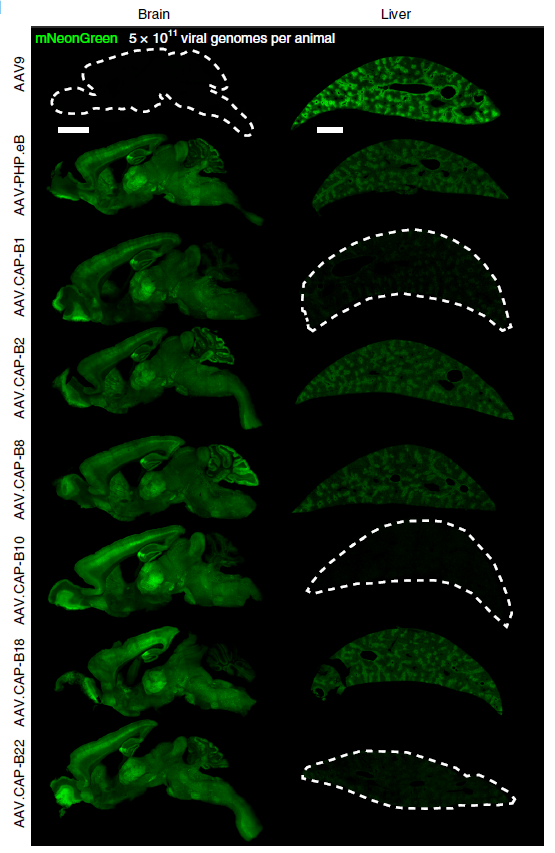
AAV.CAP-B10和AAV.CAP-B22是Viviana Gradinaru 团队基于M-CREATE方法在PHP.eB的基础上进行筛选开发的新型AAV变体。AAV.CAP-B10在C57Bl/6J小鼠中能够实现静脉注射高效穿越血脑屏障在全脑表达,且靶向神经元(在感染星形胶质细胞和少突胶质细胞的能力上都弱于PHP.eB),同时避免了在肝脏富集,从而减少了可能引起的肝毒性等副作用。类似的结果在狨猴上也得到了验证。
AAV.CAP-B22亦可以高效跨BBB,在狨猴大脑中可以高效穿越血脑屏障广泛感染大脑细胞,尤其对于星胶细胞的感染,但在肝脏中也有部分富集,没有显示出像AAV.CAP-B10那样的肝脏低靶向性。
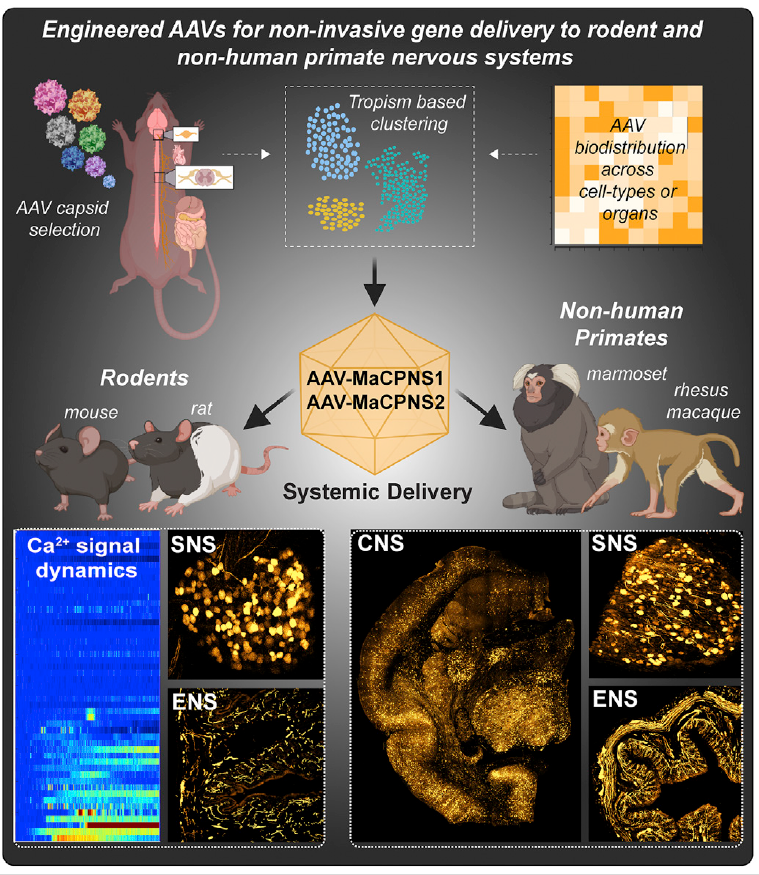
AAV-MaCPNS1&AAV-MaCPNS2
2022年,同样是Viviana Gradinaru 团队基于AAV9筛选开发出AAV-MaCPNS1和AAV-MaCPNS2,提高了在啮齿类动物和非人灵长类动物的神经系统中的基因递送效率。在成年大小鼠中,MaCPNS1/2能够通过系统注射高效转导外周神经系统(PNS),且具有一定的肝脏低靶向性,此外MaCPNS2对于肠神经系统(ENS)的转导也增强。在成年狨猴和幼年恒河猴中,MaCPNS1/2可以穿过血脑屏障,高效感染CNS和PNS,且表现出一定的细胞选择性,MaCPNS1更倾向于神经元转导;MaCPNS2则更倾向于神经元和星形胶质细胞。
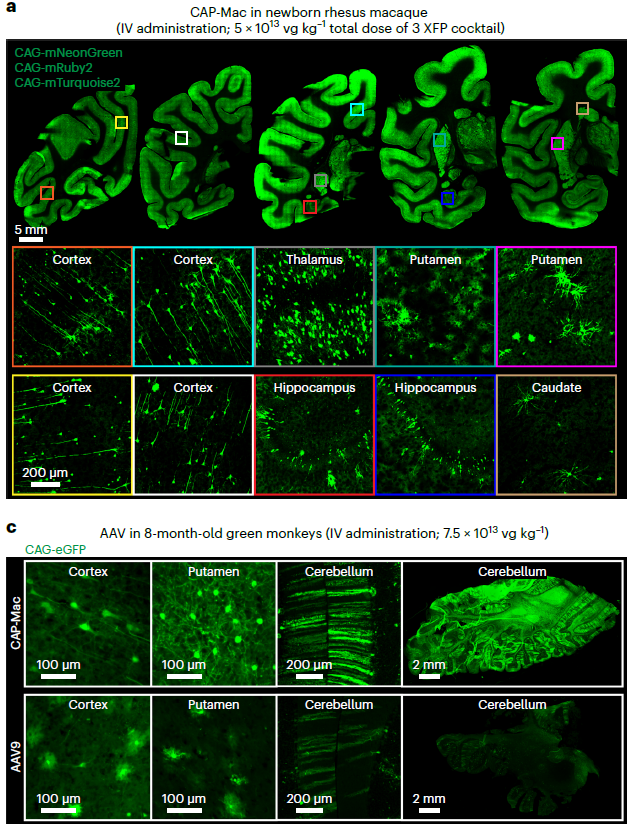
AAV.CAP-Mac
2023年,Viviana Gradinaru 团队在成年狨猴中筛选开发出AAV.CAP-Mac,提高了在多种非人灵长类动物大脑中的递送效率。通过静脉注射,CAP-Mac在新生旧世界灵长类动物(Old World primates, OWPs,如恒河猴,猕猴,绿猴)中倾向于大脑神经元转导,在成年恒河猴中表现出广泛感染特性,在成年狨猴中倾向于大脑内皮细胞。
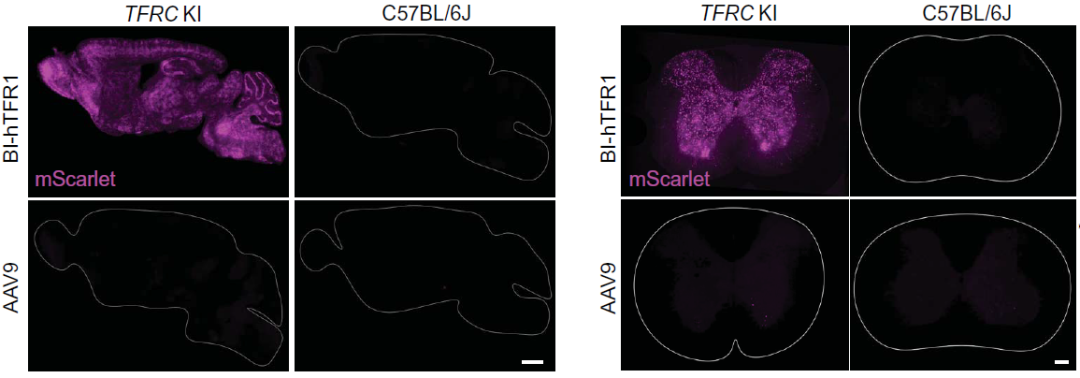
BI-hTFR1
2024年,博德研究所Bejamine Deverman团队设计开发了一种新AAV衣壳,BI-hTFR1,通过与人血脑屏障中高表达的人转铁蛋白受体(hTfR1)结合,能够有效穿越血脑屏障,在表达人转铁蛋白受体的人源化小鼠中,BI-hTFR1在大脑的表达比AAV9高40-50倍。
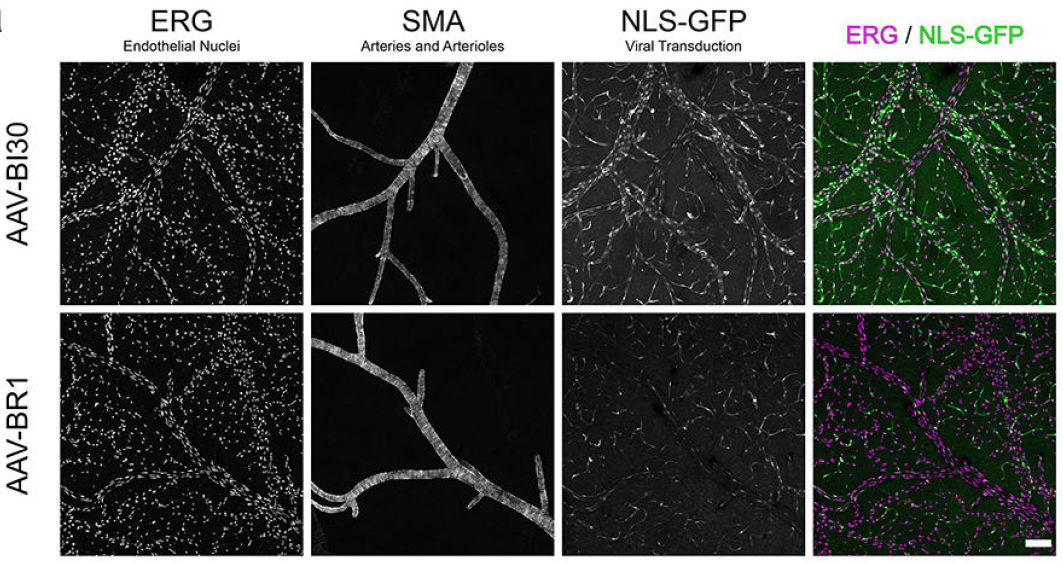
AAV-BR1和 AAV-BI30
2016年,德国奥格斯堡大学附属医院Martin Trepel团队基于AAV2筛选开发的AAV-BR1,可以通过静脉注射高效特异的转导脑微血管内皮细胞。
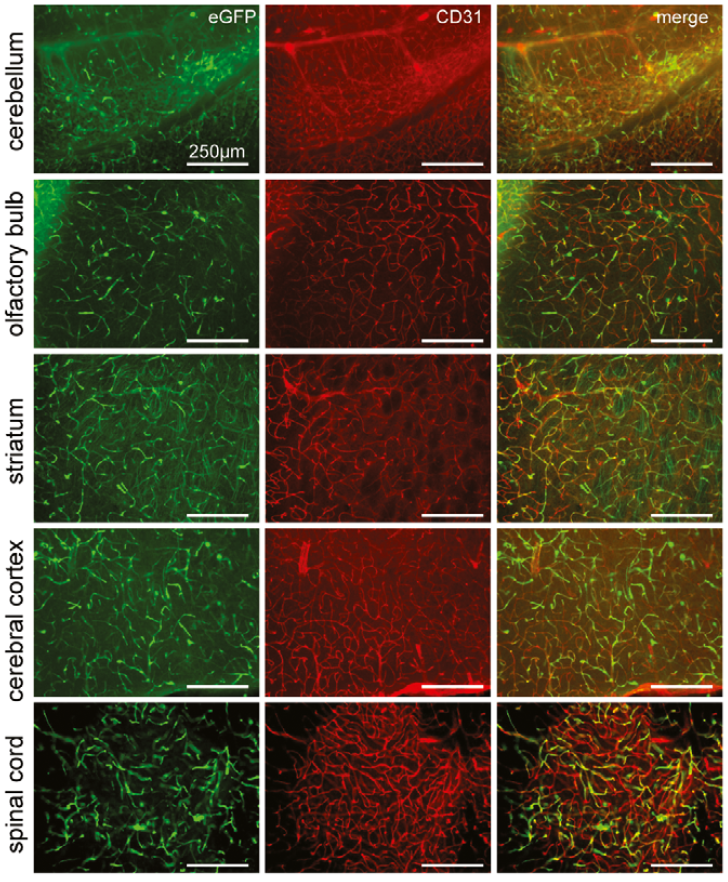
2022年,Benjamin E. Deverman团队与合作者基于AAV9筛选出AAV-BI30,可以通过静脉注射高效特异转导小鼠、大鼠CNS的内皮细胞,包括大脑、视网膜和脊髓中的大多数动脉、毛细血管和静脉内皮细胞。
除了上述AAV新血清型之外,越来越多的新型AAV载体在跨血脑屏障方面的研究也取得了显著进展。例如,哈佛大学医学院的Bei Fengfeng团队筛选并开发出AAV.CPP.16,通过结合细胞穿膜肽(CPP)来提高穿越BBB的效率,在多种小鼠品系及食蟹猴模型中展现出高效的血脑屏障穿越能力,显著提升了对脑部的感染效率。Viviana Gradinaru团队开发的AAV-X1则能够通过系统注射方式高效且特异性地转导啮齿类动物的大脑内皮细胞。此外,AAV-M6和AAV-M8等新型跨血脑屏障载体也相继被开发出来。这些新型AAV血清型不仅提高了基因递送的效率和精准度,也为基因治疗在各种脑部疾病的应用带来了新的可能性。
关于派真
作为一家专注于AAV 技术十余年,深耕基因治疗领域的CRO&CDMO,派真生物可提供从载体设计、构建到 AAV、慢病毒和 mRNA 服务的一站式解决方案。凭借深厚的技术实力、卓越的运营管理和高标准的服务交付,我们为全球客户提供一站式CMC解决方案,包括从早期概念验证、成药性评估到IIT、IND及BLA的各个阶段。
凭借我们独立知识产权的π-alphaTM 293 细胞AAV高产技术平台,我们能将AAV产量提高多至10倍,每批次产量可达1×10¹⁷vg,以满足多样化的商业化和临床项目需求。此外,我们定制化的mRNA和脂质纳米颗粒(LNP)产品及服务覆盖药物和疫苗开发的各个阶段,从研发到符合GMP的生产,提供端到端的一站式解决方案。

