
近日,4D Molecular Therapeutics公司公布了2期临床试验PRISM的积极中期数据,该试验评估了玻璃体内注射的基因疗法4D-150治疗湿性年龄相关性黄斑变性(AMD)患者的效果,这些患者具有严重的疾病活动度和高治疗负担。积极的中期研究结果有力地证明了4D-150作为一种安全、方便、持久、变革性,目标为长期保护视力的玻璃体内疗法在治疗湿性AMD患者方面的潜力。

PRISM研究的剂量扩展队列是一项随机对照2期临床试验,旨在评估4D-150在既往接受过治疗、疾病活动度严重(通过光学相干断层扫描[OCT]测量的中央亚视野厚度[CST]≥325 µm,且存在视网膜下或视网膜内积液)、治疗负担较重(在过去12个月内接受过≥6次抗血管内皮生长因子[VEGF]注射治疗)的湿性AMD患者中的应用情况。
截至2024年1月19日的数据显示,在长达48周的随访评估中,4D-150的安全性和耐受性良好,未观察到明显的炎症,高剂量组患者也没有出现≥1+级炎症,所有患者都成功地停用了局部皮质类固醇。
高剂量4D-150可将抗VEGF注射治疗的年化注射率降低89%,84%的患者只注射了0次或1次,63%的患者在接受治疗后的24周内无需补充注射阿柏西普。低剂量4D-150可将抗VEGF注射治疗的年化注射率降低85%,90%的患者只注射了0次或1次,50%的患者在接受治疗后的24周内无需补充注射阿柏西普。与接受阿柏西普治疗相比,接受4D-150治疗患者的视力和中央亚视野厚度均保持稳定。
此次研究还更新了1期研究长期随访的积极结果。截至2024年1月19日的数据,所有15名接受4D-150治疗的患者(随访长达104周)均保持了安全结果,没有出现新的炎症状况,类固醇的使用状态也没有变化。
此前报告的结果显示,3名接受高剂量4D-150治疗的患者在随访52周时仍无需补充注射抗VEGF疗法,所有3名患者在随访80-104周(最长2年)后仍无需补充注射抗VEGF疗法。
这些积极的中期结果有助于快速推进关键性开发工作,4D Molecular Therapeutics 公司计划于2025年第一季度启动针对4D-150的3期临床试验。
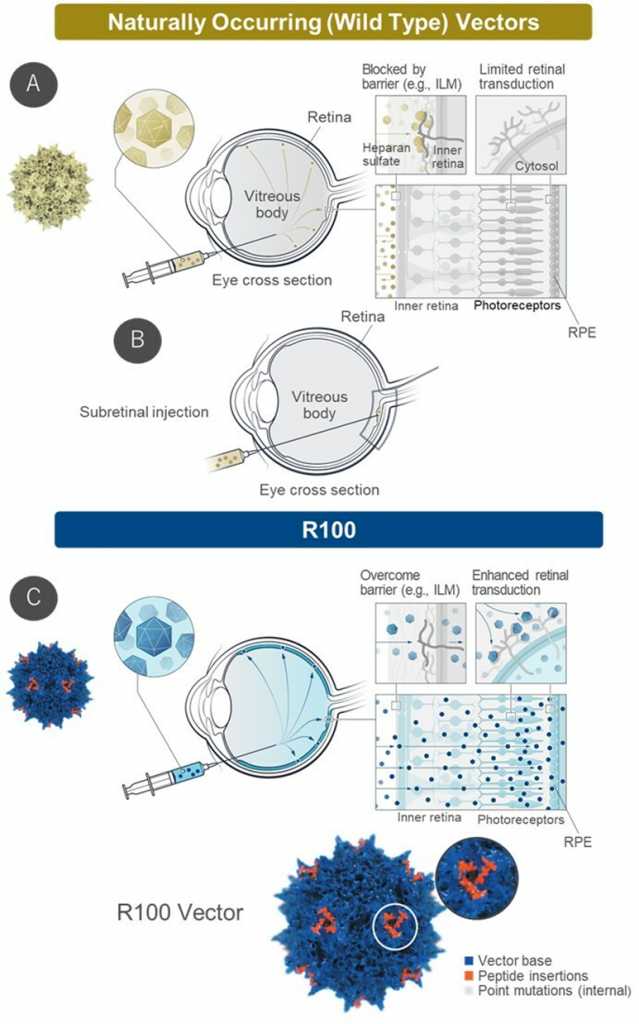
▲R100的结构和靶点载体图[3]
4D-150由表达阿柏西普和抗VEGF-C的RNAi有效载荷以及能够在玻璃体内进行递送的专有载体R100组成,能够抑制4种血管生成因子:VEGFA、B、C和PlGF。专为穿透内界膜屏障定制和优化的R100能够通过常规的玻璃体内注射有效递送至整个视网膜,从而在视网膜细胞内实现强大的转基因表达。新闻稿指出,4D-150是首款旨在抑制驱动血管生成的所有四种VEGF相关分子的视网膜基因疗法。
参考资料:
1. https://mp.weixin.qq.com/s/9A5TRT6sn9h_EDYbxsYG4w
2. https://www.globenewswire.com/news-release/2024/02/03/2823166/0/en/4DMT-Presents-Positive-Interim-Data-from-Randomized-Phase-2-PRISM-Clinical-Trial-of-Intravitreal-4D-150-Demonstrating-Favorable-Tolerability-Clinical-Activity-in-Wet-AMD.html
3. https://www.prnewswire.com/news-releases/astellas-and-4d-molecular-therapeutics-4dmt-enter-into-license-agreement-to-use-4dmts-proprietary-intravitreal-r100-vector-for-rare-ophthalmic-targets-301872750.html
关于派真
作为一家专注于AAV 技术十余年,深耕基因治疗领域的CRO&CDMO,派真生物可提供从载体设计、构建到 AAV、慢病毒和 mRNA 服务的一站式解决方案。凭借深厚的技术实力、卓越的运营管理和高标准的服务交付,我们为全球客户提供一站式CMC解决方案,包括从早期概念验证、成药性评估到IIT、IND及BLA的各个阶段。
凭借我们独立知识产权的π-alphaTM 293 细胞AAV高产技术平台,我们能将AAV产量提高多至10倍,每批次产量可达1×10¹⁷vg,以满足多样化的商业化和临床项目需求。此外,我们定制化的mRNA和脂质纳米颗粒(LNP)产品及服务覆盖药物和疫苗开发的各个阶段,从研发到符合GMP的生产,提供端到端的一站式解决方案。

