研究人员采用了靶向少突胶质细胞祖细胞(OPC)的脂质纳米颗粒(LNP)递送表达Olig2的修饰后mRNA(C-Olig2)实现体内Olig2蛋白的过表达,促进缺血性脑卒中治疗的髓鞘再生。在缺血性脑卒中小鼠模型中,观察到给药后血脑屏障(BBB)完整性的改善以及髓鞘再生,挽救了脑卒中导致的学习认知和运动缺陷。

LNP设计与体外转染
为了促进PDGFRα OPCs的细胞特异性递送和mRNA表达,研究人员使用抗 CD140a单克隆抗体(mAb)包被包封mRNA的LNP。透射电子显微镜(TEM)图像显示,添加靶向mAb不影响Olig2或Luc-LNP(C-Olig2. C-Luc)的超微结构(图1C-D)。
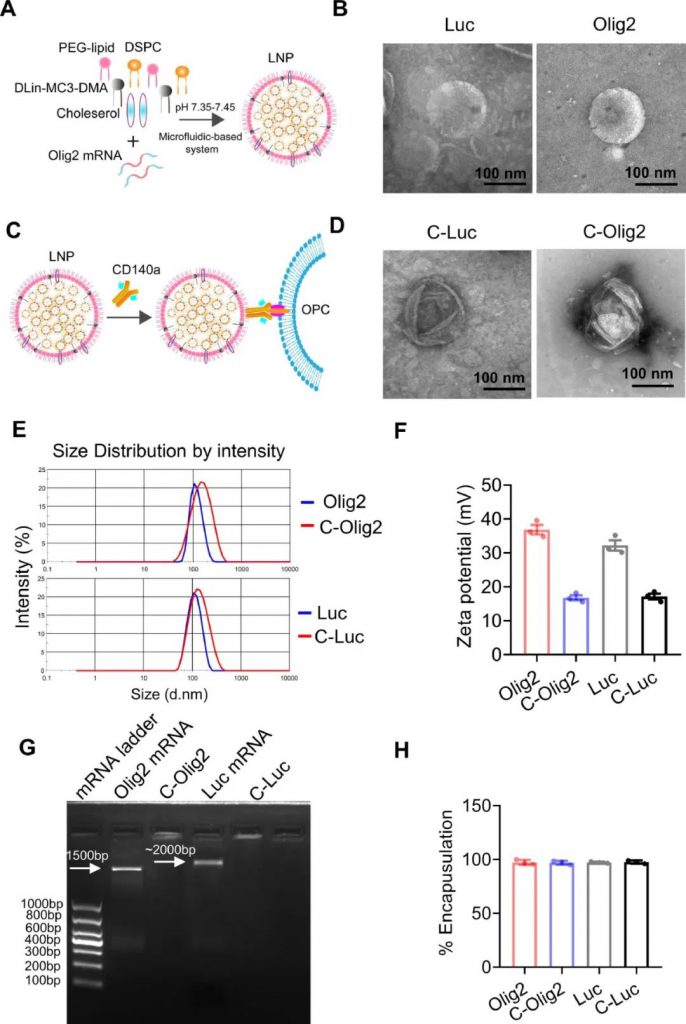
图1. mRNA-LNP的构建和表征
体外小鼠OPC转染实验显示,浓度为6 μg/mL时,该类LNP介导的荧光素酰胺(FAM)标记Olig2 mRNA的转染效率达到了66.58%,表明小鼠OPC对C-Olig2有大量摄取。此外,使用C-Luc处理时,荧光素酶在小鼠OPC中的表达时间持续了48小时。这些数据证实CD140a抗体修饰的LNP能够有效将mRNA转染到小鼠OPC中并实现翻译。
在此基础上,研究人员使用Annexin V/PI双染色和CCK-8测定法分析了C-Luc和C-Olig2转染后小鼠OPC的细胞凋亡率和细胞活力,以分析其安全性。初步结果显示,C-Luc和C-Olig2转染对细胞凋亡或细胞增殖活力没有显著影响(图2A,B)。
研究人员发现,OPC中Olig2的过表达增强了细胞迁移。通过测量OPC在24小时内从附着的少突胶质细胞团辐射出去的距离发现,用C-Olig2处理后的OPC迁移的平均距离明显大于用C-Luc或Mock处理的OPC(图2D,E)。此外,与对照组相比,C-Olig2 转染导致OPC显著分化和成熟(图2F,G)。总体而言,这些结果表明,Olig2 mRNA在体外显著增强了OPC的迁移和分化。
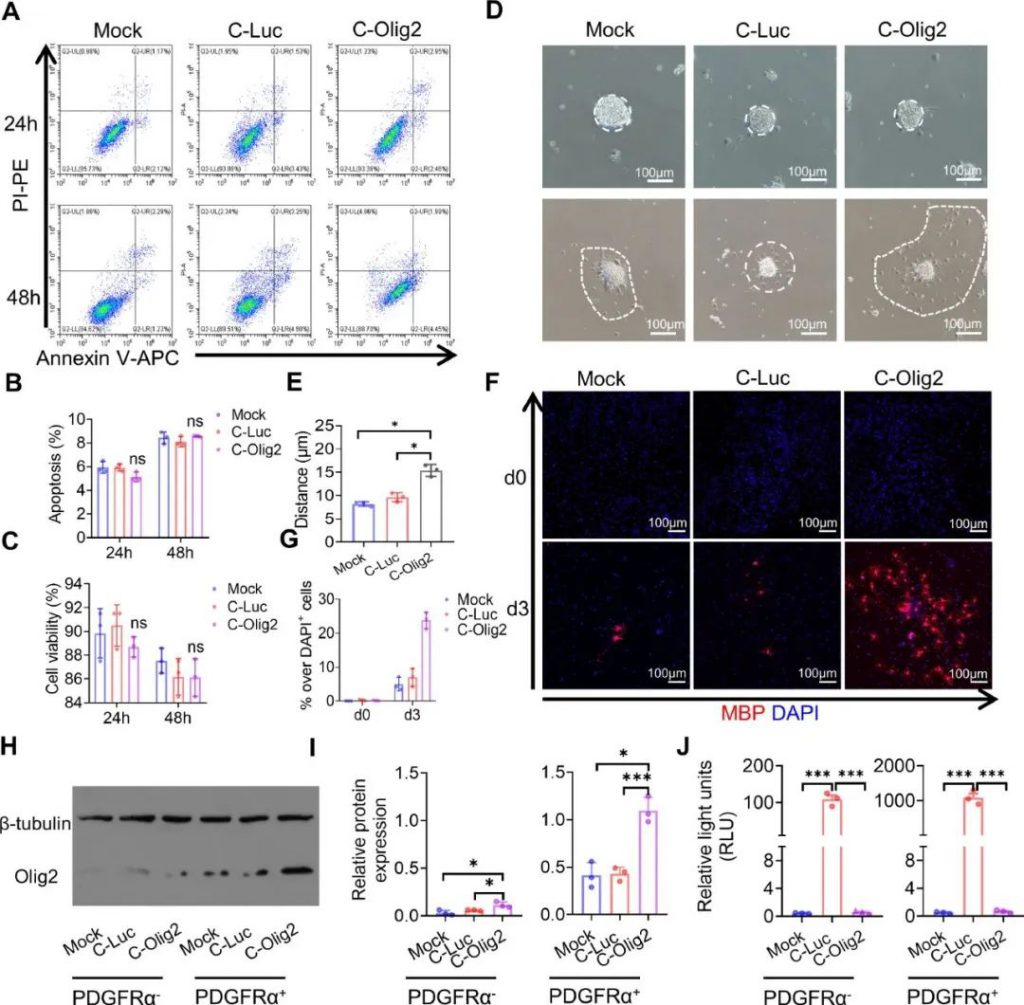
图2.体外OPC中表达Olig2的安全性和有效性
脑内注射改善缺血性损伤,恢复血脑屏障完整性
研究选用模拟缺血性脑卒中的tMCAO小鼠模型,并在tMCAO处理后6小时通过脑内注射给予C-Olig2(0.05 mg/kg)和IgG对照Olig2 mRNA(I-Olig2.0.05 mg/kg),并采用Menzies评分来评估神经功能恢复(图3A,B)。
与Mock治疗的小鼠相比,C-Olig2治疗的小鼠神经功能缺损在卒中后第7天至第21天获得显著改善。此外,在注射后3周,用C-Olig2治疗的小鼠的神经功能缺损低于用I-Olig2治疗的小鼠,表明用特定Olig2 mRNA治疗的小鼠在缺血损伤后功能恢复更好,并表现出更好的神经元保护作用。C-Olig2可以迅速改善神经功能并保护神经元免于死亡,而I-Olig2治疗在缺血性中风小鼠中显示出有限的疗效(图3C-E)。
缺血性损伤后功能失调的血脑屏障(BBB)会继而导致神经元网络重塑,这是缺血性脑卒中的突出病理特征。恢复血脑屏障完整性可促进缺血性损伤后的长期神经功能恢复,并减少卒中复发。因此,研究人员进一步实验确定C-Olig2注射液是否可以在卒中损伤下恢复BBB完整性。IgG是tMCAO小鼠脑组织梗死区域的可靠标志物,可作为BBB渗漏的可靠标志物。IgG 免疫染色显示,与Mock或I-Olig2处理的小鼠相比,C-Olig2处理的小鼠泄漏到脑组织中的IgG蛋白更少,表明通过注射C-Olig2维持了BBB完整性(图3H,I)。
为了更好地了解BBB的完整性恢复,研究人员使用CD31免疫染色测量了脑血管结构中闭合蛋白的表达,并使用ELISA检查了血管生成因子VEGF和Wnt7的水平。结果显示,注射C-Olig2的小鼠梗死周围区域的CD31微血管数量增加,脑组织中VEGF和Wnt7的浓度显著高于对照(图3J-M)。这些结果表明,C-Olig2在缺血性脑损伤后改善了神经系统损伤并促进了Wnt7b介导的BBB完整性恢复。
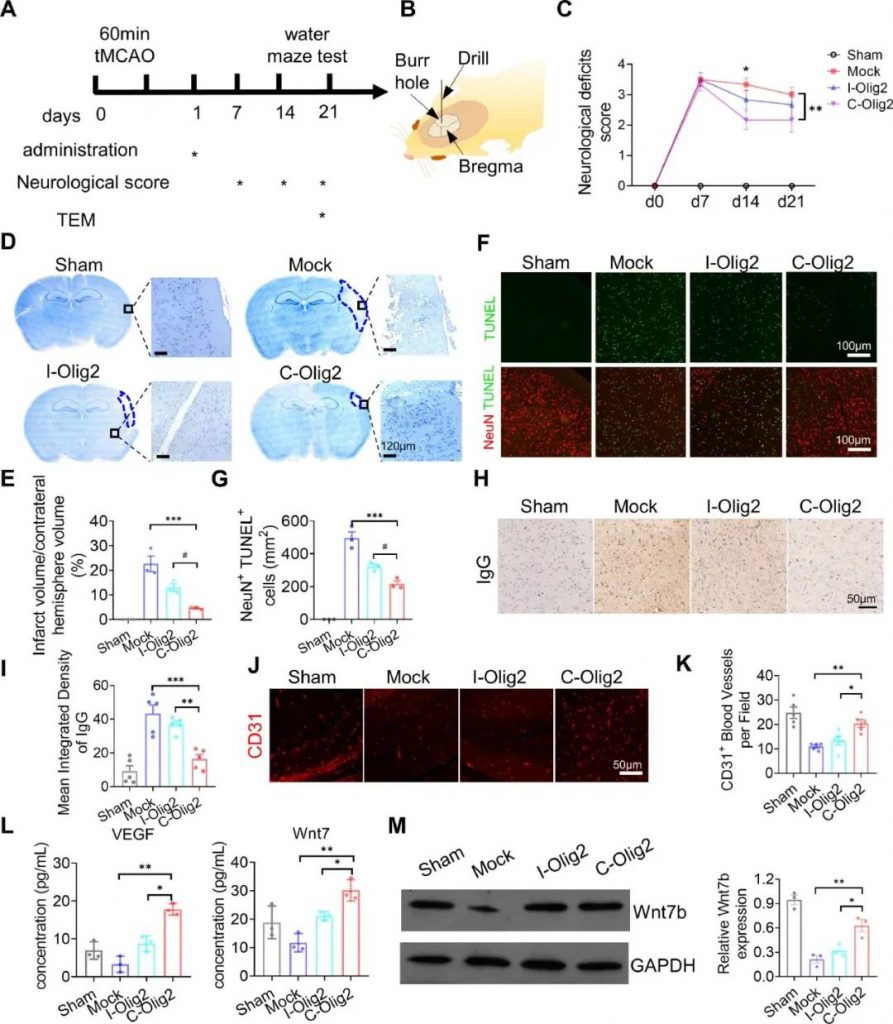
图3.脑内注射Olig2 mRNA改善缺血性损伤,恢复血脑屏障完整性
评估给药治疗21天后缺血性卒中小鼠海马区髓鞘碱性蛋白(MBP)表达发现,I-Olig2和C-Olig2组的MBP强度显著增加,C-Olig2组更为突出(图4A,B)。这一结果表明,C-Olig2给药增强了OPC向少突胶质细胞的成熟。TEM成像显示,C-Olig2组的有髓轴突密度显著高于I-Olig2组,而在有髓轴突中C-Olig2组的髓鞘厚度显著减少(髓鞘厚度越厚越不利于神经传导效率)(图4C,D)。
接下来,研究人员进一步探讨了髓鞘变化对损伤后学习记忆功能缺陷的恢复和行为表现的影响,采用MWM测试(水迷宫实验,评估空间学习记忆和相关形式学习记忆的程序)。在这一测试中,C-Olig2和I-Olig2组小鼠都比Mock组的小鼠耗费更少的时间成功逃逸(图4I)。此外,C-Olig2组小鼠在逃逸平台所在象限的停留时间更长,表明C-Olig2在行为改善方面的治疗效果超过了I-Olig2(图4J,K)。
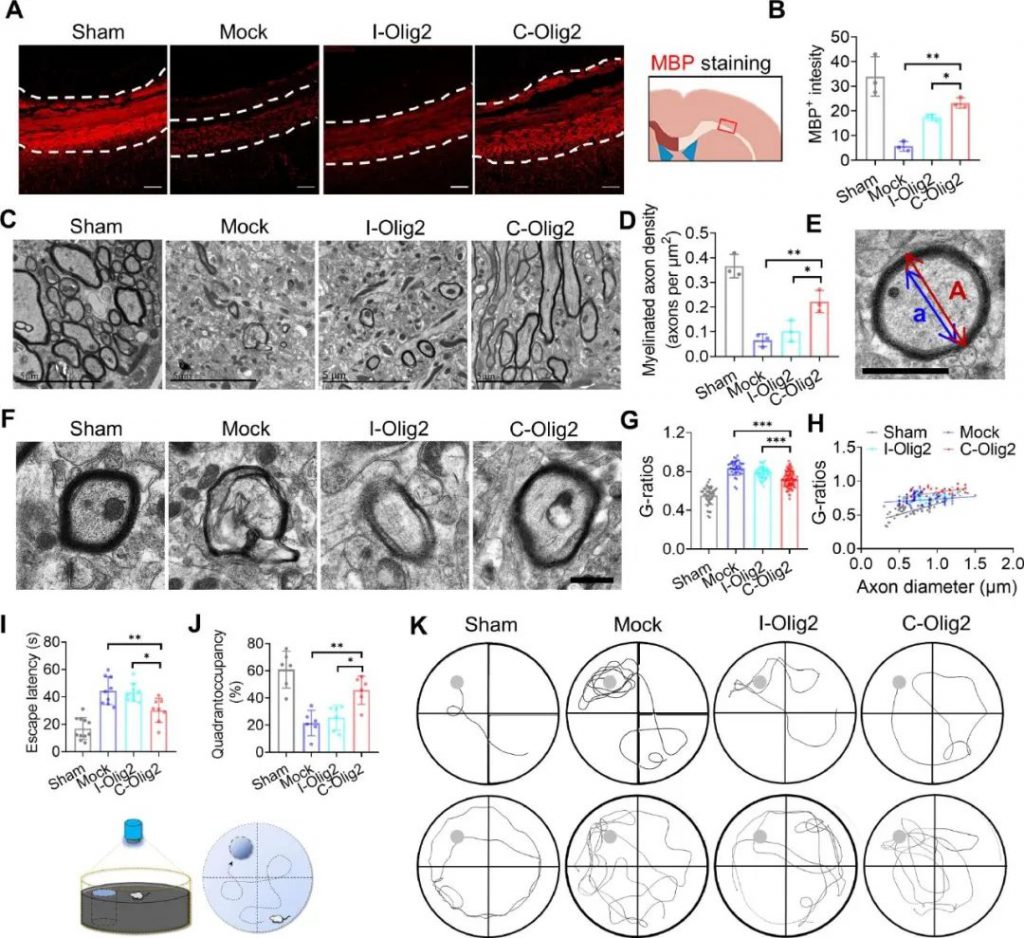
图4. Olig2 mRNA对髓鞘超微结构以及学习和记忆恢复的影响
总结
在这项研究中,将Olig2 mRNA-LNPs注射到小鼠脑中,通过分泌血管生成因子(如VEGF和Wnt7)促进血管生成来维持BBB的完整性。本研究结果强调了mRNA-LNPs在绕过BBB条件下用于缺血性脑卒中治疗的治疗潜力。
血脑屏障是大多数治疗策略的高度限制性生理屏障,目前大部分研究采取局部脑内给药的方式来绕过血脑屏障。然而,由于大量试验药物的低扩散特性以及手术对健康脑实质的严重损害,这些治疗的应用进一步受到阻碍。基于mRNA-LNP的治疗方式同样面对类似的问题,同时还需要考虑脂质制剂的生物降解性,以提高脑组织给药的安全性。
本研究表明,mRNA在未来临床应用中显示出巨大的治疗潜力。需要不断开发、优化下一代LNP或其他有前途的递送材料,支持未来利用基于mRNA的机制治疗各种脑部疾病的可能性。
资料来源
1.公众号细胞与基因治疗领域
https://mp.weixin.qq.com/s/5_AfVnZAo8PNRSsC61bApg
