PE系统由三部分组成,分别是nCas9、逆转录酶和pegRNA,pegRNA除了包含向导RNA(sgRNA)外,还包含逆转录酶模板(RTT)和引物结合位点(PBS),这是产生所需序列3′flap序列所必需的。
然而,目前PE系统还存在着一些挑战,系统太大导致的递送难题;较长的线性pegRNA不稳定且易被核酸酶降解。此外,它还存在对目标位点G/C-rich需求,以及脱靶性高的限制。
因此,如何进一步提升PE系统的精确性、消除对编辑位点的序列限制并降低递送难度,是基因组编辑领域亟待解决的重要技术难题。
2024年1月10日,中国科学院遗传与发育研究所高彩霞团队在 Nature Biotechnology 期刊发表了题为:Prime editing using CRISPR-Cas12a and circular RNAs in human cells 的研究论文。
该研究使用了尺寸更小的Cas12a开发了四个环状RNA介导的引导编辑器(CPE):niCPE、nuCPE、sniCPE和snuCPE。相比基于Cas9的先导编辑系统,CPE系统优先识别G/C-rich基因组区域,并具有多重编辑能力。其中,基于核酸酶的nuCPE和snuCPE系统的编辑效率高达10.42%,而基于切口酶的niCPE和sniCPE系统在人类细胞中分别达到24.89%和40.75%的编辑效率。此外,该研究还显示,niCPE和sniCPE系统可同时编辑多达四个基因。

迄今为止,所有开发的高效引导编辑器都使用了CRISPR-Cas9蛋白,该蛋白源自II型原核CRISPR-Cas自适应免疫系统。还有许多其他原核核酸酶被鉴定,例如IsrB、IscB、TnpB,以及各种V型CRISPR-Cas蛋白(包括Cas12a)。
Cas12a(1227aa)相比Cas9(1368aa)具有多种优势:Cas12a可识别基因组中A/T-rich区域,能够编辑Cas9无法编辑的位点,而且,Cas12a的脱靶性更低,尺寸更小,可实现更高效地递送,并促进多基因编辑
但由于Cas12a具有切割pegRNA的特点,因此,传统的pegRNA并不适用于基于Cas12a的引导编辑器的开发。
在这项研究中,研究团队开发了使用Cas12a的环状RNA(circRNA)介导的引导编辑系统——CPE,包括切口酶依赖的CPE(niCPE)、核酸酶依赖的CPE(nuCPE)、分裂切口酶依赖的CPE(sniCPE)和分裂核酸酶依赖的CPE(snuCPE)。
实验结果显示,niCPE和sniCPE的编辑效率高于nuCPE和snuCPE,但nuCPE和snuCPE在人类细胞中也表现出令人满意的编辑效果。具体来说,niCPE和nuCPE在人类细胞系HEK293T中效率分别高达24.89%和10.42%,适合慢病毒等大分子量递送系统。sniCPE和snuCPE在HEK293T细胞中效率分别高达40.75%和3.19%,适合腺相关病毒(AAV)递送系统。除了HEK293T细胞以外,niCPE和sniCPE在HeLa、N2A、MCF7等细胞中也能有效产生精确的引导编辑。
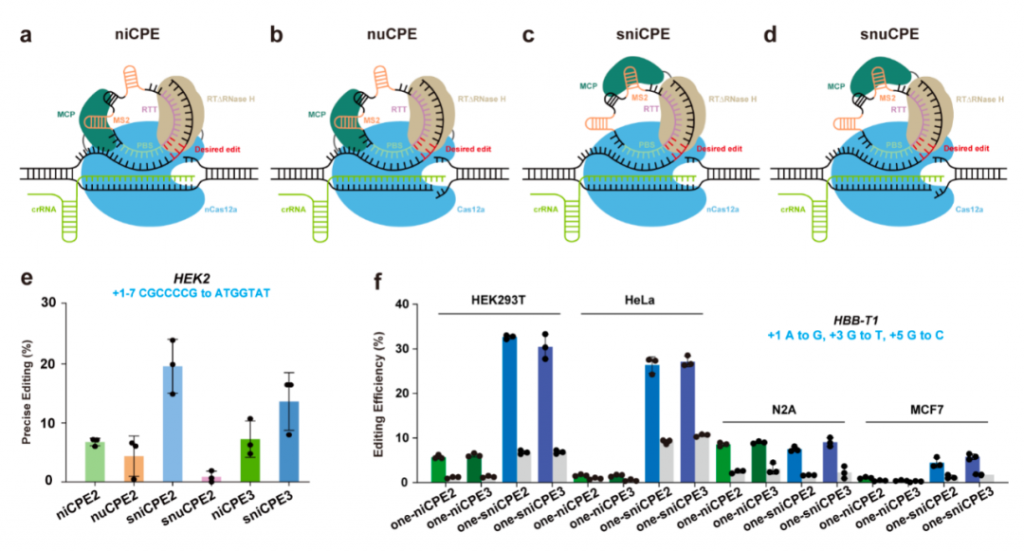
此外,研究团队将靶向不同基因位点的CRISPR RNA(crRNA)串联在一起,置于环状RNA的表达框中,然后将RTT-PBS序列也串联到环状RNA表达框中,用CPE系统进行多重编辑。结果显示,niCPE和sniCPE可以进行双基因、三基因和四基因编辑,sniCPE在四个位点上的编辑效率为1.09%-15.08%。
研究团队还进一步检测了CPE系统的脱靶效应,结果表明CPE具有优良的特异性,几乎没有检测到脱靶效应。
总的来说,该研究开发了基于Cas12a的环状RNA介导的引导编辑(CPE)系统,提供了一种可选靶向范围、多基因编辑能力和更小的尺寸,这对于CPE系统的包装和递送具有优势。低脱靶效应、高编辑效率的CPE系统为利用各种核酸酶开发为新型引导编辑系统提供了通用范式,多类型的CPE系统在生物研究、疾病治疗和作物育种等多场景中将发挥巨潜力。
派真生物很荣幸能为该研究提供AAV病毒包装服务,助力新型引导编辑器开发。派真生物多年专注于AAV包装服务,已经为20多个国家客户提供上万批次的AAV定制样品。未来,派真生物将继续创新地开发高效的AAV,助力更多基因编辑工具研究。
资料来源
论文链接:
https://www.nature.com/articles/s41587-023-02095-x
