
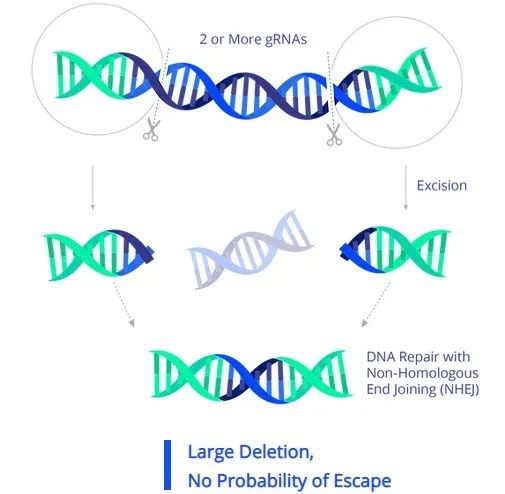
EBT-101是一款同类首创体内CRISPR基因疗法,采用腺相关病毒(AAV)来装载CRISPR-Cas9和两种向导RNA(gRNA),能够同时靶向HIV基因组中的3个位点进行多次切割,从而切除大部分HIV基因组,实现最大限度地减少潜在的病毒逃逸。在临床前动物实验中,长期非人类灵长类动物安全数据和转基因小鼠的疗效数据显示了EBT-101能够功能性治愈艾滋病。今年,EBT-101获得了FDA授予的快速通道称号。
▲ EBT-101(图片来源:官网)
所公布的数据显示,队列A中的所有参与者(n=3)均已安全给药,暂未观察到严重不良事件或剂量限制性毒性。尽管在前3例受试者中观察到4起可能/肯定与EBT-101相关的轻度(1级)不良事件(AE),但均在未进行干预的情况下逆转。未观察到与输注相关反应,也没有补体介导的毒性。3名受试者中有2名有短暂和可逆的转氨酶升高。
在4周内,3名受试者的血液中均可检测到EBT-101,在第一个剂量水平(9.0×1011 vg/kg)的情况下,单剂量EBT-101已实现外周暴露,且未观察到EBT-101基因载体在与男性生殖功能相关的两个组织区室中水平传播的证据。这些数据支持进一步剂量递增试验,该公司计划在今年第四季度进行这一试验并预计在明年公布新的数据。
数据的意义
现有的针对艾滋病的治疗手段可以长期抑制艾滋病毒,但潜伏的病毒储存库仍然隐藏在休眠的CD4细胞的染色体中,一旦停止药物治疗,就会产生大量的新病毒。多年来,针对艾滋病的功能性治愈研究导致了众多令人失望的结果,但这一探索却从未停止。CRISPR系统源于微生物的抗病毒防御系统,能帮助微生物识别外来病毒携带的核酸序列,并且切断这些核酸序列,达到抑制病毒繁殖的效果。当疾病痛点契合上技术优势,利用CRISPR治疗艾滋病也就“顺理成章”。
EBT-101作为首个应用到人体以治疗暂未攻克的艾滋病的体内CRISPR基因疗法,业内对这一候选产品的关注度较高。在其获批进入临床前,EBT-101已证明在多种动物模型中去除了前病毒DNA,并为HIV感染者提供了一个可能停止终身治疗的机会。去年9月,Excision公布了首例临床数据,给药2个月后患者的耐受性良好,直到今年10月又更新了3位患者的临床数据。
这些数据最重要的意义之一即初步证明了体内CRISPR基因疗法在人体中的安全性,尽管此前曾在动物模型中验证过,但动物模型与人体存在着较大差异,而在涉及基因组的创新药中,这种不确定性会引发对于安全性的担忧。这次试验是从动物模型验证过渡到人体验证的关键。
就在近日,一款体内基因编辑疗法VERVE-101刚被FDA解除临床搁置,而其被搁置的原因就是FDA担忧体内编辑会遗传给后代,希望Verve Therapeutics提供更多的信息。而针对这一担忧,Verve做了小鼠实验,未观察到遗传给下一代的现象,同时已经开展的临床试验也初步证明了安全性,因此临床搁置才得以解除。可见对于基因编辑疗法的安全性是受监管机构高度重视的。
EBT-101的治疗原理尽管不同于VERVE-101.但FDA在对这一类疗法的安全性的重视程度上并不会相差太大。“未观察到EBT-101基因载体在与男性生殖功能相关的两个组织区室中水平传播的证据”与Verve回应FDA担忧的证明有着“异曲同工之妙”。艾滋病是属于当下有控制手段而无治愈方法的疾病,并不像一些罕见病或者是肿瘤那样面临着死亡的迫切威胁,因此安全性的优先级可能高于有效性。在第一剂量队列初步证明了安全性后,患者的体内可以检测到EBT-101说明了该产品是有望全身性地去除前病毒DNA,距离其能够功能性治愈艾滋病的理论结果更进一步,或许这一候选产品能够打破以往令人失望的探索结果,为功能性治愈或艾滋病长期缓解铺平道路。
总结
新的治疗思路和技术层出不穷,这无论对于行业还是患者来说均是一个好现象。更进一步而言,如果未来EBT-101试验顺利,是不是也将意味着这一模式可以沿用到其他传染病领域,如针对乙型肝炎病毒、单纯疱疹病毒等,这也不仅仅是艾滋病领域的重要里程碑,也将有望推动CRISPR在更多疾病上的应用。
资料来源
1.公众号医麦客
https://mp.weixin.qq.com/s/9BbM3jrTiUxBTuZ9t7CU1A
关于派真
作为一家专注于AAV 技术十余年,深耕基因治疗领域的CRO&CDMO,派真生物可提供从载体设计、构建到 AAV、慢病毒和 mRNA 服务的一站式解决方案。凭借深厚的技术实力、卓越的运营管理和高标准的服务交付,我们为全球客户提供一站式CMC解决方案,包括从早期概念验证、成药性评估到IIT、IND及BLA的各个阶段。
凭借我们独立知识产权的π-alphaTM 293 细胞AAV高产技术平台,我们能将AAV产量提高多至10倍,每批次产量可达1×10¹⁷vg,以满足多样化的商业化和临床项目需求。此外,我们定制化的mRNA和脂质纳米颗粒(LNP)产品及服务覆盖药物和疫苗开发的各个阶段,从研发到符合GMP的生产,提供端到端的一站式解决方案。

