mRNA(messenger RNA)是一种极具前景的新型基因疗法,并已成为疫苗以及癌症或遗传疾病疗法的主要候选药物。mRNA相比其它基因药物具有独特优势,例如生物安全性高、无基因组整合风险、无突变插入风险、研发周期短、生产工艺简单、特异性强、高效等,使得mRNA疗法备受关注。
派真提供高质量、短周期、工艺稳定的定制 mRNA服务。派真CRO到GMP整体解决方案,简化疫苗和药物开发流程,加速mRNA疗法早日惠普大众,助力早期研发顺利过渡到GMP生产。
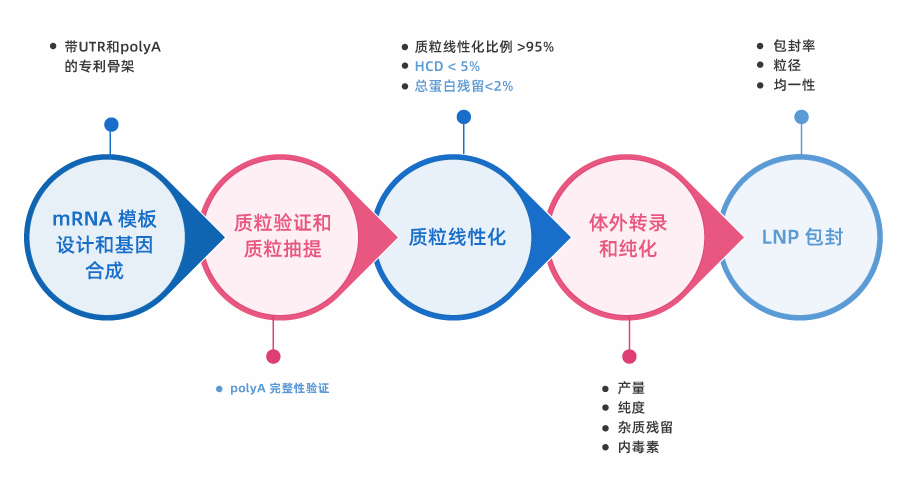
*可根据客户需求提供定制服务
体外转录 (IVT) 是一种使用 DNA 模板和 RNA 聚合酶合成 mRNA 的方法。派真通过包含启动子序列、目的基因和 polyA 尾的质粒模板体外转录合成mRNA。IVT过程中,RNA 聚合酶识别模板上的 polyA 尾序列并将其整合到 mRNA 中。polyA尾的添加使mRNA更加稳定、起始翻译效率更高。IVT是科研领域、临床前和临床应用中最常用的 mRNA 生产方法之一。
- 简化生产流程:在IVT过程中,直接从质粒模板中添加polyA尾可以简化生产流程,无需额外的生产步骤来添加polyA尾,缩短了总生产周期。
- 效率更高:在IVT过程中直接从质粒模板中添加polyA尾比在转录后添加更有效,同时质粒模板上的polyA尾,也增加了mRNA多聚腺苷酸化效率。
- 一致性:使用含polyA尾的质粒模板可以确保polyA尾的长度和组成在生产的mRNA批次中保持一致。
- 可放大生产:质粒模板的使用还可以实现mRNA的放大生产。一旦建立了质粒模板,mRNA的生产可以很容易地扩大规模,以生产大量的mRNA,用于科研、临床前或临床。
- 定制:质粒模板可以设计特定的调控元件,如启动子和增强子,可用于控制mRNA的翻译和表达。此外,polyA尾还可以增强mRNA的稳定性,从而提高其翻译效率和表达水平。
- 成本低:使用质粒模板进行 IVT 是一种经济高效的mRNA 生产方法。质粒DNA合成的成本相对较低,添加polyA尾也可以消除对相对成本较高的polyA聚合酶的需求。
| 服务类型 | 加帽和修饰 | 目的基因 | 总量 | 周期(工作日) |
|---|---|---|---|---|
| mRNA | 定制 mRNA Cap1 | 定制/现货 | 100 μg-20 mg | 3-15 |
| 定制 mRNA Cap1 N1meΨU | ||||
| mRNA-LNP | 定制 mRNA Cap1-LNP | 定制/现货 | 100 μg-20 mg | 10-25 |
| 定制 mRNA Cap1 N1meΨU-LNP |
*基因合成载体构建服务需额外增加2~3周
mRNA 质控标准
| 类别 | 检测项目 | 检测方法 | 检测标准 | 科研级 | 加测项目 |
|---|---|---|---|---|---|
| 鉴定 | 外观 | 目视检查 | 透明,无异物 | √ | |
| mRNA浓度 | Nanodrop | ≥1 mg/mL | √ | ||
| RNA完整性/大小 | 毛细管电泳CE | 完整性≥80%;符合预期条带大小,±30% | √ | ||
| Buffer类型 | 可选 | RNaseFree H2O(默认),PBS,1mM 柠檬酸钠 pH=6.4 | √ | ||
| 纯度 | A260/280 | Nanodrop | 1.70-2.30 | √ | |
| 纯度 | 毛细管电泳CE | >80% | √ | ||
| 杂质 | 总蛋白残留 | Nano Orange | ≤1% | √ | |
| 质粒 DNA 残留 | qPCR | ≤0.1% | √ | ||
| dsRNA | Slot-blot | ≤1% | √ | ||
| 安全 | 内毒素 | 半定量鲎试剂法 | <10 EU/mg | √ | |
| 内毒素 | 定量检测 | <10 EU/mg | √ | ||
| 生物负载 | 直接培养法 | 48小时内无生长 | √ | ||
| 线性化 | 线性化百分比 | 凝胶电泳AGE | >95% | √ | 高效液相色谱仪 |
| 宿主细胞DNA | qPCR | ≤ 5% | √ | ||
| 总蛋白残留 | Nano Orange | ≤1% | √ | ||
| RNA残留 | 凝胶电泳AGE | 未检出,上样量200 ng | √ | ||
| 质粒 | 目的基因 | Sanger 测序 | 100% 匹配参考序列(不包括 poly A) | √ | |
| poly A | Sanger 测序 | ≤110A ±5 nt ≤111-125A ±8 nt | √ | ||
| Poly A 长度 | LC-MS | ±5% | √ |
(滑动查看更多)
IVT mRNA是mRNA疗法和疫苗开发的关键部分。派真提供多种检测项确保IVT mRNA的质量。
电泳
电泳是一种RNA片段大小分离和可视化技术。它可用于确认 mRNA 的完整性,以及有没有降解或杂质。
紫外–可见分光光度法
紫外–可见分光光度法是一种用于检测溶液中RNA浓度的技术。它可用于确保 mRNA 浓度在所需范围内,且没有可能干扰下游应用的污染物。
毛细管电泳
毛细管电泳CE是一种通过RNA片段大小和电荷分离RNA片段,来测量mRNA纯度的技术。它可用于确定完整mRNA的百分比,以及是否存在截短或降解的片段。
内毒素检测
内毒素是革兰氏阴性细菌细胞壁中的一种成分,又叫做脂多糖,可引起人体不良免疫反应。为确保IVT mRNA的安全性,其内毒素水平须保持在一定阈值以下。
无菌检测
无菌检测是检测样品或原材料是否无菌的技术。它可确保IVT mRNA不受任何微生物污染,可以用直接接种法或薄膜过滤法进行无菌检测。
可选以下检测项目进一步验证 mRNA 的质量:
- Nano Orange检测总蛋白残留:该方法用于检测mRNA 样品中的总蛋白质含量。Nano Orange染料与样品中的蛋白质结合,测量荧光信号可确定蛋白质浓度。该检测可确保 mRNA 样品不含蛋白质污染物,这些污染物会干扰下游应用。
- qPCR检测质粒DNA残留:该方法用于检测mRNA 样品中的残留质粒 DNA的含量。质粒DNA通常被用作mRNA合成的模板,残留的质粒DNA可以保留在最终产物中,从而引起宿主的免疫反应。qPCR是一种灵敏的技术,可以检测mRNA样品中低水平的质粒DNA含量。
- slot-blot法检测dsRNA:该方法用于检测mRNA 样品中双链 RNA (dsRNA)残留量。dsRNA可以在mRNA合成过程中形成,并可以引起宿主的免疫反应。Slot-blot是一种将RNA样品转移到硝酸纤维素膜上,然后与dsRNA特异性探针杂交的技术。可以对产生的信号进行量化,以确定样品中dsRNA的总量。
以上检测有助于确保mRNA 的质量、纯度和安全性,对其应用于 mRNA 治疗和疫苗领域至关重要。
mRNA细胞转染实验

脂质纳米颗粒 (LNP) 是由脂质组成的纳米颗粒,用作药物(包括 mRNA)的递送载体。基于 LNP 的方法是最受欢迎的 mRNA 递送方法。mRNA-LNP具有多种优势,包括提高稳定性、提高递送效率、降低免疫原性、可定制和临床成功案例。这些优势使LNP成为开发和应用安全有效的mRNA疗法和疫苗的最有前景的工具之一。
- 提高稳定性:LNP 可以保护 mRNA 免受体内酶和其他因子的降解,从而提高稳定性并改善 mRNA 向靶细胞递送效率。
- 增强递送:LNP可以促进细胞更有效地摄取mRNA,从而提高蛋白质表达水平。LNP 还可以通过细胞类型特异性内吞机制实现摄取,从而将 mRNA 靶向递送至特定细胞,例如免疫细胞或肿瘤细胞。
- 免疫原性降低:LNP可以保护mRNA免受免疫系统的影响并防止先天免疫反应激活,从而降低mRNA的免疫原性。这可以提高mRNA疗法和疫苗的安全性和有效性。
- 定制:可以通过修改LNP的组成成分以改善其特性,例如稳定性,递送效率和免疫原性。这允许针对特定应用定制 LNP,例如针对特定疾病的疫苗或疗法。
- 临床成功:LNP 已成功用于开发 COVID-19 的 mRNA 疫苗,在临床试验中显示出高效性和安全性。这一成功增加了人们对将LNP用于其它mRNA疗法和疫苗的兴趣。
mRNA-LNP质控标准
| 类别 | 检测项目 | 检测方法 | 标准 | 科研级 |
|---|---|---|---|---|
| mRNA-LNP(现货和定制) | RNA完整性/大小 | 毛细管电泳CE | >80% | √ |
| 包封率 | RiboGreen | 出具报告 | √ | |
| 粒径 | DLS | <120 nm | √ | |
| 均一性 | DLS | <0.2 | √ | |
| 浓度 | / | ≥0.2 mg/mL(默认),可定制浓度 | √ |
派真严格控制各种参数以确保mRNA-LNP的质量、安全性和有效性。mRNA LNP 的基本QC检测项目包括包封率、粒径和均一性。
- 包封率:包封率 ( Encapsulation efficiency,EE) 是衡量脂质纳米颗中封装了多少mRNA的标准之一。高包封率有利于确保足量 mRNA 递送至靶细胞,较低的包封率会降低治疗效果。包封率可以通过使用离心或超滤方法从LNP中分离游离mRNA来测量,然后对封装的mRNA进行定量。包封率的测量分以下几个步骤进行:
-
- 获得制剂中使用的mRNA总量。可通过测量 mRNA 溶液的浓度并将其乘以使用的总体积来确定。
- 将封装的mRNA与游离的mRNA分离。可通过离心或超滤来完成。
- 测量封装的mRNA的量。可通过量化破乳后沉淀中mRNA的浓度来确定。
- 使用以下公式计算封装效率:
包封率 (EE) = (封装 mRNA 量 / mRNA 总量) x 100%
例如,如果您在制剂中使用了 1 mg mRNA,并在离心后获得了 0.8 mg 封装的 mRNA,则封装效率为:
EE = (0.8 毫克/1 毫克) x 100% = 80%
这意味着 80% 的 mRNA 被封装在 LNP 中,其余 20% 在溶液中游离或降解。
- 粒径:粒径是LNPs疗效和安全性的关键参数,粒径会影响LNPs的生物分布和细胞摄取,较大的颗粒更容易聚集,导致稳定性降低和毒性增加。可以使用动态光散射 (DLS) 测量颗粒大小,该检测确定颗粒的流体动力学直径。
- 粒度分布和均一性:除粒径外,LNP的粒径分布和均一性对其稳定性和有效性也很重要。窄的尺寸分布和均一性可以改善LNP的生物分布和细胞摄取,而宽的尺寸分布会导致不同的摄取和潜在的毒性。可以使用DLS或其它方法(例如纳米颗粒跟踪分析NTA)测量尺寸分布和均一性。
这些参数对于确定 LNP 将 mRNA 递送至靶细胞和组织以及评估其潜在毒性和不良反应至关重要。
IVT mRNA

毛细管电泳CE检测显示派真生产的mRNA片段大小在目标大小的 ±30% 范围内,且纯度 >80%。±30%范围可确保 mRNA 的大小符合预期,并且不同批次样品之间的 mRNA 大小基本一致。纯度>80%表明样品中mRNA含量较高,污染物水平相对较低,例如DNA基因组、RNA降解产物和mRNA合成过程中的残留试剂等。这些污染物会影响mRNA在下游应用中的功效和安全性。
数据由 Agilent 5200 CE System 测量,Agilent 5200 CE System是一种用于分析核酸(包括 mRNA)的高灵敏度和高精确度仪器。
EGFP mRNA (Cap1)-LNP
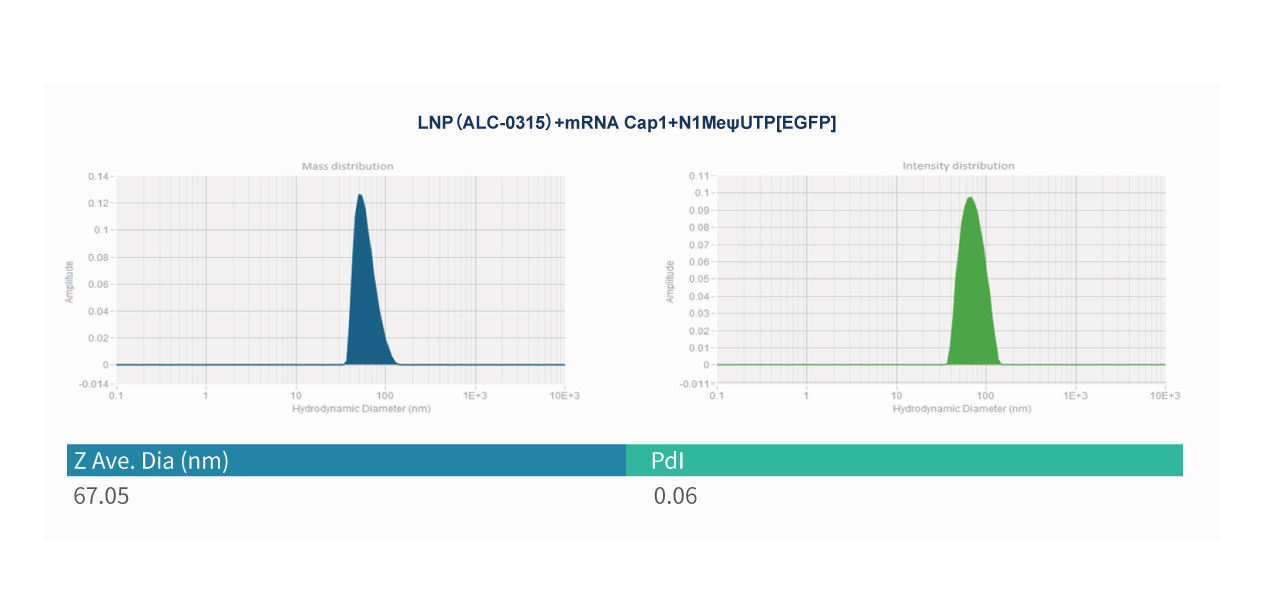
Z-average Diameter(平均粒径)是通过动态光散射(DLS)技术测量纳米颗粒的布朗运动来确定的平均水合直径。在DLS检测中,使用激光束照射样品,然后通过光散射仪器收集样品散射的光,通过分析散射光的强度分布,可计算纳米颗粒的布朗运动速率,并确定颗粒在溶液中的尺寸分布曲线。然后通过尺寸分布的强度计算加权平均值得到。这种计算方式同时考虑粒子数量及其散射功率。这意味着较大的颗粒比较小的颗粒对整体平均粒径的贡献更大。平均粒径通常以纳米(nm)为单位,是表征纳米颗粒大小的重要参数,反映了溶液中颗粒总体尺寸。派真mRNA-LNP保证平均粒径≤120 nm,包封率≥90%。
PDI 代表多分散指数,它是衡量纳米颗粒包含用于 mRNA 递送的LNP,粒径均匀性、尺寸分布宽度的标准之一。较低的PDI值表明样品中的纳米颗粒具有相对较窄的尺寸分布,尺寸均一性好,而较高的PDI值表明样品中含有尺寸范围较广的纳米颗粒,尺寸均一性较差。PDI越低,LNPs大小越均匀,对于mRNA-LNP的递送越有利的,降低PDI可提高其在体内的稳定性、有效性和安全性。高 PDI 值可能表明 LNP 配方或制造不良,这可能导致粒径变化并影响 mRNA 递送系统的一致性和可重复性。派真mRNA-LNP保证PDI<0.2。
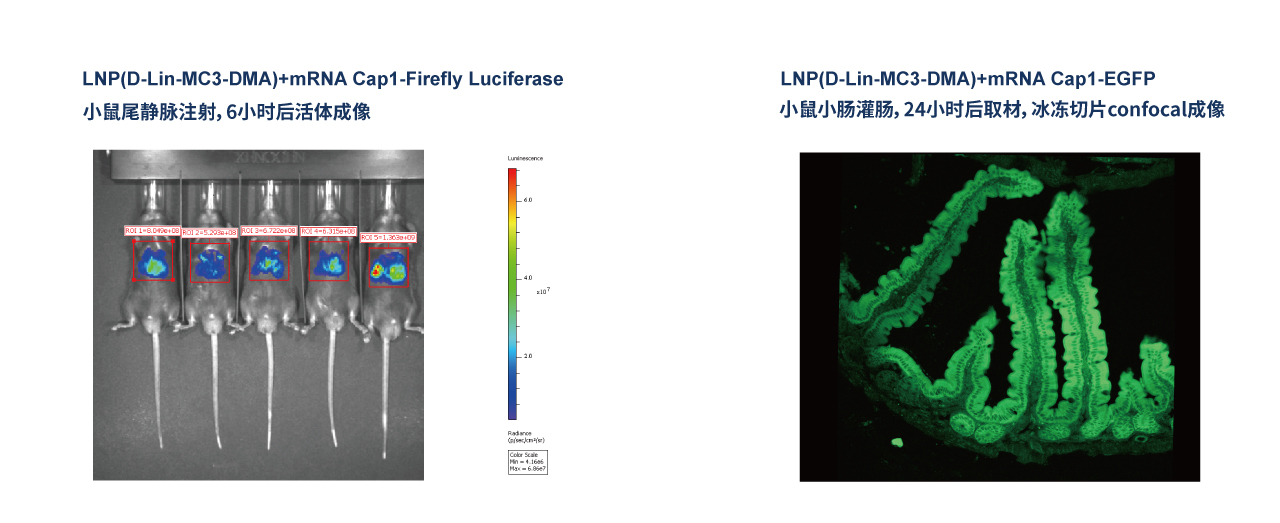
mRNA-LNP动物实验
信使 RNA (mRNA) 是一种将遗传信息从 DNA 传递到核糖体,在那里作为蛋白质合成模板并决定基因表达蛋白产物肽链的氨基酸序列的RNA分子。近年来,mRNA技术因其在各个领域的应用潜力而受到广泛关注。mRNA的一些主要应用包括:
联系我们
