NHP动物指的是非人灵长类动物(Non-human primate),通常包括猴子、黑猩猩等,它们在生理、认知能力、神经解剖学、社会复杂性、繁殖和发育等方面与人类具有高度相似性。NHP动物模型因其与人类的遗传物质有75%~98.5%的同源性,在基础和转化生物医学研究中发挥着重要的作用。
NHP动物实验在许多科学领域都是必要的,例如药物研发、疫苗测试和神经系统科学研究等。在药物研发中,NHP可以被用来研究新药的疗效和安全性,以及药物在体内的吸收、分布、代谢和排泄等过程。在神经系统科学研究中,NHP可以被用来研究大脑的认知功能、神经退行性疾病和脑部损伤等。
| 类型 | 总量 | 规模 | 交付周期 |
|---|---|---|---|
| 标准衣壳 | 保证产量 | 5.0E+13 GC~8.0E+15 GC | 17个工作日 |
| 定制衣壳 | 根据规模 | ~100 L(可小规模测试) | 25个工作日 |
AAV的产量取决于多种因素,包括血清型、目的基因和其它变量。我们为高产量的常用 AAV 血清型,例如 AA1、AAV3b、AAV5、AAV7、AAV8、AAV9 和AAV Rh10等,提供有保证的包装。对于其它产量低或未知的血清型,我们根据产量生产它们。为了确定实现目标所需的产量,我们可以进行小规模测试。如果您不确定您的血清型是否符合我们的套餐保证条件,请联系我们的技术支持团队以获取更多信息。
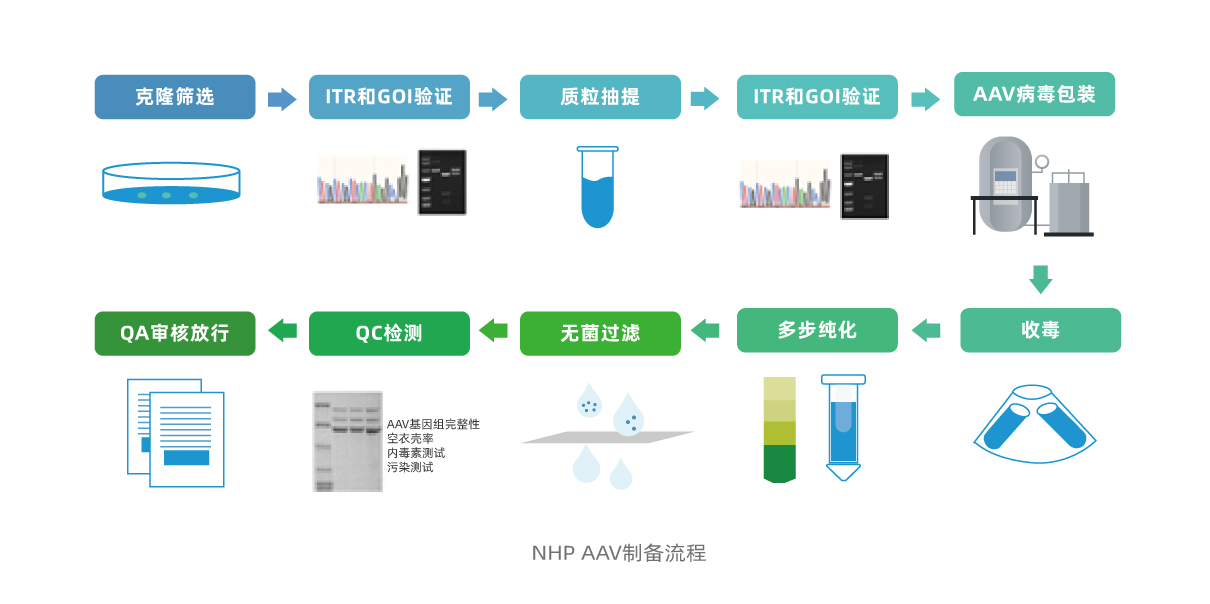
非人灵长类AAV的制备流程
NHP 级AAV的制备流程包括克隆筛选、 ITR(反转末端重复序列)和GOI(目的基因)的验证、质粒制备、ITR和GOI验证、AAV包装、病毒收集、纯化、无菌过滤、QC检测和QA审核放行。
首先,对目的基因序列进行扩增,构建质粒,转化大肠杆菌,筛选阳性克隆,对ITR和GOI进行酶切和测序验证,以确认基因的正确表达。在质粒制备完成后,需再次对ITR和GOI进行验证,确保基因正确表达。
接下来,将包含ITR和GOI 的顺式质粒、辅助质粒和 Rep-Cap 质粒,总共三个质粒共转染HEK 293 系。我们将进行小规模培养以确定细胞生长和病毒生产的最佳条件,之后将放大规模生产AAV载体。
粗纯化步骤将AAV载体与细胞碎片和其他污染物分离。然后进行浓缩和超速离心以浓缩并进一步纯化AAV载体。无菌过滤步骤去除残留的微生物。
最后一步是一系列质量控制(QC)测试,包括AAV基因组完整性、空衣壳率、内毒素测试和污染测试等。这些测试的结果由质量保证 (QA) 团队审查,然后放行。
这种制备流程的好处是它可以最大限度地降低安全风险,提高疗效,并确保结果的可重复性,使其适用于非人灵长类动物研究。
| 检测项目 | 检测方法 | 质量标准 | ||
|---|---|---|---|---|
| 标准质控检测项目 | 理化 | 外观 | 目视检查 | 透明、无色、无可见颗粒 |
| 鉴别 | AAV 衣壳蛋白鉴别 | SDS-PAGE 银染 | 与预期衣壳蛋白大小一致 | |
| 纯度 | 空壳率 | 透射电镜法 | 空壳率<20% | |
| AAV 基因组完整性 | 毛细管电泳(CE) | 出具检测报告 | ||
| 滴度 | 基因组滴度 | ddPCR | 标准衣壳:滴度和总量满足要求;定制衣壳:总量取决于产量 | |
| 安全性 | 内毒素 | 凝胶法 | <1EU/mL | |
| 支原体检测 | qPCR | 阴性 | ||
| 无菌检测 | 直接培养法 | 无菌生长 | ||
| 可选的质量控制项目或服务 | 基因组完整性 | AAV基因组测序 | 纳米孔测序 | 出具测序检测报告 |
| 纯度 | 空壳率 | 分析型超速离心(AUC) | 出具检测报告 | |
| AAV 基因组完整性 | 碱性电泳 | 出具检测报告 | ||
| 杂质 | Triton残留分析 | HPLC | <5 ppm | |
| 安全性 | 内毒素控制 | 凝胶法 | <0.2 EU/mL | |
| 生物负载 | 直接培养法 | 无菌生长 | ||
非人灵长类AAV级在放行前要经过严格的QC测试,以确保AAV产品的质量,并将动物研究中的不良影响降至最低。
AAV 衣壳大小
该测试使用 SDS-PAGE 银染来验证 AAV的衣壳蛋白大小。
空壳率
该测试使用透射电子显微镜(TEM)来测量 AAV 产品中空衣壳的百分比。空壳率必须低于 20%。
内毒素
该测试使用鲎变形细胞裂解物(LAL)来检测内毒素水平,内毒素水平必须低于 1 EU/mL。
支原体检测
该测试使用qPCR来确保AAV产品中没有支原体污染。
无菌检查
该测试使用直接接种来检测 AAV 产品中是否存在任何微生物生长。
通过毛细管电泳检测AAV基因组完整性
该测试使用毛细管电泳(CE)来检测 AAV 基因组的完整性,并出具测试结果报告。
ddPCR
相较于qPCR,ddPCR能更准确地定量AAV滴度,因此,我们用ddPCR检测AAV 产物的滴度,如果首次测量AAV的滴度大于1E+13 vg/mL,则将其稀释至滴度为 1 E+13 vg/mL后再次测量。对于保证产量的AAV血清型,产品的浓度和总量将满足保证产量包;对于非保证产量的AAV血清型,产品的浓度和总量将基于生产规模。
除上述测试外,还可以进行几种可选的QC测试,包括通过Nanopore进行AAV基因组测序,用分析型超速离心(AUC)技术检测空壳率,用HPLC进行Triton残留分析,以及用于检测快速生长和缓慢生长微生物的无菌检查。
用于NHP级AAV包装的高标准质粒
为确保目的基因的保真度和高效的AAV包装,用于NHP级AAV包装的质粒经过严格的质量控制。基本质控项目包括外观要求、A260:280 比值、均一性(超螺旋 >80%)、限制性内切酶分析、RNA 和宿主 DNA残留、内毒素 (≤0.01 EU/μg) 以及质粒的Sanger 测序分析,这些对于确保基因治疗中AAV的有效递送至关重要。
除了基本标准外,还有一些高级要求,这些要求不包括在默认包中,可根据要求提供,但需要额外付费。这些高级要求包括宿主蛋白残留、低内毒素生产工艺(<0.005 EU/µg)、无菌检查、支原体污染、ITR 纳米孔测序、无动物源成分生产工艺证明、菌种溯源资料、卡那霉素残留、无菌检查、专用纯化树脂等。
| 检测项目 | 检测方法 | 质量标准 | ||
|---|---|---|---|---|
| 基本标准 | 理化 | 外观 | 目视检查 | 透明、无色、无可见颗粒 |
| pH | 电位法 | 7.0-8.0 | ||
| 鉴别 | 质粒测序 | Sanger测序法 | 100% 匹配 ITR 和 GOI 正确且测序图无杂峰 | |
| 限制性内切酶分析 | 琼脂糖凝胶电泳 | 匹配图谱 | ||
| 纯度 | A260:280 | UV法 | 1.8 - 2.0 | |
| 超螺旋比例 | HPLC | 超螺旋比例>80% | ||
| 杂质 | RNA残留 | 琼脂糖凝胶电泳 | 未检出 | |
| 宿主 DNA残留 | qPCR法 | <10 µg/mg | ||
| 安全性 | 内毒素 | 凝胶法 | ≤0.01 EU/µg | |
| 无菌检查 | 薄膜过滤法 | |||
| 可选服务项目 | 杂质 | 宿主蛋白残留 | ELISA,Nano orange | <0.1% |
| 卡那霉素残留 | ELISA | 无检出 | ||
| 安全性 | 内毒素<0.005 EU/μg | 凝胶法 | <0.005 EU/µg | |
| 支原体污染 | qPCR | 阴性 | ||
| 无菌检查 | 直接培养法 | 无菌生长 | ||
| 其他 | 感受态细胞(菌种库检定) | JM108、Sure、Sure2、Stbl3、NEBStbl | 根据客户要求 | |
| ITR 完整性 | 纳米孔测序 | 出具测序结果报告 | ||
| 无动物源性成分生产工艺证明 | TSE/BSE声明 | |||
| 专用纯化树脂,膜包,膜柱 | 根据客户要求 | |||
| 缓冲液 | 根据客户要求,默认TE | |||
| 分装 | 分装规格根据客户要求确定 | |||
| 菌种溯源资料 | COA及购买发票 | |||
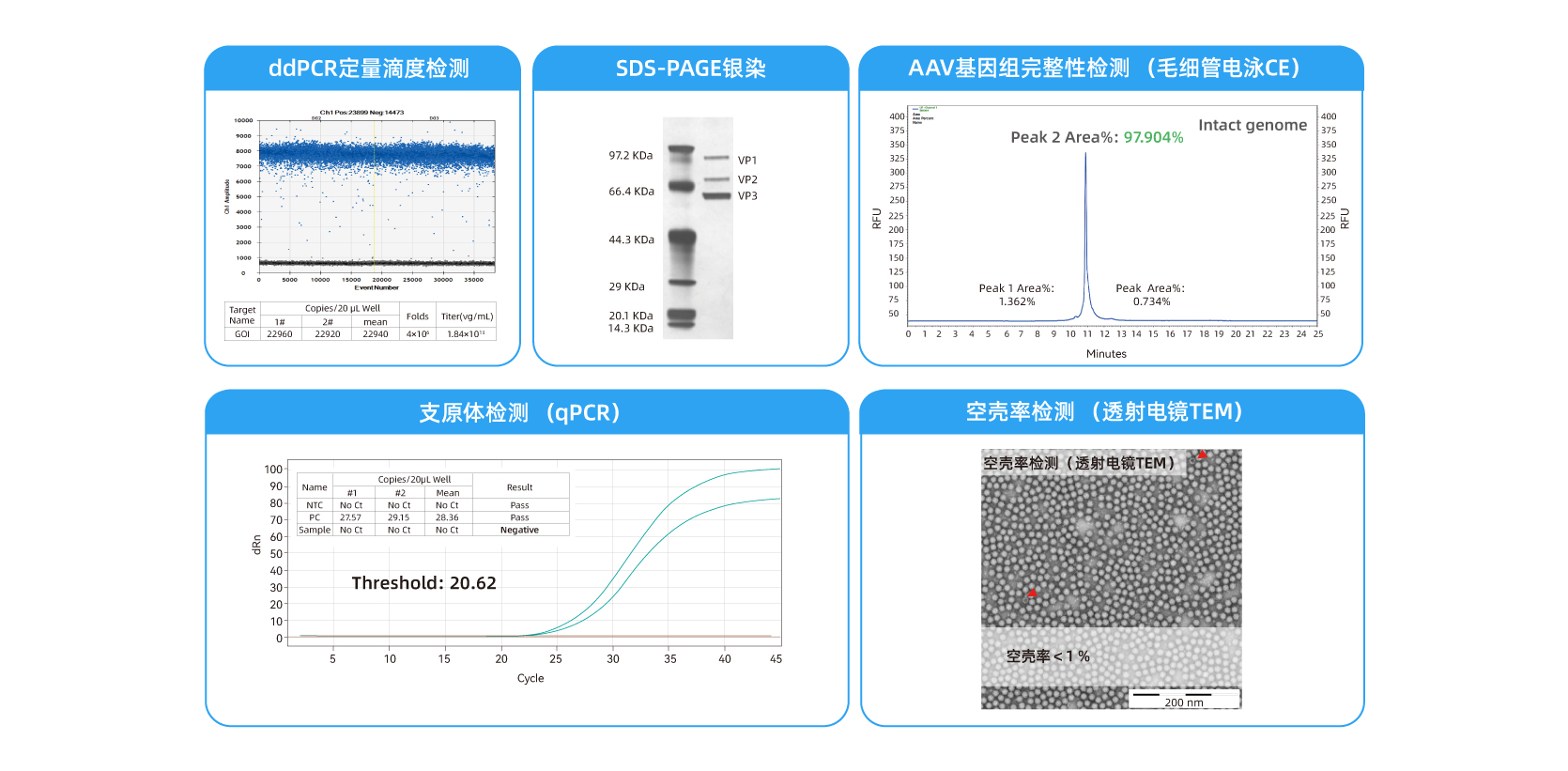
我们采用多种不同的检测方法从各个方面评估了AAV的质量,包括其基因组完整性、衣壳大小和污染物的存在等,以确保AAV可以用于NHP的研究。
微滴式数字PCR(ddPCR)是一种高灵敏度的定量样品中AAV含量的方法。它可以准确和精确地测量每毫升的AAV基因组拷贝数。
定量PCR(qPCR)是一种检测和定量样品中支原体污染的方法。支原体是细胞培养物中的常见污染物,会影响AAV质量,因此确认其不存在很重要。
毛细管电泳(CE)是一种用于分析AAV基因组完整性的技术。CE 可以检测截短或重排的 AAV 基因组片段的存在,这可能会影响 AAV 的效力和安全性。
十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)和银染是分析AAV衣壳蛋白大小和纯度的方法。这些方法可以检测杂质的存在,并确保衣壳大小与AAV血清型的预期大小一致。
透射电子显微镜(TEM)和分析型超速离心(AUC)是确定AAV样品中空壳比例的方法。空衣壳是不可取的,因为它们不含治疗的有效成分,并且会降低 AAV 载体的功效,因此监测空壳率对于确保AAV产品的效力和质量非常重要。
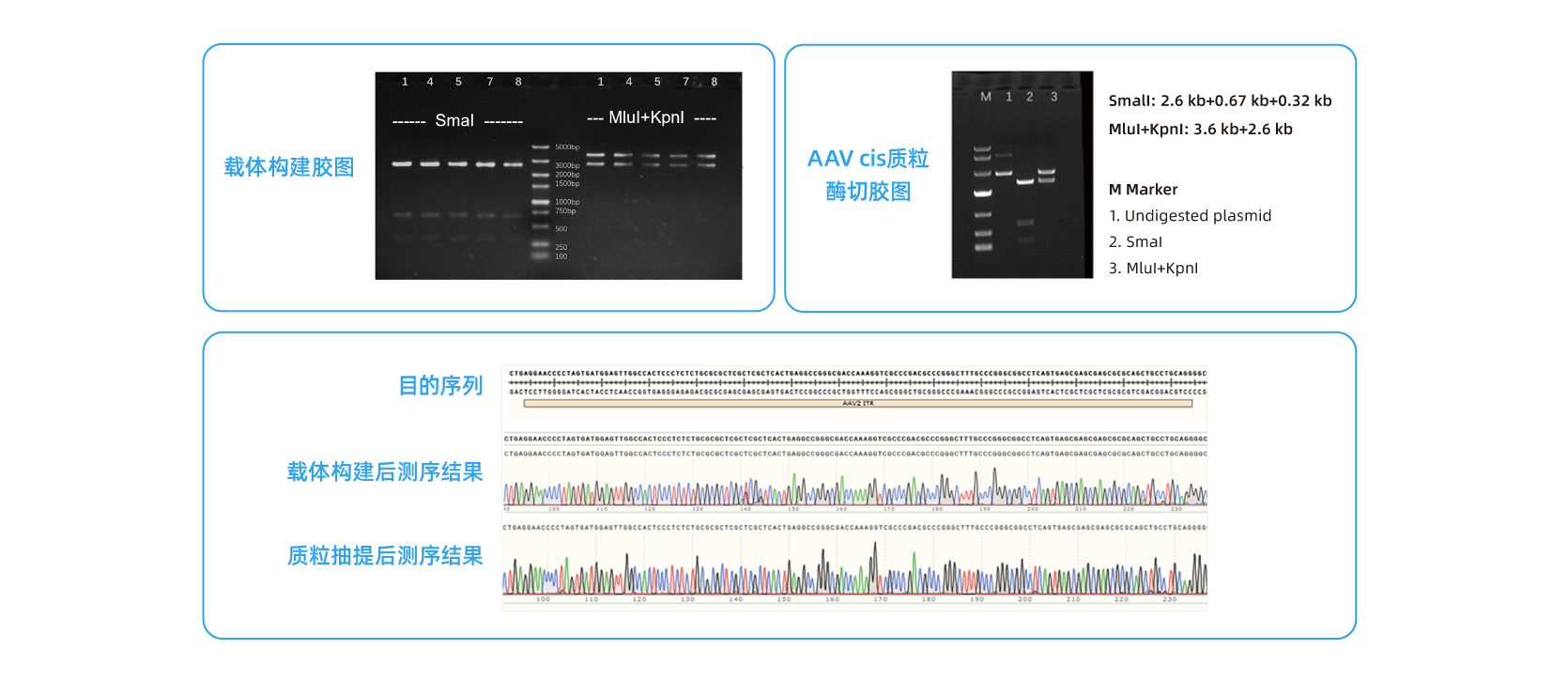
在收到客户的AAV顺式质粒模板后,除了在克隆筛选期间验证GOI大小外,我们还对ITR完整性进行了双重检查,然后再放大质粒生产规模。质粒制备完成后,进行另一轮ITR和GOI测序,确保序列的保真度。您可以放心,我们用于 NHP 级 AAV 的质粒具有最高的质量和完整性。
联系我们
