COVID-19大流行已经在全球范围内肆虐了两年多,造成了数亿人感染和数百万人死亡。随着感染人群的增多,如今的新冠病毒已积累了大量的变异,演化为德尔塔(Delta)和奥密克戎(Omicron)等传染性和免疫逃逸能力更强的突变株。
近日,海南三亚的新冠疫情引发广泛关注,而引起本次疫情的病毒株为奥密克戎BA.5.1.3变异株,为我国首次报道。这种新变异株具有传染性强、传播速度快、隐匿性强等特点,防控难度较大。
新冠突变株的不断出现削弱了现有COVID-19疫苗和中和抗体治疗的有效性。但无论是哪一种SARS-CoV-2突变株,其感染仍然依赖于血管紧张素转换酶2(ACE2)这一受体。因此,可溶性人源ACE2 (shACE2)作为一种潜在药物可以广泛阻断新冠突变株感染。
2022年8月,中山大学公共卫生学院(深圳)舒跃龙/孙彩军团队在Antiviral Research 期刊上发表题为:Rational design of AAVrh10-vectored ACE2 functional domain to broadly block the cell entry of SARS-CoV-2 variants的研究论文。
该研究设计了一系列截短的ACE2同源蛋白,并将其构建到以AAVrh10为载体的重组腺相关病毒(rAAV)载体中,这些重组ACE2蛋白在体内和体外均表现出对SARS-CoV-2原始病毒株和突变株广泛的阻断效果。

该研究中使用的表达不同ACE2片段的腺相关病毒AAVrh10均由派真生物(PackGene Biotech)构建。作为一家专注于重组腺相关病毒(rAAV)载体包装的CRO &CTDMO科技公司,派真生物致力于为基因功能以及基因治疗研究提供从质粒克隆到AAV包装的一站式解决方案,将助力AAV在阻断新冠突变株感染的科学研究进展。

自新冠疫情爆发以来,不少研究报道人源重组可溶性ACE2(hrsACE2)可以有效地阻断SARS-CoV-2感染,部分临床研究已经在健康志愿者和COVID-19患者中进行了Ⅰ期和Ⅱ期临床试验。
此外,可溶性ACE2(sACE2)还有许多优化方向,例如,通过随机诱变获得高亲和力的sACE2与新冠病毒S蛋白的RBD结构域结合,与Fc(可结晶片段)融合构建Fc-sACE2以延长其药代动力学半衰期,通过计算设计截短ACE2功能片段以减少其副作用,基于mRNA的基因递送以快速产生循环sACE2衰变等等。
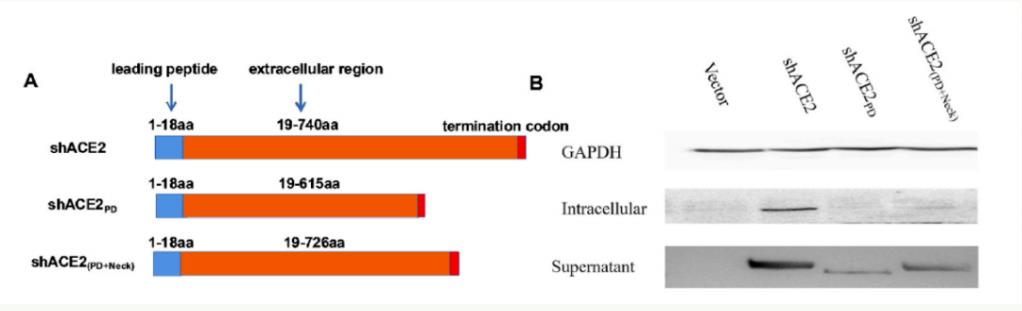
截短shACE2及其表达
由此可见,以sACE2为基础的新型药物对控制SARS-CoV-2感染激增具有重要意义。在这项最新研究中,研究团队使用基于AAVrh10的AAV递送载体来表达不同形式的sACE2,作为一种对抗SARS-CoV-2突变株感染的新策略。
腺相关病毒(AAV)由于其临床安全性、感染宿主范围广且可选择的组织特异性、高水平和长时表达、低免疫原性等优势,已被广泛应用于基因治疗的递送。值得注意的是,AAVrh10是一种具有肺组织趋向性的AAV血清型,已有研究表明,全身注射AAVrh10可以高效地在肺部特异性表达目的基因。
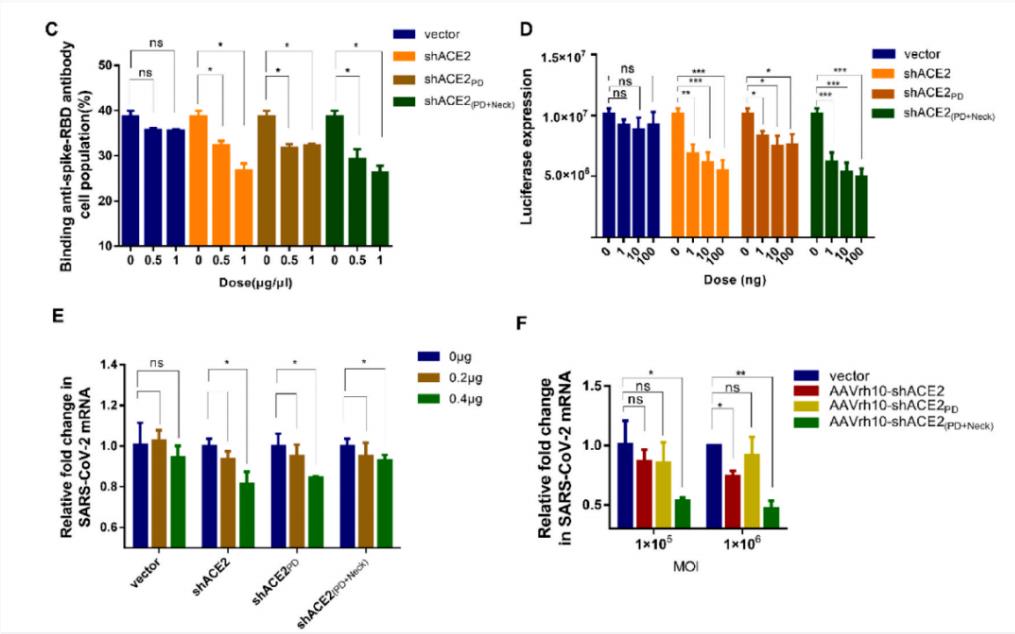
AAVrh10装载截短体shACE2,有效阻断SARS-CoV-2感染
为了进一步优化最小化的ACE2功能域候选序列,研究团队进行了综合分析,以阐明不同物种的ACE2同源序列与SARS-CoV-2 刺突蛋白(S蛋白)受体结合域(RBD)之间的相互作用。
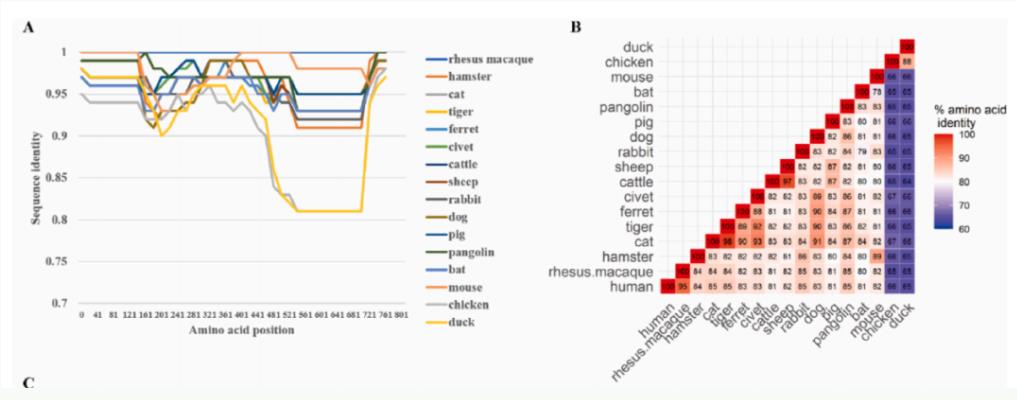
ACE2同源物的保守性分析
研究团队以关键的界面氨基酸为基础,设计了一系列截短的ACE2同源蛋白,并评估了它们与SARS-CoV-2突变株的RBD结构域的潜在亲和性。此外,研究团队还通过去除对血管紧张素底物的催化活性域来降低潜在的副作用。
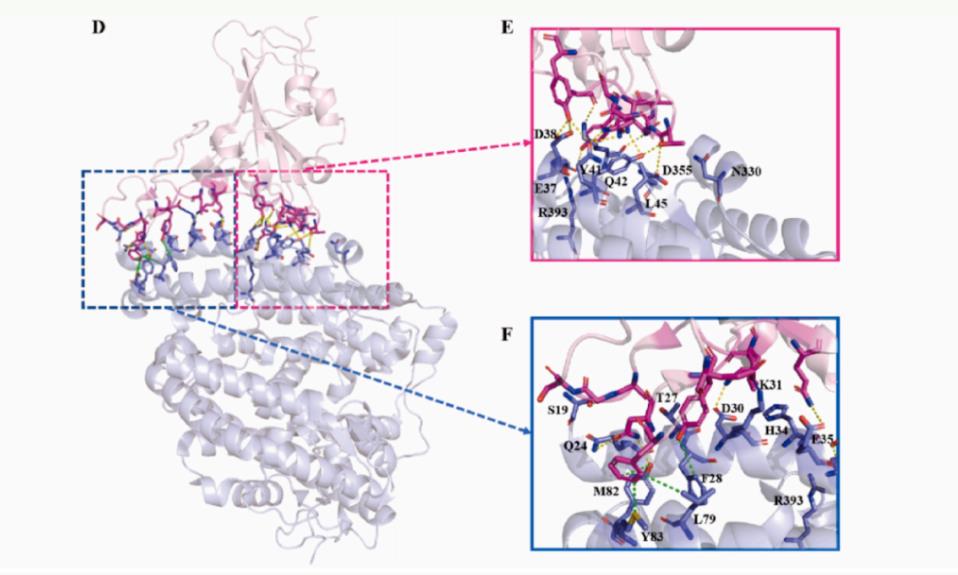
ACE2与SARS-CoV-2 RBD界面之间的关键分子间相互作用
有趣的是,在筛选过程中,研究团队意外地发现,狗ACE2的24-83aa片段(dACE224-83)与SARS-CoV-2突变株的RBD亲和力高于人源ACE2。更重要的是,以AAVrh10为载体的shACE2或dACE224-83构建体在体外和体内均表现出对SARS-CoV-2原始病毒株和突变株广泛的阻断效果。
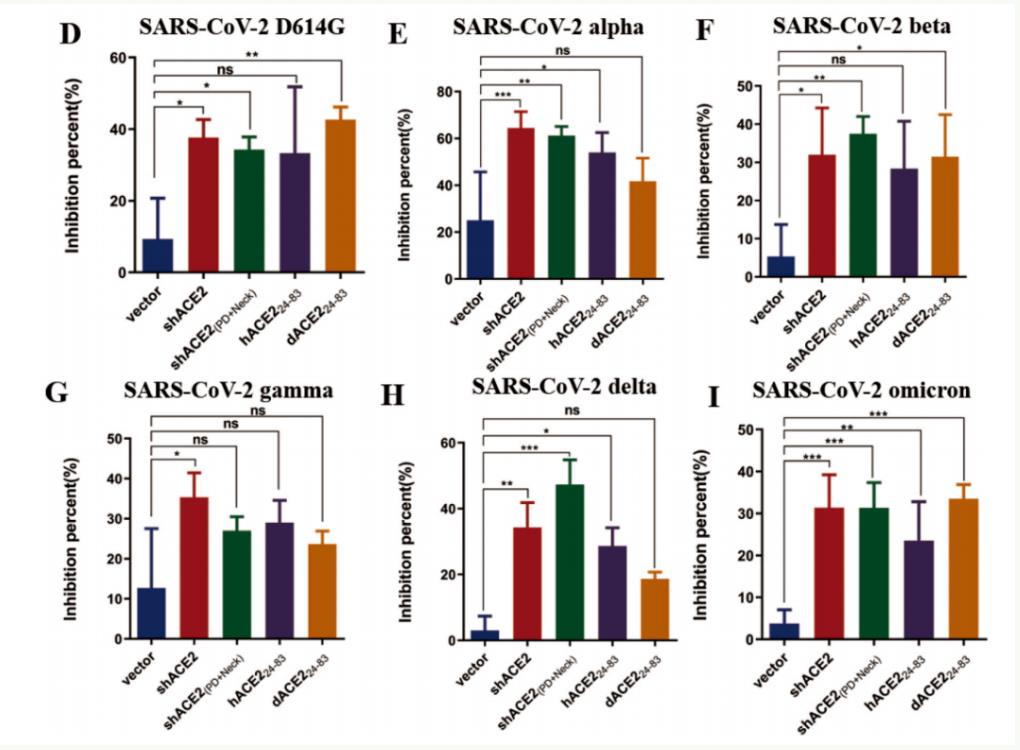
AAVrh10递送的ACE2功能域广泛阻断了SARS-CoV-2原始病毒株和突变株的入侵
总而言之,这项研究表明,以ACE2为基础并联合肺靶向递送载体AAVrh10的新型阻断剂是一种十分有前景、可防治SARS-CoV-2突变株的策略。此外,这也提示我们,不仅仅是人源ACE2,其他动物的ACE2截短体也许可以更好地阻断新冠变异株感染。
参考资料:
https://www.sciencedirect.com/science/article/pii/S0166354222001528?via%3Dihub
