2023年10月23日,北京大学魏文胜和博雅基因袁鹏飞共同通讯在Genome Biology 在线发表题为“Utilizing AAV-mediated LEAPER 2.0 for programmable RNA editing in non-human primates and nonsense mutation correction in humanized Hurler syndrome mice”的研究论文,该研究展示了通过AAV介导的环状ADAR招募的RNA(arRNAs)递送在适用于治疗的剂量下,可以在灵长类非人灵长动物中实现有效的RNA编辑。
在感染后的4至13周内,AAV感染的细胞中的编辑效率可以达到约80%,即使在高剂量下也没有明显的毒性。此外,当AAV传递的循环arRNAs被系统地用于Hurler综合症人源化小鼠模型时,它能够精确纠正早期终止密码子,并在多个器官中恢复由Hurler致病基因编码的IDUA酶的功能。
腺相关病毒介导的cDNA疗法具有巨大潜力,但外源基因的过度表达或高剂量AAV治疗可能导致毒性。虽然通过基因编辑酶可以直接修复导致疾病的突变,但这些酶的异位表达通常伴随着一系列问题,包括全基因组DNA和/或RNA转录物的大范围非特定靶向、免疫原性、致癌性,以及由于载体大小而产生的传递障碍。因此,利用内在机制修复突变基因对基因治疗而言是一种引人注目的替代选择。
可编程的腺嘌呤(A)到鸟嘌呤(G)编辑理论上可以治疗几乎一半由单核苷酸多态性(SNP)引起的遗传疾病,包括导致早期终止密码子或剪接位点突变的疾病。作为一种重要的转录后修饰,腺苷脱氨酶(ADAR)介导的RNA编辑广泛发生在真核细胞中。在这个过程中,腺嘌呤被脱氨化成肌醇,随后在剪接或翻译机制中被解释为鸟嘌呤,从而促进了遗传密码的改变。已经开发了几种依赖于ADAR的RNA碱基编辑工具。值得注意的是,招募和利用内源ADAR的技术在治疗应用中尤其有前景,因为它们易于传递并具有安全性优势,因为它们在整个转录组中的非特异性靶向效应很小。
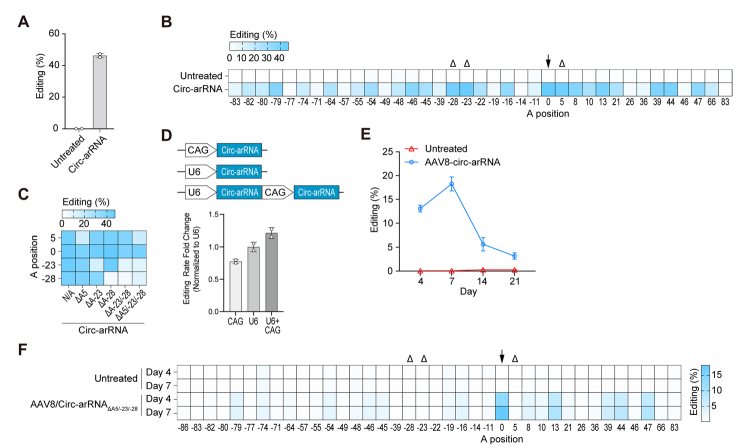
用于非人灵长类动物的arRNA优化
(图片源自Genome Biology )
研究人员先前开发了一种名为LEAPER(利用内源ADAR进行可编程RNA编辑)的可编程RNA编辑技术,并最近将其升级为LEAPER 2.0.具有更高的效率和特异性。LEAPER 2.0技术利用细胞中存在的内源ADAR蛋白质来实现熟练和精确的RNA编辑。在小鼠模型中,作者已经证明了通过LEAPER 2.0进行的AAV介导的RNA编辑对于疾病治疗是可行的。然而,LEAPER 2.0的实用性仍需在更接近人类的模型中进行评估,如灵长类非人灵长动物或人类转录物,因为不同器官和物种内在ADAR的活性变化较大。
鉴于体内RNA编辑通常需要使用相对高剂量的AAV或寡核苷酸,因此至关重要的是要验证AAV介导的LEAPER 2.0是否能在临床可接受的剂量下在灵长类非人灵长动物中产生治疗效果。该研究进一步优化LEAPER 2.0系统,以确保通过AAV传递以临床合理的剂量在灵长类非人灵长动物和人源化小鼠中实现强大的RNA编辑。
资料来源
1.公众号iNature
https://mp.weixin.qq.com/s/0tIaqXS9ouZmHv7P282raw
