客户文献解读
4月16日,Nature Genetics 杂志(IF=30.8)刊登关于哺乳动物肝脏高精度时空图谱的研究论文,揭示了小鼠肝脏稳态的空间分子特征,以及肝部分切除与再生过程中的复杂分子机制,确定了转录辅助因子TBL1XR1 作为一个炎症诱导的调节器,促进肝细胞增殖。该研究的数据有望为肝脏疾病治疗、肝脏再生与移植提供新的思路和策略。

这项研究由杭州华大生命科学研究院主导,吉林大学、哥本哈根大学、泰国朱拉隆功大学和中国科学院广州生物医药与健康研究院等多家单位科研团队共同参与。许江山、郭鹏程、郝世杰、上官顺成、石泉和Giacomo Volpe为该研究的共同第一作者,Miguel A. Esteban、赖毅维、陈奥、刘龙奇、徐讯和郭鹏程为共同通讯作者。派真生物为本研究提供了基因敲低AAV,用于研究TBL1XR1在肝脏稳态和再生过程中的功能。
研究亮点
生成了一个全面的哺乳动物肝脏稳态和再生的时空图谱,该图谱构成了一个大规模的资源库,可用于支撑进一步的功能验证。
发现TBL1XR1作为一个炎症诱导的调节器,促进了肝细胞的增殖。对TBL1XR1进行操控,可能为临床应用中调节受损肝脏再生提供治疗可能性。
研究背景
在过度熬夜、吸烟喝酒、高糖高盐饮食等不良习惯日渐常态化的现代生活中,肝硬化、肝炎和肝癌等肝脏疾病也呈现出日益严峻的态势。作为人体的“化工厂”,肝脏除了解毒功能外,还负责代谢、合成、消化、免疫反应等多种生理功能,并且,其功能分布就像公司里的各个职能部门,坐落在不同的空间位置上,负责着不同的任务。也因此,肝病的发展往往表现出空间异质性,肝脏损伤后的再生模式也与其空间位置高度相关。在空间维度上解析控制肝细胞损伤与再生的机制,对于阐明肝脏疾病恶性转化和再生医学具有重要意义。
哺乳动物的肝脏是由肝小叶组成的,成人的肝脏包含50万到100万个肝小叶。在每个肝小叶中,血液从门脉区流向中央静脉区,其营养物质、激素、细胞、生长因子等呈现梯度变化,导致肝小叶不同空间位置上的细胞具有不同的生物学功能。
研究思路
这篇文章的研究思路是通过结合先进的空间转录组学技术和单细胞转录组学分析,来深入理解哺乳动物肝脏在稳态和再生过程中的时空动态变化。具体的研究思路可以概括为以下几个步骤:

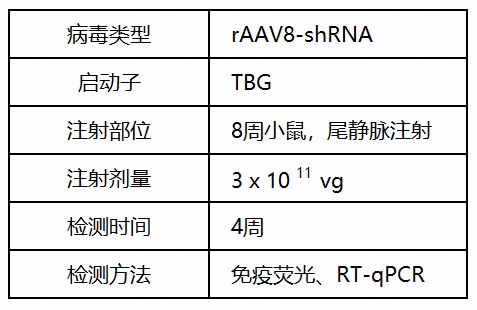
TBL1XR1基因功能研究中用到的派真AAV产品:
研究结果
1. 小鼠肝脏的时空图谱
为了捕获所有主要的肝脏驻留细胞类型,将Stereo-seq应用于小鼠部分肝切除(PHx)模型,收集了不同时期的30个整肝叶切片,进行了匹配的单细胞RNA测序(scRNA-seq),共得到435.413个细胞,还检索了先前报道的非实质细胞(NPC)scRNA-seq数据集,生成了包含51.275个细胞的更广泛的肝脏稳态细胞矩阵。
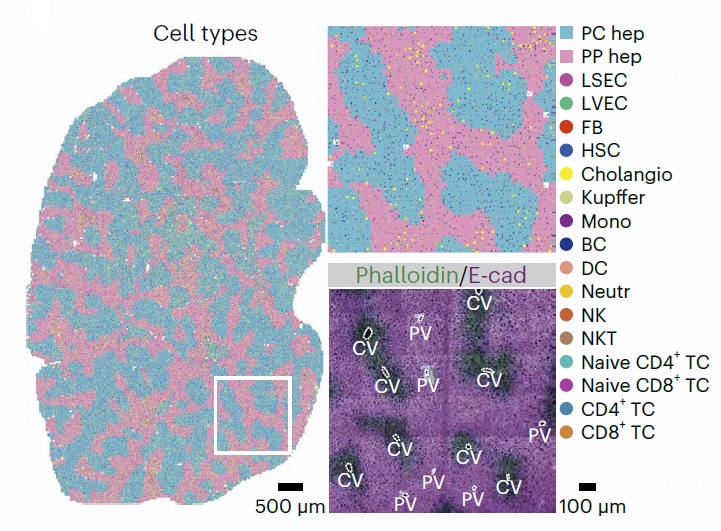
图1 稳态肝脏的细胞类型分布(D0-DY1节段)。右上图,放大所示区域。右下图,相邻切片中肌动蛋白和E-钙粘蛋白(E-cad)的代表性免疫荧光染色
2. 稳态肝细胞中的区域化基因
有8.127个基因(Q值<0.05)在区域化层间显示非随机空间分布,2.456个基因为肝细胞特异性基因(log2(倍数变化)>0.25)。乙型肝炎病毒结合受体Slc10a1(NTCP)在周围中心区域富集;未折叠蛋白反应调节因子Xbp1在周围门静脉区域的富集;T3甲状腺激素受体Thrb和EGFR配体Fgl1(hepassocin)在中区的富集。
共识别了307个调控子,其中172个位于肝细胞中,包括与代谢活动相关的周围中心和周围门静脉区域富集的调控子,TBL1XR1和CEBPA等中区富集调控子。
3. 稳态非实质细胞(NPCs)中的区域化基因和非区域化结构
在肝窦内皮细胞(LSECs)特异性基因中,有132个(约20.8%)与之前报道的结果一致,包括Wnt2、Dll4和Lyve1等,此外还识别了Tie2(Tek)和转录因子Gata4等之前未报道过的基因。功能分析识别了神经生长因子与VEGF和VEGFR通路的相互作用,Notch信号通路调控等区域化通路。
肝星状细胞(HSCs)区域化基因分析显示有54个先前研究中报道过的基因和1.104个未知基因。功能分析识别了BMP和Wnt信号通路等区域化通路。
作者还发现了富含IFNγ反应基因(Rsad2)的非区域化的稀疏斑点状结构,这些微结构内部有效应T细胞和过渡单核细胞的富集。
4. 稳态中的区域化细胞-细胞通信网络
作者观察到了与Wnt相关的周围中心区域和与Notch相关的周围门静脉区域等已知的区域化相互作用。在未知的区域化相互作用中,作者检测到了涉及周围门静脉区域的非典型Wnt因子WNT4和WNT5B的相互作用,Egfl7与周围中心区域的LSECs中的Notch1相互作用。在Kupffer细胞中,Bmp10与Acvrl1(ALK1)之间的相互作用在中区富集,Bmp4与Bmpr1a之间的相互作用在周围中心区域和周围门静脉区域富集,Fgf1/2/21与Fgfr1之间的相互作用在周围门静脉区域的肝细胞中更为富集。
在围绕门静脉的免疫细胞中,作者发现了涉及趋化活性的新相互作用,多种趋化因子与在肝窦内皮细胞(LSECs)和肝星状细胞(HSCs)中表达的非典型趋化因子受体之间的相互作用,以及免疫斑点基因Cxcl10与多种免疫细胞类型表达的Cxcr3/4和Tlr4相互作用。
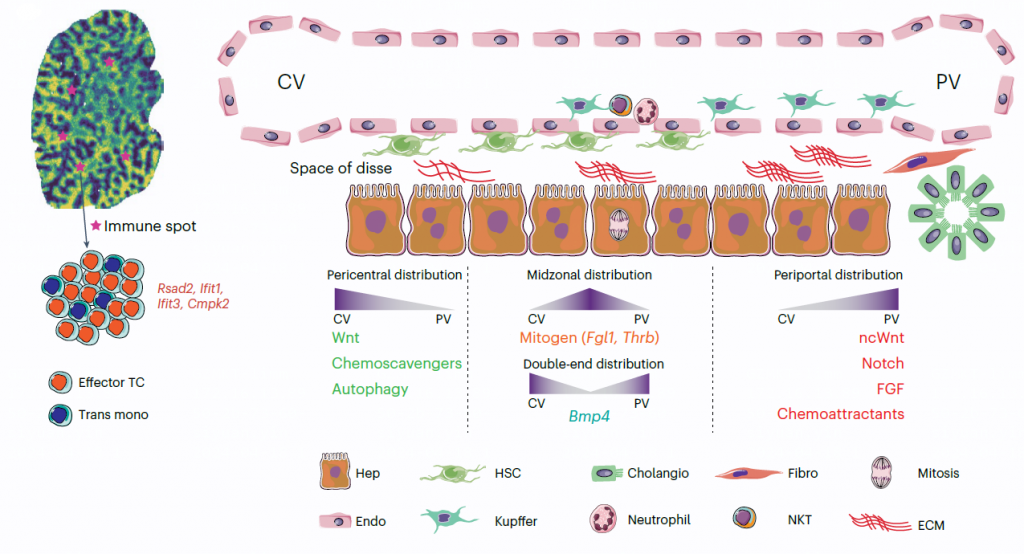
图2 稳态肝脏的分子事件示意图
5. 再生过程中的细胞增殖动力学
肝细胞是从中区层开始的,细胞数量在D2时显著增加,然后逐渐下降。肝窦内皮细胞(LSEC)的增殖在D2出现,并在D3达到高峰。免疫细胞的增殖水平低。
6. 再生过程中的区域化转录组响应
功能富集显示了两波主要的代谢基因调节,第一波是与身体稳态相关的基因减少,始于8小时,并从D3到D7部分恢复。第二波基因与能量生产有关,这些基因在8小时部分减少,并从D1开始激活。其他增加的基因聚类包括启动、早期增殖和晚期增殖基因。
在LSECs中,8小时时被抑制的基因主要与适应性免疫反应和趋化作用有关,这可能有助于防止免疫细胞过度激活。增加的基因包含与Wnt信号(Wnt2)和EGFR信号(Hbegf)有关的基因。
在HSCs中,被抑制的基因包含细胞外基质相关基因和IFNγ反应基因;在8小时或D2增加的基因包含MET/PI3K/AKT信号(Hgf)基因。
7. 再生过程中的细胞间相互作用动态
作者共识别了1.487个相互作用,其中75%是区域化的。8小时时增加的相互作用主要与免疫细胞有关。
由LSECs和HSCs及其相应的受体贡献相互作用,如周围中心区域的Wnt2、Wnt9b和Rspo3等,达到了门静脉区域。非典型Wnt4和Wnt5a与其受体的相互作用主要在D1时增加,分别在门静脉区域和周围中心区域占主导地位。其他相互作用涉及有丝分裂过程,如IL6、EGF、FGF、HGF和Hedgehog,以及抗有丝分裂信号,如BMP-BMPR1A轴、activin和IL1.
在LSECs的传入信号中,Mif和Cxcl12(编码SDF-1)与Ackr3(编码CXCR7)的相互作用增强,横跨整个小叶,但在周围中心区域更为明显。Dll4-Notch相互作用在8小时减少,并从D3稳步恢复,而Egfl7-Notch1从D2开始增加,特别是在周围中心和中区区域。肝细胞表达的Lect2与血管生成素受体Tie1的相互作用从D1开始增加,并在周围中心区域占主导地位。血管生成相互作用(Angpt2/4-Tek,Vegfa/c-Kdr)在D3和D7时增加。
大多数与趋化因子相关的相互作用在再生期间减少,但在终止阶段恢复。
8. 再生过程中的时空基因调控网络(GRNs)
在8小时时伴随着转录变化出现了显著的调控子变化,下调的调控子包括CEBPA,以及几个代谢调控子(HLF),上调的调控子包括SOX5、ZEB1、RREB1以及参与修复性炎症反应的转录因子EGR1、JUN和TBL1XR1等。这些调控子在所有区域都有所富集,适度偏向于周围中心区域。在D1和D2.与Wnt相关的调控子在整个小叶中上调,具有中区的主导地位。在D2.几乎所有富集的调控子都与有丝分裂有关。在D7.代谢调控子恢复到接近稳态水平。
9. TBL1XR1调节肝脏再生
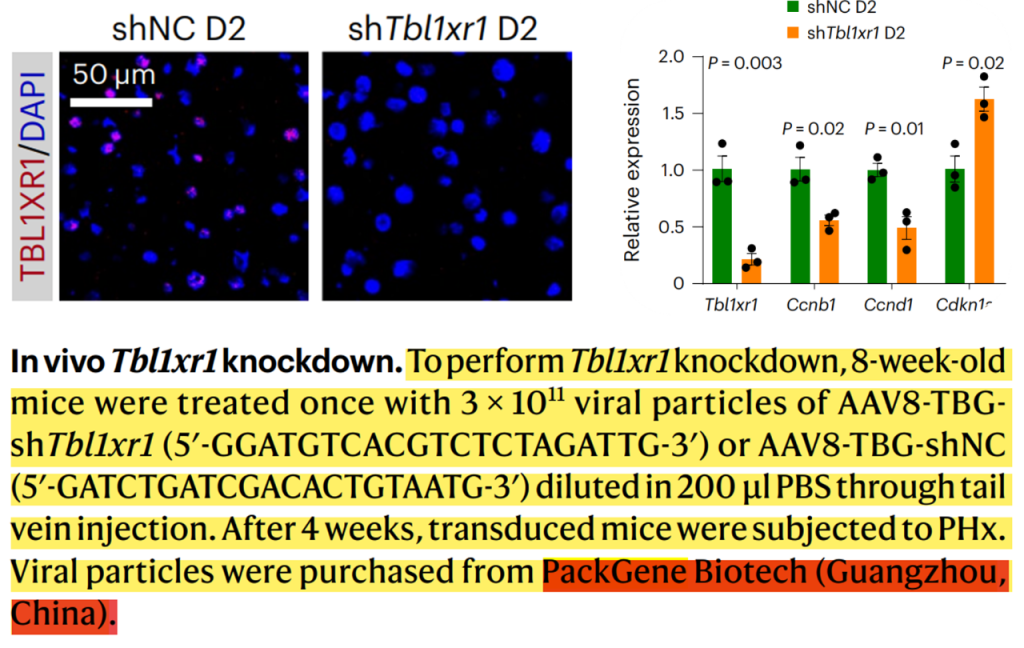
使用靶向肝细胞的AAV在小鼠体内对TBL1XR1进行敲低,感染后4周,免疫荧光和RT-qPCR显示了高效的Tbl1xr1敲低,Tbl1xr1敲低组(20.9%)中增值的肝细胞数比对照组低,而肝细胞的大小增大,且在Tbl1xr1敲低后总肝脏质量适度增加,表明有补偿性肥大。Tbl1xr1敲低导致了细胞周期和Wnt信号通路基因减少,还损害了脂肪酸β-氧化。
TBL1XR1和β-连环蛋白在关键位点协同结合,通过去除NCoR共抑制复合物和促进组蛋白乙酰化,促进肝细胞增殖程序的激活。
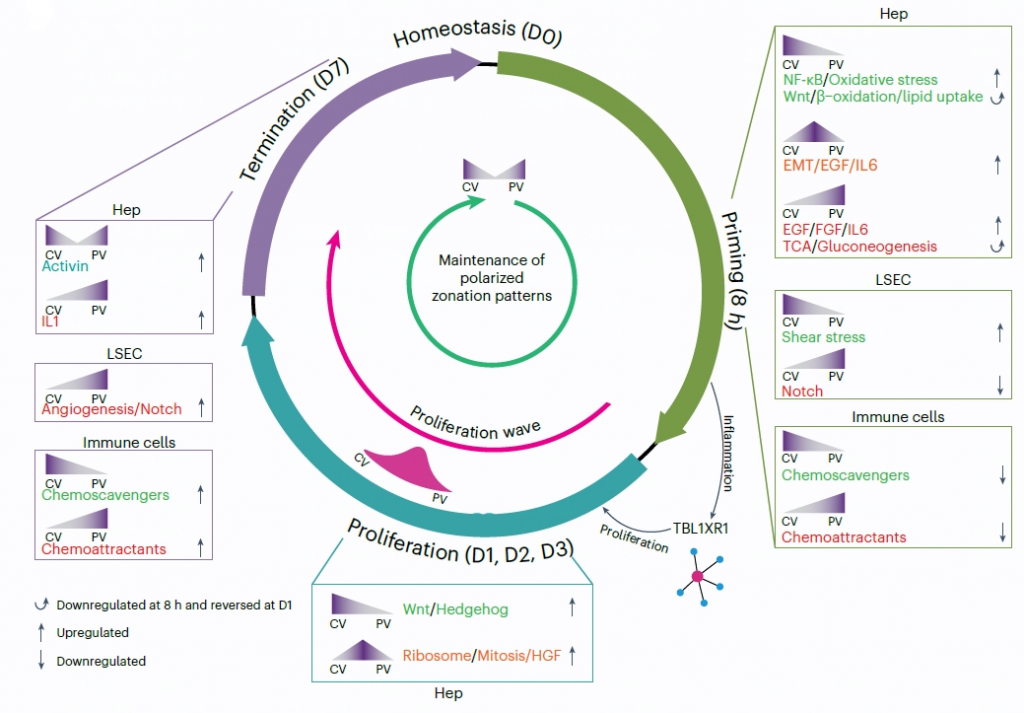
图3 部分肝切除(PHx)后再生肝脏中特定分子事件的动态示意图
结 论
1. 生成了一个全面的哺乳动物肝脏稳态和再生的时空图谱,这个图谱构成了一个大规模的资源库,可用于生成假设并进一步进行功能验证;
2. 鉴定了数千个以前未被注意到的区域化基因,还提出了可能的模型来解释它们是如何被调控的;
3.识别了以前未被注意到的可能介导免疫区域化的相互作用,并描述了免疫斑点的存在;
4. 剖析了肝细胞和非实质细胞(NPCs)在肝脏再生过程中的时空反应;
5. TBL1XR1作为一个炎症诱导的调节器,促进了肝细胞的增殖。TBL1XR1可能是肝脏再生治疗的靶点。
参考资料:
1. https://doi.org/10.1038/s41588-024-01709-7
2. https://mp.weixin.qq.com/s/j6vrrqRkNBusxmusGrbGGw
