四组分脂质纳米颗粒(LNPs)已被广泛应用于上市COVID-19 mRNA疫苗和大量mRNA疗法的临床试验中,证明了它们在将mRNA传递到肝脏和肌肉方面的有效性。mRNA药物的肝外靶向分布对于治疗影响非肝器官的多种疾病具有巨大的意义,特别是靶向脾脏和T细胞的特异性mRNA递送为癌症免疫治疗和诱导抗病毒免疫反应提供了一个引人注目的选择。
尽管如此,将mRNA靶向递送至肝外组织在很大程度上仍是限制其应用开发的重要挑战。目前的脾靶向技术往往以转染效率或疗效降低为代价,导致使用新型递送载体时,脾中的mRNA整体表达量仍低于肝脏。
2024年4月18日,来自浙江大学药学院的刘帅课题组在Angewandte Chemie International Edition上发表了题为“One-Component Cationic Lipids for Systemic mRNA Delivery to Splenic T Cells”的研究论文。本研究提出,富含仲胺的阳离子脂质可以作为独立的单一组分载体在体外和体内有效地递送mRNA。此外,这些载体有助于在静脉给药后有效地将mRNA递送至脾脏T细胞亚群,显示出免疫治疗应用的巨大潜力。这种简单的策略扩展了脂质体在肝外mRNA递送中的效用,为LNP以外的载体开发提供了新的见解,以进一步推动精准mRNA治疗领域的发展。

单组份可电离阳离子脂质载体设计
作为大多数四组分LNP载体的重要组成部分,已有大量研究设计了多种含叔胺的阳离子脂质(An-R-T),通常通过胺基和环氧类似物或丙烯酸酯合成。仔细控制环氧开环和Michael加成起始材料的反应温度和摩尔比,即可得到富含仲胺基的阳离子脂质(An-R-S)(图1B、1C),并采用这一设计的可电离阳离子脂质作为单组分载体制备阳离子脂质/mRNA纳米颗粒(CLNs)。
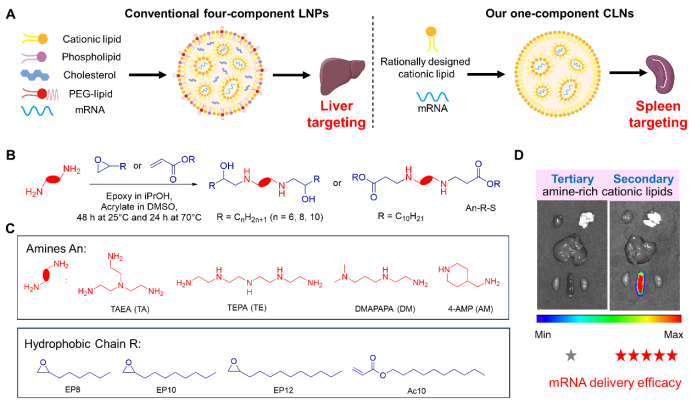
图1. 单组分阳离子脂质载体的设计合成
体外筛选实验显示,富仲胺可电离子阳离子脂质(AnEP-S和An-Ac-S)介导了强大的mRNA表达和最小的细胞毒性,最佳候选药物表现出比叔胺脂质(An-EP-T和An-Ac-T)高4个数量级的递送效率。与ALC-0315 LNPs相比,效率最佳的TE-EP10-S CLNs显示了43倍增强。
仲胺脂质CLNs的表征和验证
在mRNA的结合/包封上,叔胺脂质体仅显示出低于60%的低mRNA结合率,而单一仲胺脂质的mRNA结合率达到了95%(图2D)。移液器制备CLN的尺寸相对较大,依靠微流控设备可有效减小粒径,最佳尺寸维持在100 nm左右。由于An-R-S脂质富含仲胺基和疏水尾部,对mRNA静电作用和疏水作用保证了CLNs的稳定性,即使在4℃的10%胎牛血清(FBS)血清中孵育7天后,这一设计下的CLNs仍保持稳定(图2E)。
通过红细胞破裂测定溶血和通过荧光共振能量转移(FRET)分析的脂质融合分析,显示两种富胺脂质之间的内体逃逸没有明显差异(图2G)。共聚焦荧光成像证实了优化后的仲胺CLNs从内体中有效逃逸(图2H)。相反,叔胺对应载体由于细胞摄取较低介导了有限的内体逃逸。这些结果突出了单组分可电离阳离子脂质在克服多种递送障碍方面所取得的突破。此外,基于仲胺的CLN由于增强了mRNA结合和细胞摄取而优于叔胺。
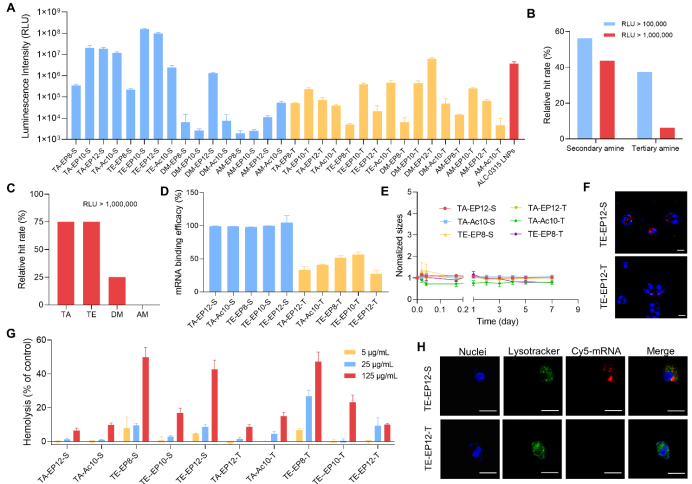
图2. 单组分阳离子脂质CLN的构效及理化性质分析
靶向验证
研究在C57BL/6小鼠中,通过静脉注射0.25 mg/kg的剂量,进一步评估了CLNs的器官靶向性(图3A)。与主要靶向肝脏的LNPs不同,单组分可电离阳离子脂质主要介导靶向脾脏的mRNA表达。
TE-EP8-S具有两个疏水尾部和五个仲胺基,所得的CLNs在脾脏中获得了最高的mRNA表达(图3B)。其介导的荧光素酶表达在脾脏中高出几个数量级,并呈剂量依赖性增加。
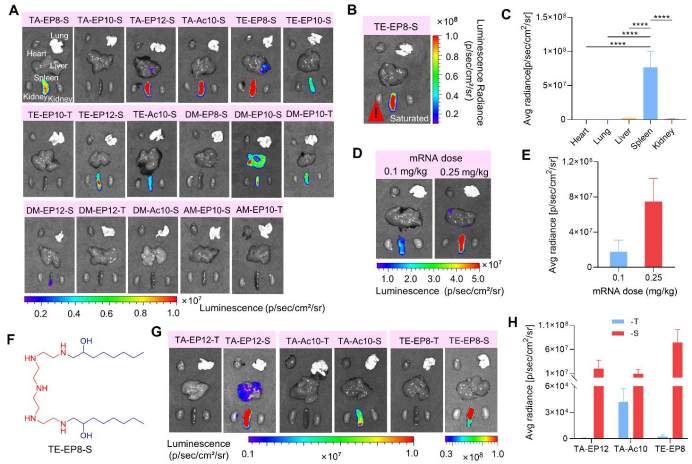
图3. 单组分CLNs的体内mRNA递送
引入loxp-Cre重组系统的Ai9小鼠模型可以在Cre重组蛋白存在的情况下诱导tdTomato的表达来删除转录终止信号盒(stop cassettes)。实验表明,装载Cre mRNA的TE-EP8-S CLNs有效地促进了脾脏中的蛋白表达,在静脉注射给药后,近6%的T细胞被转染(图4B,C)。
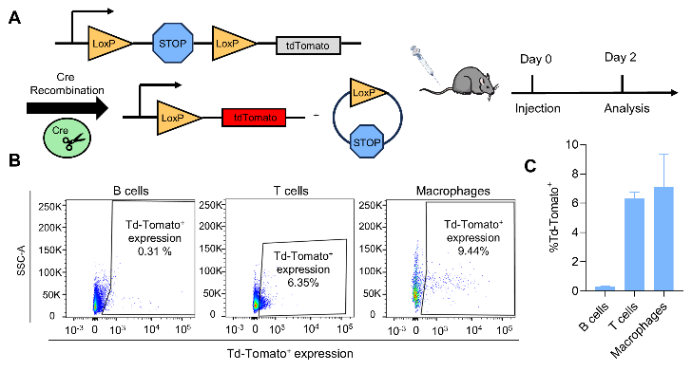
图4. TE-EP8-Scln介导脾脏T细胞mRNA翻译
总结
本研究提出的单一组分阳离子脂质直接用于载体构建,为mRNA药物提供了另一种递送选择,并存在将mRNA递送到肝外组织的潜力。本文提出的基于仲胺的单组分载体方法可以扩展到广泛的阳离子脂质和聚合物载体,为进一步发展mRNA传递技术和应用开启了新的研究方向。
参考资料
[1]Zhang X, Su K, Wu S, Lin L, He S, Yan X, Shi L, Liu S. One-Component Cationic Lipids for Systemic mRNA Delivery to Splenic T Cells. Angew Chem Int Ed Engl. 2024 Apr 18:e202405444. doi: 10.1002/anie.202405444.
[2]文章来源于RNAScript:https://mp.weixin.qq.com/s/UYj4dtT16LrgMPkYT_GTrA
