CRISPR基因编辑技术极大地加速了遗传疾病治疗方法的开发。然而,临床的进一步发展在很大程度上取决于开发多样化工具以应对基因组编辑的挑战。其中,最关键的一个方面是递送,因为Cas核酸酶及其衍生的融合产物(包括碱基编辑器、先导编辑器)的尺寸较大。
腺相关病毒(AAV)是最高效和最广泛使用的体内递送载体,但其载体容纳量仅为4.7 kb,导致其很难与CRISPR系统兼容,最常用的来自化脓性链球菌的SpCas9及其sgRNA和必要的调控区域就无法被单个AAV所装载。一些小型化Cas9核酸酶,例如来自金黄色葡萄球菌的SaCas9和脑膜炎奈瑟菌的Nme2Cas9可以被单个AAV递送,但它们基因编辑效率低于SpCas9.总之,在原核生物(细菌、古菌)中广泛存在的CRISPR-Cas系统的多样性尚未被充分开发。
通过宏基因组测序和宏基因组组装基因组(MAG)重建,已经鉴定了大量的未表征的原核生物物种,其中许多编码系统发育多样性的Cas9同源物。大多数质量控制的MAG具有足够高的质量,能够对整个Cas9基因座进行全序列表征,而这种揭示出的多样性有可能为发现具有理想特性的核酸酶提供可能性,以应对治疗应用中的复杂性。
近日,意大利特伦托大学的研究人员在 Nature Communications 期刊发表了题为:CoCas9 is a compact nuclease from the human microbiome for efficient and precise genome editing 的研究论文。
该研究从人类肠道微生物组中发现了一种来自科林斯属(Collinsella)肠道细菌的Cas9核酸酶——CoCas9,其具有高效和精准基因编辑特性,脱靶性远低于spCas9.更重要的是,CoCas9尺寸较小,仅1004个氨基酸,可与其sgRNA一起包装在AAV载体中,用于体内递送。此外,CoCas9还可与脱氨酶融合,用于碱基编辑。
该研究在人类原代细胞和人源化小鼠模型中进一步验证了CoCas9的高效和精准基因编辑特性,展示了CoCas9的临床开发潜力。

在这项研究中,研究团队在一个大型数据库中搜索了未被描述的小型Cas9变体,该数据库由>154000个微生物基因组组成,这些基因组由>9400个人类相关宏基因组重建而来,其中包括超过3000种以前未被表征的细菌物种。
该研究从中发现了大量II型CRISPR-Cas基因座(n=17173),其中,一种来自未被表征的科林斯属(Collinsella)肠道细菌的Cas9核酸酶——CoCas9,其具有高效和精准基因编辑特性,脱靶性远低于spCas9.更重要的是,CoCas9尺寸较小,仅1004个氨基酸,可与其sgRNA一起包装在AAV载体中,用于体内递送。此外,CoCas9还可与脱氨酶融合,用于碱基编辑。

为了评估CoCas9的治疗应用潜力,研究团队在人原代细胞中测试了其编辑活性,用慢病毒载体向人类造血干/祖细胞(HSPC)、人支气管上皮细胞(HBE)和人皮肤成纤维细胞(HSF)递送CoCas9系统,并在嘌呤霉素抗性筛选后,在6个位点均显示出高基因编辑活性。
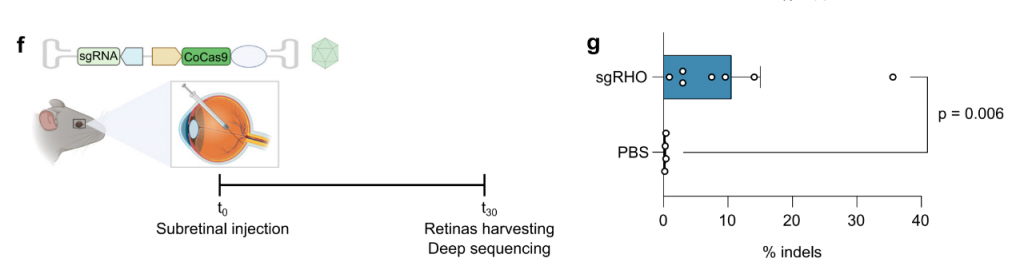
接下来,研究团队评估了CoCas9在小鼠模型中的表现。在表达人RHO基因(hRHO)的人源化小鼠模型中,研究团队向5周龄的小鼠视网膜下注射AAV8共递送的CoCas9及其sgRNA,以靶向编辑hRHO基因,该基因突变会导致常染色体显性遗传性视网膜色素变性。结果显示,注射4周后,在hRHO目标处实现了最高达到35.6%的编辑效率,在7只视网膜中的平均编辑效率为10.5%。
该研究发现了一系列之前未被表征的Cas9核酸酶,尤其是CoCas9.丰富了基因组编辑工具箱。在人类原代细胞和人源化小鼠模型中实验表明,CoCas9具有临床开发潜力。
论文链接:
https://www.nature.com/articles/s41467-024-47800-9
