听力损失是常见的感官障碍之一,尤其在新生儿中。遗传因素导致的听力损失占比高达60%。目前尚无有效的方法可以恢复遗传性听力损失患者的自然听觉感知。近年来AAV基因疗法在治疗遗传性耳聋方面展现了巨大的潜力。然而,先前的AAV基因治疗研究大多集中于特定内耳细胞类型(尤其是毛细胞)中的基因,如Otof、Tmc1、Strc和Kcne1基因等,而对广泛表达于多种内耳细胞的耳聋基因关注较少。
髓鞘蛋白P0样蛋白2(Myelin protein zero-like 2)是由MPZL2基因编码的一种细胞黏附分子,广泛表达于耳蜗细胞中,包括Deiters细胞(DC)、内毛细胞(IHC)、外毛细胞(OHC)和血管纹(SV)等。MPZL2基因突变可导致常染色体隐性非综合征型耳聋(DFNB111),是轻至中度遗传性耳聋的第二大致病因素,因此对MPZL2相关的听力损失进行基因治疗具有重要意义。
近日,复旦大学附属眼耳鼻喉科医院舒易来、何英姿团队在 The American Journal of Human Genetics 杂志(IF=8.7)上发表了题为“Hearing restoration by gene replacement therapy for a multisite-expressed gene in a mouse model of human DFNB111 deafness”的研究论文,探索了AAV基因治疗Mpzl2相关听力损失的可能性。

研究团队首先通过CRISPR-Cas9技术生成Mpzl2基因敲除小鼠,这些小鼠表现出缓慢进展的听力损失,模拟了DFNB111型听力损失的表型。接着使用AAV-ie载体系统递送MPZL2基因,注射到小鼠耳蜗,测量注射前后小鼠的听觉脑干反应(ABR)和畸变产物耳声发射(DPOAE)阈值变化,并通过免疫荧光染色观察耳蜗细胞的结构变化,评估OHCs和DCs的存活率与结构完整性(图1)。
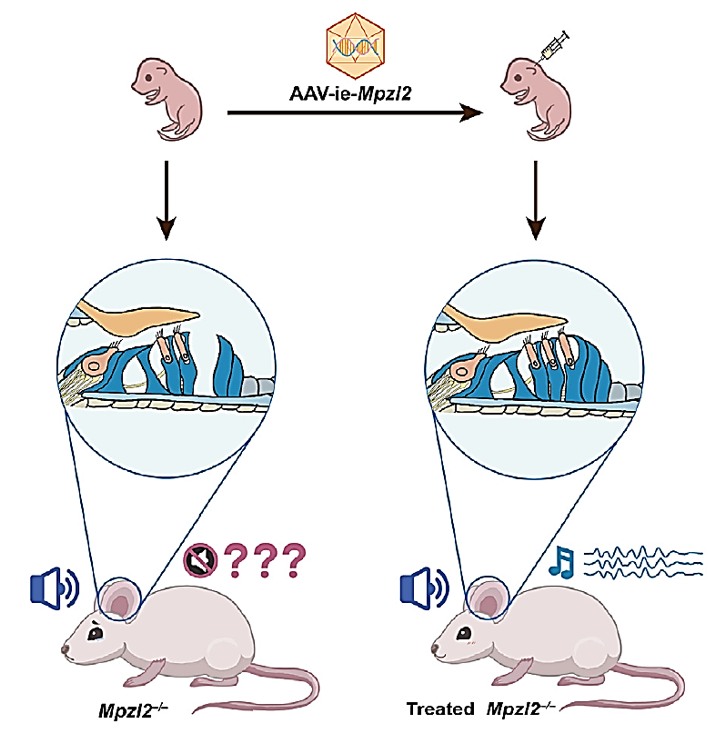
听觉功能的显著恢复
AAV-ie-Mpzl2给药后,Mpzl2基因敲除小鼠的听觉功能得到显著改善。ABR和DPOAE测试显示,这些小鼠的听觉阈值在注射后至少7个月内持续降低,特别是在高频率范围内(16 kHz及以上)的改善最为明显。
耳蜗细胞结构完整性恢复,存活率提高
AAV-ie系统能够高效地转导不同类型的耳蜗细胞。注射AAV-ie-Mpzl2后,小鼠耳蜗中的OHCs和DCs的存活率显著提高,并恢复了细胞的结构完整性。
长期效果和安全性
AAV-ie-Mpzl2治疗的效果可维持至少7个月,并且未发现任何显著的副作用或组织损伤。这表明AAV-ie-Mpzl2具有良好的有效性和安全性。
总之,这项研究首次证明了AAV-ie-Mpzl2能有效恢复DFNB111型耳聋小鼠模型的听觉功能。研究结果为未来的遗传性耳聋基因治疗,尤其是针对多细胞类型的基因突变提供了重要的实验基础。派真生物有幸为本研究提供了AAV病毒包装服务,助力遗传性耳聋基因治疗研究。
本篇文章AAV的导入方式:
| 实验动物 | P0-P2 Mpzl2-/-和 Mpzl2+/+小鼠 |
| 血清型 | AAV-ie |
| 启动子 | CMV |
| 注射方式 | 通过圆窗膜进行内耳注射 |
| 注射剂量 | 病毒滴度1 x 10^13 vg/mL,注射体积1~2 μL |
| 检测时间 | 感染后1周 |
