近日,顶级学术期刊《Immunity》发表了题为“Respiratory Virus Infections: Understanding COVID-19”的综述性文章,重点从SARS-Cov-2进入呼吸道后,如何激活机体的然免疫和适应性免疫,以及致病机制和抗病毒治疗方案等方面进行了综述。

呼吸道病毒的概念
从婴儿期到老年期,呼吸道病毒都严重威胁着人类健康,影响着我们的生活。呼吸道病毒感染可引起从普通感冒至重症肺炎等严重程度不同的疾病。 尽管不同的呼吸道病毒感染引起的疾病在临床体征以及病理特征上有很多相似之处,但在病程迁延时间,严重程度,传播特点等方面也有很多不一样的地方。
所谓呼吸道病毒即指一大类在感染人体后会引起呼吸道炎症的病毒,呼吸道病毒并不是病毒分类上的一个专业名称。在专业上分类上,呼吸道病毒有不同的名称和分类。比如引起流感的流感病毒属于正粘病毒科;引起普通感冒的副流感病毒属于副粘病毒科,同属于副粘病毒科的还有引起婴幼儿肺炎的最主要病原–呼吸道合胞病毒。造成世界范围内大流行的SARS-CoV2 在分类上属于正冠状病毒亚科的β属。冠状病毒亚科分为α、β、γ和δ四个属, 目前感染人类的冠状病毒共有七种, 除2003年发现的SRAS, 2012年发现的MERS, 2019年发现的 SARS-Cov-2外, 其余四种冠状病毒在人体中都只引起类似普通感冒的轻微症状 。
呼吸道病毒在感染人体后一般会导致呼吸道急性炎症。当病毒被吸入呼吸道或直接接触鼻子或眼睛粘膜, 就会造人类的感染。受感染的人通过咳嗽或打喷嚏,甚至安静的呼吸都可以向环境中释放病毒。病毒在咳嗽和打喷嚏时从呼吸道表面脱落, 随着打喷嚏和咳嗽时喷出的飞沫被释放到空气中。直径较大的含病毒飞沫, 在空气中漂浮较短的距离即会沉降到物体表面, 在病毒失活之前,当有人触摸受病毒污染的表面,然后触摸他们的鼻子眼睛或嘴巴时, 病毒就有可能感染人体。病毒如果以小液滴核(<5微米)的形式被排出体外,在空气中会长时间保持悬浮状态,并且可以被吸入下呼吸道。不同的尺寸的飞沫在病毒传播过程中发挥的作用是不同的,当然这在很大程度上也决定于病毒本身的生物学特征和感染机制。流感病毒通过接触以及空气传播,但是SARS-CoV-2的传播方式仍在讨论中。
有些病毒比其他病毒在环境中更易失活。例如呼吸道合胞病毒(RSV)是引起小儿病毒性肺炎最常见的病原,可引起间质性肺炎,及毛细支气管炎。 呼吸道合胞病毒(RSV), 无法在在环境中长期存活,而冠状病毒则要稳定得多。尽管目前还没有可以预防新型冠状病毒感染的疫苗,但我们可以通过采取适当措施来降低感染风险。WHO和CDC针对如何避免呼吸道病毒感染提供了以下标准预防措施建议:
- 经常使用肥皂和清水或者含酒精的洗手液洗手。
- 咳嗽或打喷嚏时用手肘或纸巾遮盖口鼻。
- 避免用脏手触摸眼睛和口鼻。
- 避免与任何病患发生密切接触。
- 患病期间避免与他人共用餐具、杯子、床上用品以及其他家居用品。
- 对经常触摸的表面进行清洁和消毒。
- 患病期间避免前往工作场所、学校以及公共场所。
此外, 根据所处环境的不同可以佩戴普通医用口罩或P2/N95口罩, 还可使用特殊的空气处理器, 对室内的空气进行消毒,都会降低病毒传播的风险。
病毒到达呼吸道黏膜时会发生什么?
呼吸道上皮由多种细胞组成,包括纤毛和非纤毛上皮细胞以及杯状细胞。杯状细胞(goblet cell),呈上大下小的形态,宛如高脚杯,故有此名。杯状细胞是一种单细胞腺,其主要功能是合成并分泌黏蛋白,形成黏膜屏障以保护呼吸道上皮细胞,。有些呼吸道病毒优先结合并感染纤毛上皮细胞, 有些则优先结合并感染非纤毛上皮细胞,肺泡内衬细胞和肺泡巨噬细胞。例如,禽流感病毒感染纤毛上皮细胞,而人流感病毒感染非纤毛上皮细胞。这主要由宿主细胞表面存在的特定分子决定的,这些分子就是病毒附着和侵入宿主细胞必需的受体蛋白。人体血管紧张素转换酶2(ACE2)是SARS-CoV和SARSCoV-2以及其它人类冠状病毒的受体。中东呼吸综合征冠状病毒(MERS)的受体是人二肽基肽酶4(DPP4)。所有流感病毒都使用唾液酸作为受体,但是人类流感病毒结合a-2,6 唾液酸受体,而禽流感病毒偏好结合a-2,3唾液酸受体。表达相关病毒受体的细胞在呼吸道中的分布或所处位置对于病毒感染后引起的临床症状至关重要。例如,如果表达病毒受体的细胞仅存在于上呼吸道,那么感染可能会局限为鼻炎(以流鼻涕和鼻塞为特征)或咽炎(喉咙痛)(图1)。相反,如果表达病毒受体的细胞主要在位于下呼吸道, 就会引起支气管炎。
附着到受体后,病毒下一步会脱掉包裹在基因组外面的核衣壳,释放出病毒基因组也即遗传物质RNA或 DNA, 进入细胞。需要指出的是,有些病毒只将遗传物质注入宿主细胞,有些病毒会将病毒粒子包含的某些蛋白释放到宿主细胞内。在宿主细胞内,大量合成子代病毒必须的核酸和蛋白。从病毒感染细胞到新的子代病毒的产生, 称为病毒的一个复制周期, 这一过程十分复杂, 并且不同的病毒会有不同的复制方式。流感病毒的复制完全在宿主细胞核内。冠状病毒的复制周期完全在细胞质中完成。
宿主感染后的临床表现
当人感染呼吸道病毒后,在临床症状出现之前有一个潜伏期。在潜伏期,病毒会在细胞内大量复制并释放子代病毒感染邻近细胞。流感的潜伏期很短,通常为1-2天,而SARS-CoV-2的潜伏期则为4.5-5.8天。病毒感染呼吸道上皮细胞会引起什么样的临床症状和体征,取决于其哪一部分呼吸道被感染(图1)。鼻腔, 鼻咽和口咽粘膜感染会引起流鼻涕,咳嗽,打喷嚏和喉咙痛; 而气管,支气管感染表现为咳嗽和呼吸窘迫。
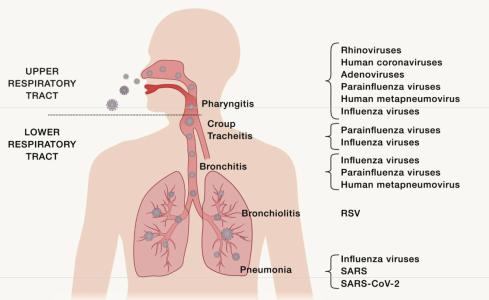
图1.人类呼吸道示意图,不同呼吸道病毒会感染上,
下呼吸道特定部位并引起不同的临床表现
鼻病毒,腺病毒和人类冠状病毒感染通常局限于上呼吸道。副流感病毒会引起儿童下呼吸道感染,呼吸道合胞病毒引起儿童支气管炎; SARS,MERS和SARS-CoV-2可引起肺炎(图1)。 肺炎(pneumonia),主要是指肺泡和肺实质出现发炎的症狀。有时呼吸道病毒感染会诱发继发性的细菌感染, 在临床上主要表现为中耳炎或肺炎。流感病毒感染后, 最常见的是由肺炎链球菌或金黄色葡萄球菌造成的继发细菌性肺炎。在1918年和2009年流感大流行期间,很大一部分患者死于继发细菌性肺炎。
宿主感染后的免疫反应
人体的对外来微生物的入侵的免疫保护机制可分为天然免疫和适应性免疫。首先响应病毒感染的是机体的天然免疫系统,可识别病原体并诱导促炎细胞因子和趋化因子的产生, 也是抵御病原微生物入侵的第一道防线。其次是适应性免疫系统, T细胞可以直接杀死被病毒感染的细胞,B细胞可产生并分泌抗体,阻断病毒的感染。
天然免疫系统被激活主要通过损伤相关分子模式(DAMP)和病原体相关的分子模式(PAMPs)。损伤相关分子主要是指死亡细胞释放的细胞内容物或细胞组织蛋白。PAMPs通过识别一些保守的非自我分子,激活天然免疫反应,保护宿主免受感染。这些分子为微生物中保守的小分子基序, 例如来自入侵病原体的病毒RNA,它们会被机体的的toll样受体(TLRs)和其他模式识别受体(PRRs)识别。炎症小体也是机体天然免疫系统的重要组成部分, 病毒感染过程中炎症小体的激活, 会使宿主细胞大量分泌IL-1beta, 一种功能强大的促炎细胞因子。与此同时, RIG-IMAVS和cGAS-STING等病原微生物识别途径也会被激活, 进而启动宿主细胞抗病毒基因表达。对天然免疫的调节, 在 H5N1流感(致死率非常高的一种流感病毒)和SARS-CoV-2感染的治疗中非常重要,这两种病毒的感染常常诱导人体的天然免疫系统产生细胞因子风暴, 通俗来讲就是严重的炎症反应。
适应性免疫又叫获得性免疫或特异性免疫, 一般是在微生物等抗原物质刺激后才形成。在适应性免疫中包括细胞免疫和体液免疫。在病毒感染中的细胞免疫一般来讲是T淋巴细胞在受到在来自病毒的多肽的刺激后,在CD4+ T辅助细胞的参与下,CD8+效应T细胞会大量增殖和分化, 分化后CD8+效应T细胞会通过杀细胞作用来杀死或溶解被病毒感染的靶细胞。
呼吸道病毒的最终清除,还是依赖于体液免疫即中和抗体的产生。体液免疫是指B细胞在抗原的刺激下转化为浆细胞,合成并分泌能与抗原结合的免疫球的蛋白即抗体。免疫球蛋白G(IgG)是血清中含量最多的免疫球蛋白,能与病毒表面的抗原蛋白结合,从而阻断病毒与靶细胞上的受体结合,使病毒无法感染细胞。此外,存在于鼻,支气管分泌物,唾液中的IgA, 可将病毒粘附在呼吸道黏膜表面, 阻止病毒向呼吸道上皮细胞的扩散。
需要注意的是, T和B细胞的持久性激活或抗原过度刺激会导致T细胞或B细胞衰竭, 使得T细胞或被细胞再次遇到某些抗原蛋白刺激时不会产生相应的免疫应答。这种现象已在许多慢性病毒包括艾滋病毒的感染中有过报道,并常伴有淋巴细胞减少症。 SARS和大流行H1N1流感病毒感染也会在一些患者中引起淋巴细胞减少和T细胞衰竭。
COVID-19中会发生什么?
潜伏期后,感染从症状发生前的阶段(1-3天)发展到有症状(2-4周)至症状后或恢复期延长(2-8周)(图2)。 SARS-CoV2在不同人群中引起的临床症状差别巨大, 有些感染者自始至终没有任何症状, 有些感染症则表现作出非常严重的临床症状, 甚至会因呼吸衰竭而失去生命。80%的SARS-CoV2感染者为轻症患者, 这些患者的症状表现为发烧,咳嗽,咽喉肿痛,嗅觉消失,头痛和肌肉酸痛。在流感中,病毒的感染量, 也即感染的病毒多少与感染后发病的严重程度相关。目前尚不清楚SARS-CoV-2是否也是如此。值得注意的, 2019年冠状病毒病(COVID-19) 的无症状携带者(约占总感染人数 10%–50%)可以大量排放病毒。
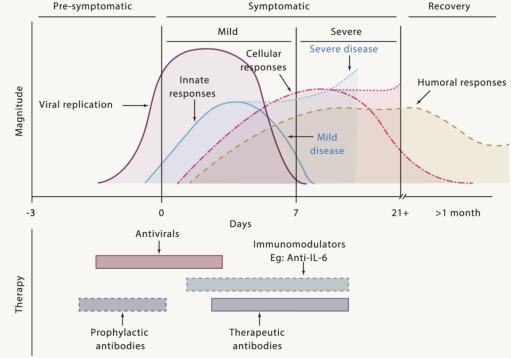
图2. COVID-19发病阶段示意图,SARS-CoV-2复制的动力学以及和适应免疫应答。
该疾病可分为三个阶段:症状发作前,症状发作期和恢复期。 病毒复制发生在症状发生前的晚期和症状早期。 随后激活机体的天然免疫反应,包括巨噬细胞,自然杀伤(NK)细胞,树突状细胞和一系列分泌促炎性细胞因子的免疫细胞的激活。 在重症患者中,天然免疫被过度激活,并长时间维持在一个高水平状态,对组织造成免疫损伤。 在轻度至中度症状的COVID-19患者中, 出现症状后的第一周内,可检测到抗原特异性B和T细胞的细胞免疫应答。
严重的并发症出现在男性和患有基础疾病(包括高血压,糖尿病,心血管疾病疾病和免疫功能低下等)的患者中。在这些患者中,还可以观察到白细胞增加伴有淋巴细胞减少,凝血酶原时间延长(表示凝血功能障碍)和肝酶水平升高,乳酸脱氢酶,D-二聚体,白介素-6,C反应蛋白和降钙素原。
SARS-CoV-2感染的重症患者的发病机制很复杂。病毒表面的糖蛋白S与细胞表面受体ACE2的结合,后者在机体肾素-血管紧张素-醛固酮系统中的起着重要的调节作用(RAAS)。 ACE2的生理作用是调节血液压力; ACE2代谢血管收缩剂血管紧张素II,生成血管紧张素1-7,它们是血管扩张剂。分布在鼻和肺粘膜表面的表达ACE2的细胞会促进呼吸道感染。但是,ACE2也可以在许多其他组织的细胞中表达,包括内皮,心脏,肠道和肾脏,因此,这些器官也容易受到病毒攻击 。重症SARS-CoV-2的显着标志是细胞因子释放综合征。 SARS-CoV-2呼吸道感染上皮细胞激活单核细胞,巨噬细胞和树突状细胞,导致一系列促炎性细胞因子的分泌,包括白介素6(IL-6)。 IL-6会促进T辅助细胞17(Th17)的分化,以及其他淋巴细胞变化。循环中的IL-6和可溶性IL-6受体复合物间接激活许多类型的细胞,包括内皮细胞,导致一系列细胞因子的泛滥,从而导致血压降低和急性呼吸窘迫综合征(ARDS)。IL-6在该级联反应中的关键作用。提示人们去评估IL-6的拮抗剂(例如tocilizumab,sarilumab和siltuximab)用于治疗严重的COVID-19疾病的可能性。
除了增加血管通透性外,细胞因子“风暴”还导致高水平的纤维蛋白原和小血管上内皮表面的凝血级联激活, 标志为纤维蛋白分解产物D-二聚体在血液中的水平异常升高。病毒竞争性地与ACE2的结合可能会导致RAAS失调进而引起血管收缩。令人费解的是:在COVID-19肺炎中,有些患者血氧水平极低,但他们并没有感到呼吸困难。有研究表明,在COVID-19肺炎中, 氧摄取障碍是由肺部血管阻塞或收缩造成的, 而不是由肺泡水肿液的积聚和肺泡的充血引起的。由肺泡水肿液积聚和肺泡充血造成的氧摄取障碍在在其他呼吸道病毒感染引起的肺炎中很常见。因此,可考虑将抗凝剂用于对重症COVID-19疾病的治疗。越来越清楚的是,SARS-CoV-2感染诱发的一系列并发症会损害从肾脏到大脑等多个机体器官。这样的病理生理变化在其他呼吸道病毒感染病例中很少见到。
SARS-CoV-2感染的治疗策略
截止目前, 没有专门针对SARS-CoV-2的许可药物(或其他)。 COVID-19的大流行,在四个月的时间里,造成185个国家/地区,超过300万确诊病例其中23万例死亡,寻找针对SARS-CoV-2的抗病毒药物已经迫在眉睫。寻找有效的治疗方法最快途径就是从已获得批准许可被用于治疗其他疾病的药物中寻找。
针对病毒特定蛋白或宿主细胞生命周期中关键过程的药物在抗SARS-CoV-2方面的作用, 已经在体外和临床试验中得到评估(图2)。超过300项临床试验已在世界各地注册,但并非全部都是随机对照试验(RCTs),而随机对照试验是临床研究中的金标准。随机对照试验可最大程度地减少在衡量新药干预或治疗有效性时预存的偏见。经过评估的药物有HIV蛋白酶抑制剂组合:洛匹那韦-利托那韦,氯喹,羟基氯喹和瑞德昔韦。迄今为止,洛匹那韦-利托那韦和羟氯喹尚未显示出明确的抗SARS-CoV-2临床效果。在一项同情用药研究中发现,瑞德昔韦可改善患者对氧气支持和机械通气的需求。所谓同情用药,指对于患有严重或危及生命疾病的患者,在不能通过现有药品或入选临床试验来得到有效治疗时,可以申请在临床试验之外使用未经上市许可的试验用药物。在一项在中国开展的设有瑞德昔韦和安慰剂对照组的随机对照临床试验中,未发现瑞德昔韦可显著加快病毒载量下降速度。但是一项大型国际临床试验的中期分析显示联合使用瑞德昔韦可将平均住院时间缩短4天,并且该药在美国已经批准用于COVID-19的治疗。
免疫调节剂可能会改善COVID-19的严重症状,可以用作抗病毒药物的辅助药物(图2)。在很多COVID-19患者中可观察到细胞因子释放综合征, 血清中IL-6其他促炎细胞因子浓度的异常升高, 提示研究者IL-6信号通路阻断剂或可用于COVID-19的免疫治疗,例如tocilizumab(托珠单抗,一种IL-6信号通路抑制剂,用于活动性类风湿关节炎的治疗)和Sarilumab(一种靶向IL-6受体,用于治疗类风湿关节炎的全人源单克隆抗体)。
抗体可以阻断病毒的感染。抗体可从康复患者的血浆中分离得到;也可以分离康复患者的特异性B细胞来制备全人源化单克隆抗体;还可以用噬菌体展示库来制备单克隆抗体。恢复患者血浆已单独或作为抗病毒药物的佐剂用于SARS, 重症流感 和COVID-19的治疗(图2)。抗体也可以用于高危人群的预防(图2)。
抗病毒药物,免疫调节剂和治疗性抗体的给药时机应遵循疾病的发展阶段和病毒复制和免疫反应的动力学(图2)。
概括来讲, 包括冠状病毒,鼻病毒,呼吸道合胞病毒,副流感和流感病毒在内的呼吸道病毒以呼吸道为感染目标,引起从鼻炎到肺炎的一系列严重程度不同的疾病,对人类健康造成严重威胁。呼吸道病毒通过结合表达在细胞表面的不同受体来感染呼吸道上皮细胞, 感染后病毒会迅速激活宿主的天然免疫。 宿主的天然免疫反应是生物在漫长的进化过程中形成的对外来入侵微生物的免疫保护机制,也是构成机体免疫系统的是第一道防线。所谓“道高一尺, 魔高一丈”, 病毒在长期的进化过程中也获得了多种抑制宿主免疫反应的能力。
在宿主对抗病毒入侵产生的一系列免疫反应中, T细胞介导的细胞免疫, 在宿主清除病毒感染以及抗体产生过程发挥着重要作用。其中记忆性T细胞在对抗同型病毒的再次感染中起关键作用,这种细胞曾经遇到过某种特定抗原,当同种抗原再次进入人体时,记忆T细胞可以第一时间产生强烈的免疫反应, 清除病毒感染的宿主细胞, 但实际上由于病毒的变异或中和抗体的消失, 许多呼吸道病毒会在一生中多次感染人类。
COVID-19指由SARS-CoV-2(一种人畜共患的冠状病毒)感染引起的疾病, 于2019年在中国出现,并在世界范围内大流行。COVID-19肺炎的严重程度和病程迁延时间较其它呼吸道病毒严重和漫长的多, 这可能是天然免疫被激活后产生的强烈的炎症反应导致的。肺功能和体内凝血功能异常引起血氧浓度降低和大量促炎细胞因子产生,这两个因素最终导致机体的多器官功能障碍。随着大流行的发展,我们将会更好地了解COVID-19复杂的病理生理学特征。目前的治疗策略包括抗病毒药物,免疫调节剂和抗体以及其它辅助疗法。
参考资料:
Kanta Subbarao,Siddhartha Mahanty. Respiratory Virus Infections: Understanding COVID-19.Immunity,Volume 52, Issue 6, 16 June 2020, Pages 905-909
