帕金森病(Parkinson’s disease,PD)是一种常见的神经退行性疾病,有数据显示,中国的PD人数量或超300万。传统上认为PD是一种运动系统疾病,最明显的为运动功能减退,颤抖,肢体僵硬[1]。但现在认为,PD其实是一种具有多种临床特征的复杂疾病,除了运动症状外,其临床症状还包括神经精神性及其他非运动表现,例如情绪紊乱,睡眠紊乱等等[2]。药物治疗(L-多巴)和脑深部电刺激是目前的PD治疗的主要手段,可以有效地改善肢体震颤等运动症状,但是对于非运动症状,例如情绪紊乱收效甚微[3-4]。因此,对于PD中运动以及非运动症状机制的研究可以为PD的治疗提供新思路以及新靶点。
2022年6月8日,麻省理工学院冯国平教授团队在Nature上发表了题为“Targeting thalamic circuits rescues motor and mood deficits in PD mice”的研究论文 ,通过对丘脑环路的研究,首次揭示了PD中运动以及非运动症状的治病机制,发现了新的可以用于PD治疗的药物靶点。张颖博士和Dheeraj Roy博士是该论文的共同第一作者,冯国平教授、张颖博士、Dheeraj Roy博士为共同通讯作者。(拓展阅读:冯国平课题组最新研究进展,详见“逻辑神经科学”报道(点击阅读):PNAS︱冯国平实验室揭示前端丘脑环路在工作记忆中的重要作用)
丘脑束旁核(parafascicular thalamus,PF)是丘脑板内核群的重要组成部分,因为与运动基底核团的密切联系,一般被认为是一个运动相关的丘脑核团[5,6]。在PD患者的脑部也可以检测到PF神经元大量特异性的衰退[7]。因为缺乏特异有效的操作手段,PF在以往的研究中长期被忽略,其行为学功能,特别是其在PD中的致病机制,并不明确。
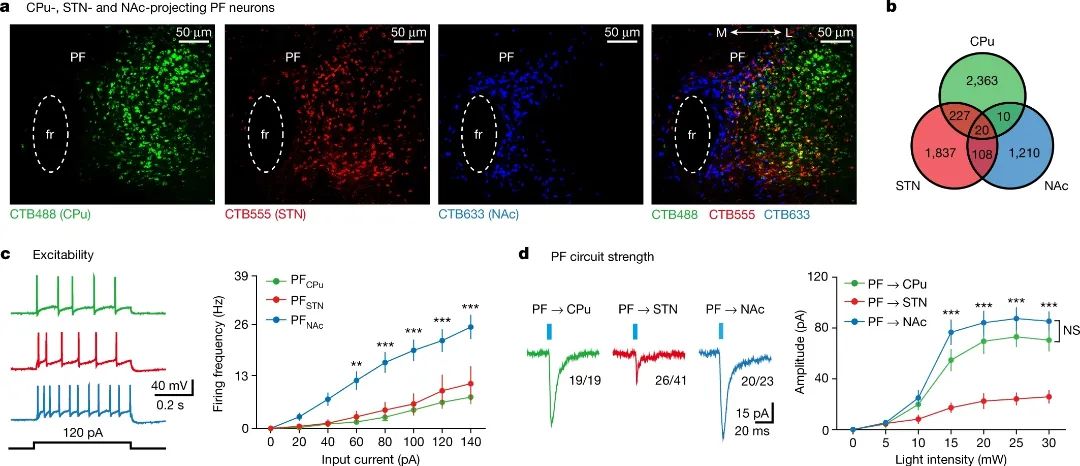
通过新颖的环路操控技术以及在体钙成像的方法,研究人员首先研究了野生型小鼠中PF环路及其功能,第一次发现了PF中存在三种不同的神经元亚群:一类PF神经元投射到背侧纹状体CPu (caudate putamen)调节运动功能;一类PF神经元投射到丘脑下核STN(subthalamic nucleus)调控运动学习功能;还有一类PF神经元可以投射到腹侧纹状体NAc(nucleus accumbens)参与抑郁样行为的产生(图1)。有意思的是,进一步对PFàSTN 环路的研究,科学家发现在STN中发现了一群兴奋性投射的PV神经元,而就是这群神经元参与了运动学习的功能。
图1 PF中三种不同的神经投射(神经元亚群)
(图源:Zhang Y., et al., Nature, 2022 )
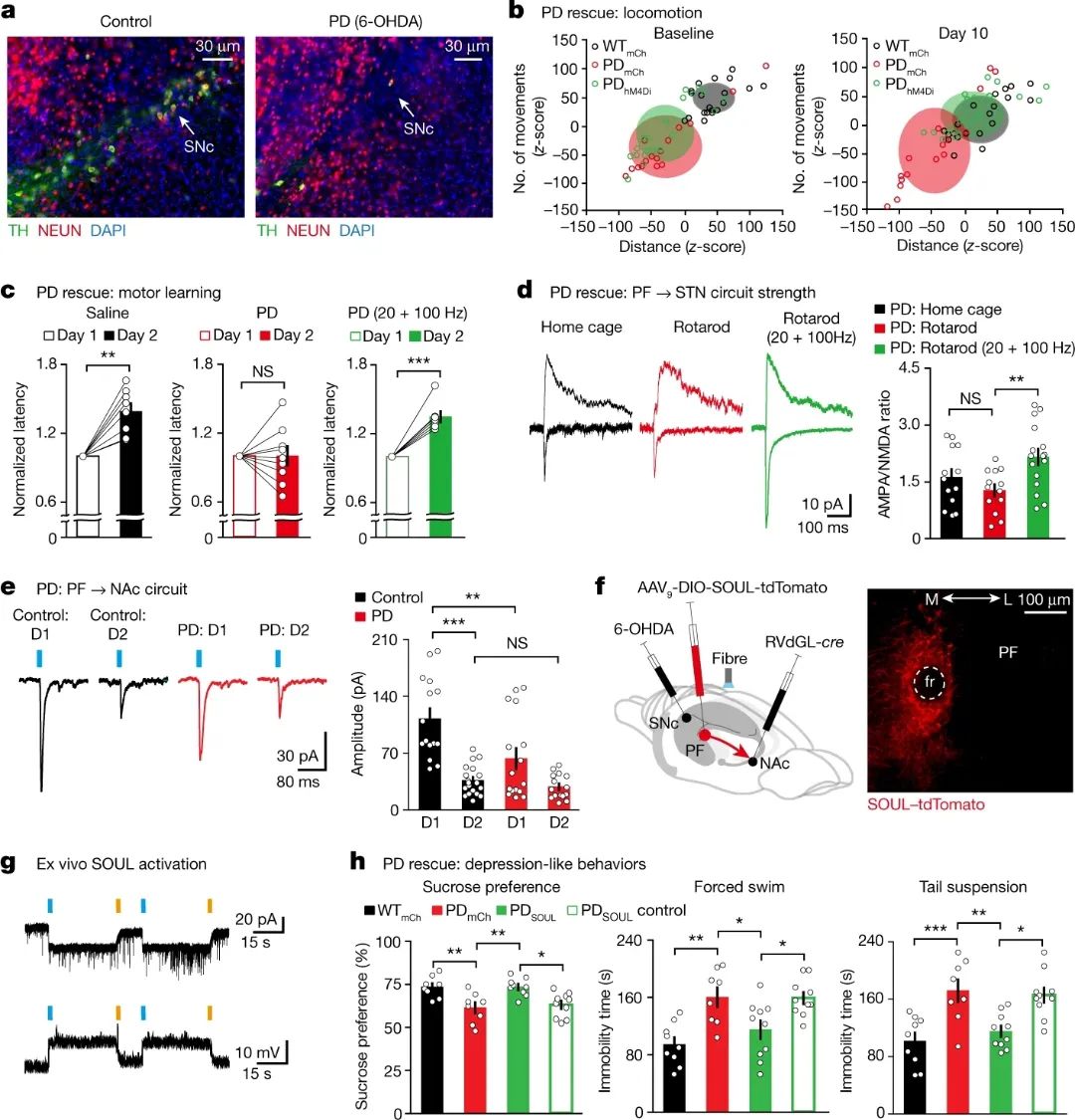
运动功能减退,运动学习能力的降低,以及抑郁样行为都是PD的症状,那么,这些不同的PF神经元亚群及其环路是否参与了PD的致病呢?通过对PD小鼠模型的研究,科学家发现三种不同的PF环路均存在不同程度的异常:PFàCPu 环路在PD小鼠中突触连接增强;PFàSTN 环路在PD小鼠中突触可塑性降低;PFàNAc 环路在PD小鼠中突触连接减弱。
那么,如果特异性地调控PD模型小鼠中不同的PF环路,能不能有效改善PD的症状呢?研究人员发现,用药理学遗传的方法特异性抑制投射到CPu的PF神经元,可以长期改善小鼠的运动功能。用光遗传的方法增强PFàNAc 环路的突触可塑性可以有效改善PD小鼠的运动学习功能。通过在NAc投射的PF神经元中表达一种新型的光敏感蛋白SOUL,研究者可以用非损伤的方法改善PD小鼠的抑郁样行为(图2)。
图2 靶向PF神经挽救PD运动缺陷和抑郁样行为
(图源:Zhang Y., et al., Nature, 2022)
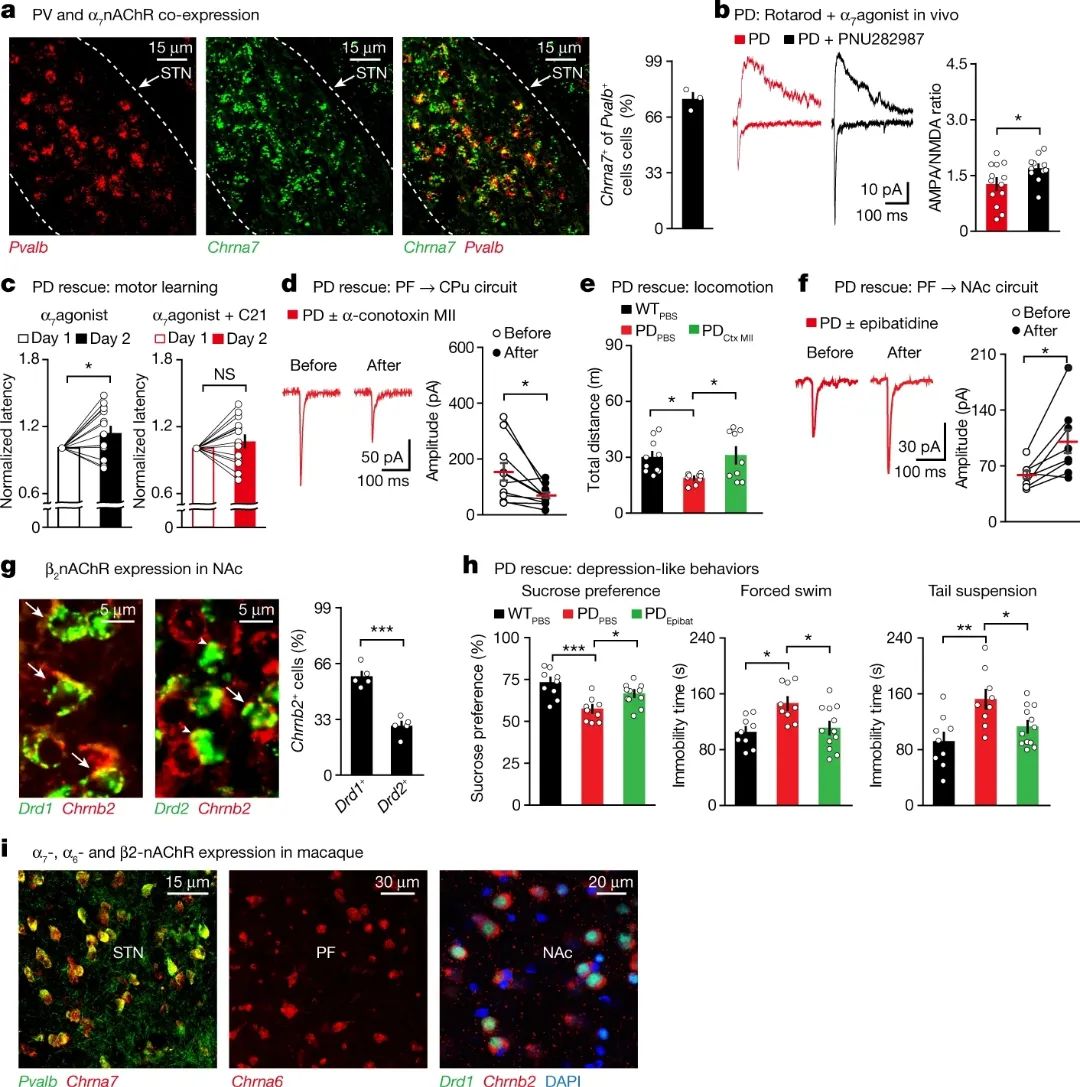
通过光遗传以及药理学遗传的方法,研究者可以有效改善PD模型小鼠的运动以及非运动症状。接下来,研究人员就想知道,能不能在不同的PF环路中找到各自的药物学分子靶点,从而起到治疗的作用的呢?通过一系列研究,他们发现,不同的乙酰胆碱受体(nAChRs)可以表达在不同的PF环路中,使用其特异性的激动剂或者拮抗剂可以有效改善PD小鼠的运动功能,运动学习功能,以及抑郁样行为(图3)。值得一提的是,通过对猕猴的研究,研究人员证实,这些nAChRs也在灵长类动物的PF环路中特异性表达。
图3 靶向PF环路的nAChRs可拯救PD表型
(图源:Zhang Y., et al., Nature, 2022 )
文章结论与讨论,启发与展望
该研究通过对单一丘脑核团的调控同时改善了帕金森病(PD)的运动以及非运动症状,同时揭示了相应的分子靶点,为PD的治疗提供新思路以及新方向。通过PD的小鼠模型,研究者发现了新的可以用于PD治疗的靶点,同时指出这些靶点在灵长类动物中表达,那么能否通过调控受体从而改善PD的灵长类模型中的行为学症状有待研究。
派真生物作为一家专注于重组腺相关病毒(rAAV)载体包装的CRO & CTDMO科技公司,致力于为神经科学研究科研者提供从质粒克隆到AAV包装的一站式基因操作解决方案,推动神经科学研究进展。此外,派真生物的现货AAV库可为您提供光遗传、化学遗传、钙指示等神经研究工具AAV,欢迎咨询。
参考文献
2. Poewe, W. Non-motor symptoms in Parkinson’s disease. Eur. J. Neurol. 15, 14–20(2008).
3. The Parkinson Study Group. Levodopa and the progression of Parkinson’s disease.N. Engl. J. Med. 351, 2498–2508 (2004).
4. Hamani, C., Saint-Cyr, J. A., Fraser, J., Kaplitt, M. & Lozano, A. M. The subthalamic nucleus in the context of movement disorders. Brain 127, 4–20 (2004).
5. Smith, Y., Raju, D. V., Pare, J. F. & Sidibe, M. The thalamostriatal sytem: a highly specific network of the basal ganglia circuitry. Trends Neurosci. 27, 520–527 (2004).
6. Diaz-Hernandez, E. et al. The thalamostriatal projections contribute to the initiation andexecution of a sequence of movements. Neuron 100, 739–752 (2018).
7. Jouve, L., Salin, P., Melon, C. & Kerkerian-Le Goff, L. Deep brain stimulation of the center median-parafascicular complex of the thalamus has efficient anti-parkinsonian actionassociated with widespread cellular responses in the basal ganglia network in a rat model of Parkinson’s disease. J. Neurosci. 30, 9919–9928 (2010).