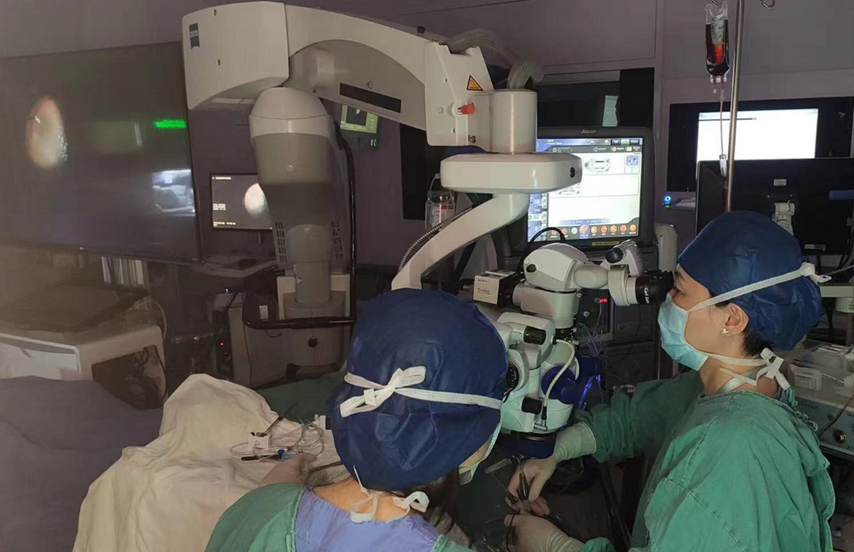
继先天性黑矇症、老年黄斑变性三项IIT基因治疗研究后,2022年7月6日,国家眼部疾病临床医学研究中心(上海交通大学附属第一人民医院/上海市第一人民医院)再一次顺利完成RPE65突变遗传性视网膜患者(IRD)I期注册临床试验首例受试者的基因治疗,显示出良好的安全性和改善视功能的优势,为遗传性眼病患者摆脱无药可医困境、朝向光明之路更进一步!
该项研究是中国首个针对RPE65双等位基因突变相关遗传性视网膜变性(IRD)患者,评价 rAAV2-RPE65 基因治疗制剂(LX101)安全性和有效性的多中心、多阶段的注册临床试验,由国家眼部疾病临床医学研究中心主任许迅教授牵头,北京同仁医院魏文斌教授共同领衔。
遗传性视网膜疾病的患病率为1/3000~1/5000,以中国每年1500万新生儿计算,这就相当于每年将有4500个儿童将面临人生的不幸。遗传性视网膜变性是儿童及工作年龄人群致盲的首要病因,因其中绝大多数缺乏有效干预手段,长期以来被称作“不可治”眼病,尽管国际上已有获批上市的基因治疗药物,但动辄上百万美元的“天价药”,让大部分患者望而却步。
如今,终于在中国有了突破,中国第一个“在RPE65双等位基因突变相关遗传性视网膜变性(IRD)患者中评价 rAAV2-RPE65 基因治疗制剂(LX101)安全性和有效性的多中心、多阶段临床研究”即将在上海国家眼部疾病临床医学研究中心及全国多家著名眼科中心开启临床试验。这意味着中国自主研发基因治疗眼科新药步入了“成药快车道”,给遗传性眼病患者带来新的光明希望。
本次试验的研究药物LX101是朗信生物旗下上海朗昇生物科技有限公司,自主研发的中国第一款针对RPE65的基因治疗药物。该药物通过腺相关病毒2(AAV2)携带正常RPE65基因,能特异识别并转染病变的视网膜色素上皮细胞,并在细胞内持续表达患者缺少的RPE65蛋白,恢复正常视循环,达到提升视功能的治疗目的。前期朗信生物通过大量的临床前实验获得了充分安全性和有效性数据。于2021年6月,经科学和药物安全委员会和伦理委员会批准以及国家科技部人类遗传资源管理办公室登记备案,在上海交通大学附属第一人民医院成功开展了LX101探索性IIT临床研究,共入组6例患者,目前最长随访时间已超300天,显示出该药物具良好的安全性和改善视功能优势,其中一名儿童患者视力提升最高可达ETDRS视力表37个字母。本研究得到的严谨临床安全性数据和初步有效性数据,作为申请主要附件内容得到了国家药品监督管理局的认可。2022年4月,获得中国第一个针对RPE65突变的视网膜色素变性患者的临床试验批件(CXSL2200048)。