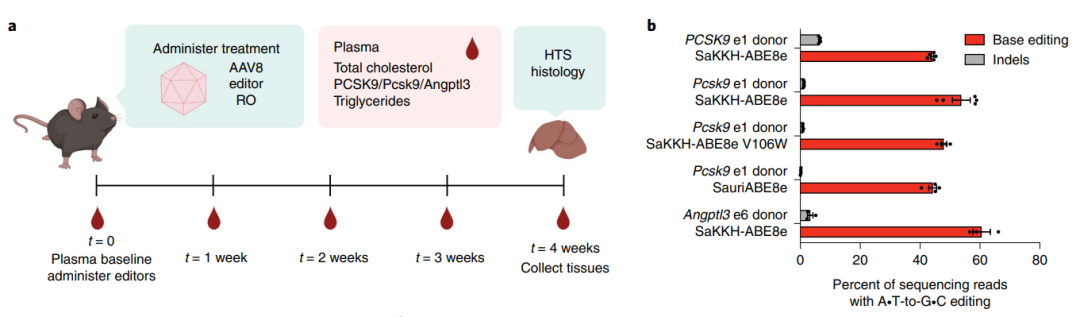
PCSK9和Angptl3基因是已知的心血管疾病相关风险基因,降低这两个基因的表达,均能降低低密度脂蛋白胆固醇(LDL-C)水平,从而预防和治疗心血管疾病。
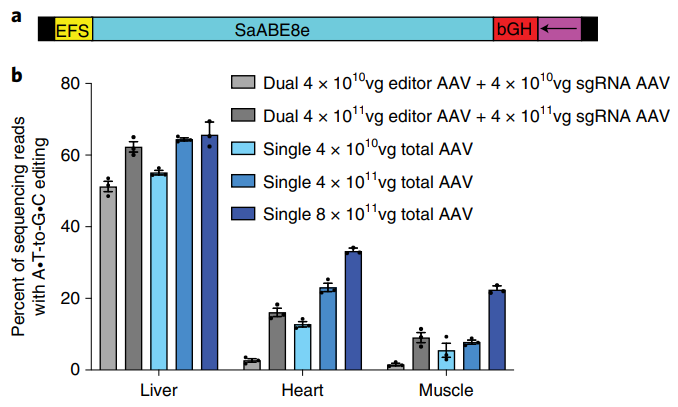
该研究通过优化腺嘌呤碱基编辑器和AAV病毒载体组件的大小,开发了一套单AAV腺嘌呤碱基编辑系统,能够实现强大的体内碱基编辑,而且具有广泛的PAM序列兼容性。这一单AAV碱基编辑系统在肝脏、心脏和肌肉组织中分别可实现高达66%、33%、22%的碱基编辑效率,优于双AAV载体。当与双AAV载体同剂量时,单AAV载体递送的编辑效率在心脏中增加2.1倍,在肌肉中增加2.5倍。
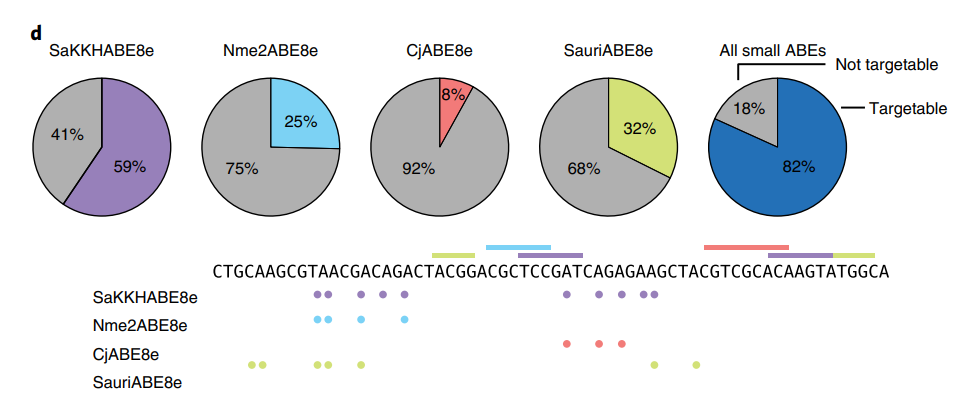
此外,单AAV腺嘌呤碱基编辑系统可以使用多种血清型的AAV(该研究中使用了AAV8和AAV9),这有助于在肝外组织进行递送。对于脂质纳米颗粒(LNP)递送最有效的肝脏,该单AAV腺嘌呤碱基编辑系统的效果与之相当,而对于心脏等LNP无能为力的器官,单AAV腺嘌呤碱基编辑系统将大有可为。
与目前使用的双AAV载体策略相比,该研究开发的单AAV腺嘌呤碱基编辑系统的优势很明显,只需生产单个AAV载体,能够提高效率、降低复杂性,减少给药剂量,从而降低潜在毒性作用。总的来说,这项研究提高了碱基编辑的治疗潜力,确立了单AAV碱基编辑器系统的优势,并提供了一套具有广泛靶向能力的单AAV腺嘌呤碱基编辑器,以支持高效的体内碱基编辑。