
AAV的由来与生物学特征
基因治疗的概念最早是在1947年明确提出 (Keeler, 1947)。有两方面的因素促使克莱德·基勒(Clyde Keeler)想将基因治疗模式与其他治疗策略区分开来,一方面是基因治疗具有从根本上解决疾病病因的能力,另一方面是该疗法可以诱导对基因“永久纠正”。迄今为止,这两个因素仍然是研究者们研究基因治疗的主要原因。
神经系统疾病,比其他类型的疾病或许更能从基因治疗的独特优势中获益。对于单基因疾病,通过基因治疗的手段进行治疗,已经有临床上的效果,但目前基因治疗已经通过各种遗传干预扩展到常见的复杂疾病领域。
基因治疗的长期表达疗效,对脊髓、大脑以及外周感觉器官系统的临床应用非常有益,大多数药物无法通过血脑屏障(BBB)到达这些器官。对脑、脑脊液、视网膜或耳蜗等器官或组织的给药方式,临床上禁止使用频繁注射作用半衰期短的传统药物,而基因治疗只需要一次注射就可以实现持久的疗效,以最安全方便的模式达到治疗疾病的目的。
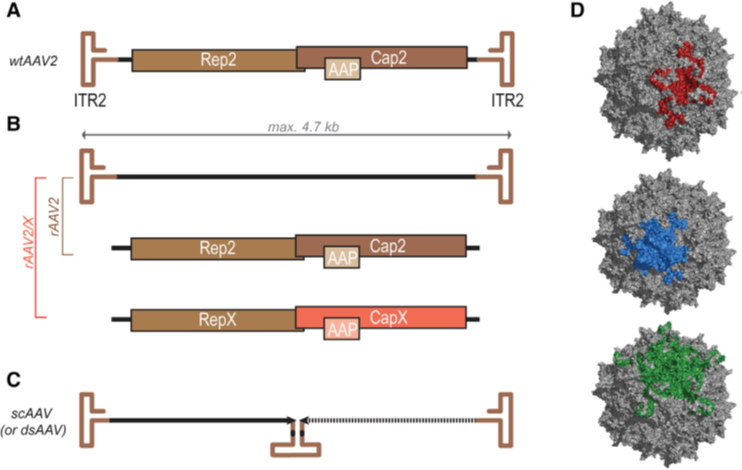
图1:AAV病毒和基因组载体
腺相关病毒(AAV),是细小病毒科的一员,其特征是:无包膜;衣壳呈二十面体结构;携带4.7 kb的单链(ss)基因组(图1)。AAV的基因组两侧是反向末端重复序列(ITRs),编码三个基因家族:复制相关基因(Rep),结构衣壳基因(Cap VP1. -2和-3),以及组装所需的小病毒辅助因子,称为组装激活蛋白(AAP)(图1A) (Knipe和Howley, 2013)。
自然发现的AAV已经从多个物种中分离出来,包括非人灵长类动物(NHP)、牛、山羊、老鼠,甚至鸟类(Gao et al,2005)。野生型病毒的感染可以整合到人类AAVS1 19q3基因位点 (Kotin et al., 1990;Linden et al., 1996)。这种相对特异性是由于ITR区域的序列同源性以及Rep基因产物在宿主基因组中的整合而产生的(Linden et al., 1996)。重组AAV是通过清除病毒基因组中的所有开放阅读框(orf)来产生的,使其成为复制缺陷病毒载体(图1B)。为了制备重组AAV,需要保留侧翼ITR145 bp的序列 (Hastie和Samulski, 2015)。载体中没有病毒基因组,因此不会发生复制,大大减少了安全问题,同时释放了基因装载容量,以便插入治疗性目的基因。
目前最常见的载体生产方法是三质粒瞬时转染HEK293细胞来完成,即一个质粒包括ITR-侧翼的顺式转基因,另一个质粒编码AAV rep和cap基因,以及一组最小的腺病毒基因,这些基因共同帮助AAV完成病毒复制。
注
AAV给药途径的选择在临床应用中尤为重要,下文是对AAV在神经系统疾病中临床应用相关的给药途径的综合阐述。
AAV给药途径
是药物转导安全性和有效性的主要因素
将基因转移到中枢神经系统或分隔的感觉器官,如眼睛和耳朵,具有很大挑战性。载体和递送途径的正确选择,才可能在保证药物的安全性的同时,提高细胞感染效率 (图2)。例如,脑、眼、耳蜗和脊髓是分隔的器官,其生理障碍(如血脑屏障)极大地限制了AAV药物的进入。
治疗神经系统或感觉器官相关的疾病时,由于所靶向的区域相对较小,最好选择局部注射的方式(例如眼睛或耳蜗等局部器官)。目前将治疗性基因输送到大脑的最常用的仍然是脑实质内输注AAV这种局部注射的方式。
鼻内给药是另一种非侵入性的给药方式,可用于恢复溶酶体酶表达水平的相关治疗,溶酶体酶是分泌蛋白,可以通过中枢神经系统进行扩散。
最后,改善运动神经元相关疾病的治疗一般选择肌内或脊髓内注射AAV,效果比较好。
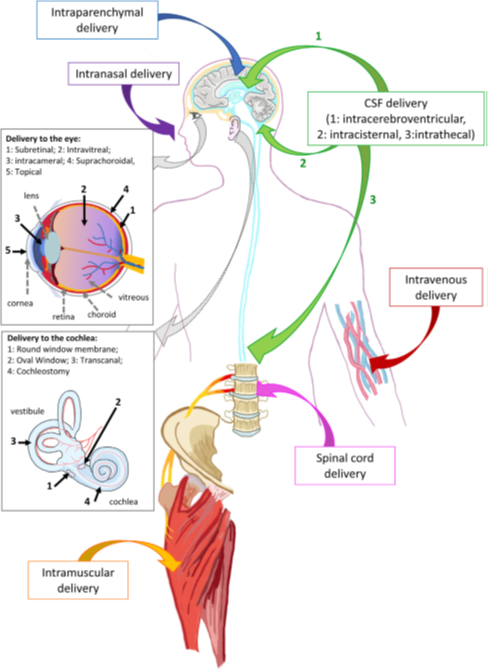
图 2. AAV在体内传递到神经系统的途径
与注射到静脉系统或其他充满液体的隔室相比,局部途径的给药具有明显的优势。它最大限度地提高了基因转移药物在靶细胞附近的浓度和停留时间,避免了广泛的生物分布,从而限制了免疫原性风险和由AAV成分或转基因异位表达引起的毒性。
脑立体定位注射实践案例
中枢神经系统的局部递送,操作复杂,涉及外科手术过程,受试者被麻醉并限制在立体定向框架内,同时针尖或柔性石英导管通过颅骨钻孔直接插入实质。在小动物模型(小鼠和大鼠)中直接注射AAV,通常根据脑图谱从颅骨上的参考点(bregma)计算立体定向坐标。而实时MRI引导系统可以提高大型物种(如NHPs和人类)的准确性(Eberling等人,2008;Fiandaca et al., 2009;Hadaczek et al., 2006)。大多数AAV血清型表现出比较好的神经元亲和性(ceearley和Wolfe, 2007),例如AAV5可以有效地靶向星形胶质细胞(Davidson等,2000)。衣壳修饰的AAV6可以实现对小胶质细胞的转导 (Rosario et al., 2016)。在溶酶体贮积病(LSD)、阿尔茨海默病(AD)、帕金森病(PD)和亨廷顿病(HD)小鼠模型的大量临床前研究中,AAV通过肺内注射取得了成功(Hocquemiller等人,2016;Choudhury等人,2017)。
在小动物模型中,只需局部注射几微升的载体就可以实现广泛的转导。较大物种中的研究,局部注射也显示出显著的安全性和更高转导效率,例如GM1和GM2神经节苷脂的猫模型(使用AAV1或AAVh.8;McCurdy et al., 2015),粘多糖病I型和IIIB型狗模型(使用AAV5;Ellinwood等人,2011)和MPTP(1-甲基-4-苯基-1.2.3.6-四氢吡啶)诱导衣壳突变后的NHPs,模拟帕金森神经变性(在注射AAV2-hAADC后8年观察到持续的临床改善;Hadaczek et al., 2010)。
在健康的NHPs中进行了AAV脑内注射后的安全性和转导有效性研究,也表现出良好的耐受性(Colle et al.,2010;McBride et al., 2011;Zerah等人,2015.Ciron等人,2009;Sondhi et al., 2012)。对于运动神经元疾病,运用的是脊髓实质的多层注射方式,目前已成功地应用于肌萎缩性侧索硬化症(ALS)小鼠模型中 (Azzouz等人,2000;Franz等人,2009;Hardcastle等人,2018)。
高风险的手术干预和由此产生的转基因表达的局灶性病变,使得AAV脑部定位注射应用于大型哺乳动物和人类具有极大的挑战性。除了神经外科干预所固有的病毒或细菌感染、出血和水肿的风险外,与AAV立体定向注射相关的主要影响因素还有载体在实质中的传播受到限制,。有些血清型 (例如AAV1. -6. -8和-9)的长距离顺行和逆行轴突转运,可能促进病毒颗粒在大脑解剖连接区域中的传播(Castle等人,2014;Lo¨w等人,2013;San Sebastian et al., 2013;Zingg等人,2017)。对流增强输注(CED)是另一种注射选择,在输注过程中施加一定压力以增强载体扩散(Bankiewicz et al., 2000;Hadaczek et al., 2006)。其他在脑内局部递送后增强AAV转导的方式包括联合输注肝素(Mastakov等人,2002)或甘醇(Mastakov等人,2001)等因子 (Carty等人,2010)。
局部向脑脊液递送AAV药物在整个大脑和脊髓中会有更高的基因转导效率(Hardcastle等人,2018) (图2)。然而,室管膜细胞之间的紧密连接,限制了AAV血清型(如AAV1、-2、-4、-5、-8、-9、rh10和PHP.B)的穿透能力(Hinderer等人,2018a)。在啮齿类动物的临床前研究中,新生儿和成年小鼠灌注AAV或腹腔内(IC)输注AAV可使转基因在脑组织和脊髓中广泛表达,该方法已成功地缓解了一系列疾病症状,例如MPS I (AAV8-hIDUA;Wolf等人,2011),II (AAV9.hIDS;Hinderer等人,2016),IIIA (AAV9.CAG;Haurigot等人,2013),VII (AAV1-GUSB;Passini et al., 2003), GM1神经节脂质沉积症(Broekman et al., 2007), SMA (AAV9.SMN1;Armbruster等人,2016),MDL (AAV1-hARSA;Hironaka et al., 2015), ALS (AAV.miRNA-SOD1;Dirren et al., 2015),甚至AD (levi et al., 2006)。由于室管膜细胞的更新速度相对较快(Chauhan and Lewis, 1979),能否实现基因的长期表达需要进一步探究。
鞘内注射实践案例
相比之下,在腰椎水平的鞘内(IT)注射,则更容易在临床中得以应用。研究表明,单次IT注射AAV.hGAA能显著改善庞贝病的神经系统和心脏功能(Hordeaux等,2017)。在比较不同物种的脑脊液给药途径时,成年小鼠的转导更有效 (Bey等人,2017),而腰椎穿刺注射IT给药时,食蟹猕猴或狗的大脑和脊髓的转导效果要强得多(Hinderer等人,2018a)。
鼻内注射实践案例
局部给药还可以通过鼻内递送AAV用于脑部转导。鼻内递送AAV的主要是针对呼吸道相关疾病,但这种非侵入性基因转移策略也被研究者应用于治疗MPS I (Belur等人,2017)。成年IDUA缺陷小鼠经鼻内灌注AAV9.治疗5个月后,大脑所有部位的酶活性完全恢复到正常水平。由于治疗性溶酶体酶可能通过支配鼻道的嗅觉和三叉神经通路转运到中枢神经系统,这种给药方法也可能适用于LSD (Wolf et al., 2012)。
靶向脊髓的AAV可以通过肌肉注射进行给药,依赖于某些AAV血清型的轴突运输方式以及沿神经向心方式传播的能力(Boulis等人,2003;Towne et al.,2010)。AAV1、AAV6以及AAV9在啮齿类动物肌内输注后可以有效靶向运动神经元 (Benkhelifa-Ziyyat et al., 2013;Hollis等人,2008;Towne et al., 2010)。在非洲绿猴的腹肌中注入ssAAV6.约50%的运动神经元在脊髓同侧腹角中有效转导 (1.3E12 vg;Towne等人,2010)。研究表明,肌肉注射的给药方式,适合于治疗运动神经元相关疾病,
例如ALS和SMA (Benkhelifa-Ziyyat et al., 2013;Wang et al., 2002)。但是,在治疗较大疾病动物时,所需病毒的剂量比较大,病毒的传递也局限于脊髓的腰椎节段。此外,轴突运输的早期功能障碍可能会阻碍AAV的有效转导(Bilsland等,2010;Fischer et al., 2004)。因此,局部给药也仍然有更多优化的空间。
尽管AAV外周给药在技术上很容易并且无创,但在临床应用中仍然有很多挑战:
(1)需要大剂量的载体来实现中枢神经系统的转导;
(2)静脉给药更可能使机体产生抗AAV抗体;
(3)由于大多数AAV是嗜肝性的,增加了肝毒性的风险;
(4)转基因在外周组织异位表达可能进一步带来安全风险。
总之,给药途径的选择在基因治疗中非常关键,目前局部注射是首选,可以最大限度地增加递送载体量,同时提高了安全性。
资料来源
参考文献:
Eloise Hudry, and Luk H. Vandenberghe, Therapeutic AAV Gene Transfer to the Nervous System: A Clinical Reality, Neuron,2019.
Lin Kang, Shilin Jin, Jiayi Wang et al., AAV vectors applied to the treatment of CNS disorders: Clinical status and challenges, Journal of Controlled release,2023.
关于派真
作为一家专注于AAV 技术十余年,深耕基因治疗领域的CRO&CDMO,派真生物可提供从载体设计、构建到 AAV、慢病毒和 mRNA 服务的一站式解决方案。凭借深厚的技术实力、卓越的运营管理和高标准的服务交付,我们为全球客户提供一站式CMC解决方案,包括从早期概念验证、成药性评估到IIT、IND及BLA的各个阶段。
凭借我们独立知识产权的π-alphaTM 293 细胞AAV高产技术平台,我们能将AAV产量提高多至10倍,每批次产量可达1×10¹⁷vg,以满足多样化的商业化和临床项目需求。此外,我们定制化的mRNA和脂质纳米颗粒(LNP)产品及服务覆盖药物和疫苗开发的各个阶段,从研发到符合GMP的生产,提供端到端的一站式解决方案。

