由于面临诸多挑战,开发具有临床疗效的吸入给药基因疗法已被证明十分困难。近年来,人们对肺部疾病的吸入给药基因治疗项目的兴趣与日俱增,但迄今为止还没有任何产品成功进入市场。为此类项目提供支持的临床前研究对于最大限度地开发成功候选药物至关重要。本文综述了吸入给药基因疗法的各个方面,重点是动物模型的临床前研究。讨论了吸入给药基因疗法的各种障碍,包括气溶胶应力、气溶胶在呼吸道中的行为以及沉积后的处置过程。还考虑了动物模型的重要方面,包括生物相关剂量测定的确定方法以及与可转化性有关的问题。要在临床前动物模型中确定生物相关剂量,就必须采用合适的实验和分析方法。疾病特异性动物模型的进一步发展可能有助于提高未来工作中结果的可转化性,我们期望看到吸入给药基因疗法治疗各种疾病的兴趣加速增长。我们鼓励赞助商、研究人员和监管机构就候选疗法进行早期和经常性的讨论,而临床前方法的进一步传播将对避免常见陷阱具有巨大的价值。
文章亮点
直接向预期作用部位给药是针对肺部疾病的吸入给药基因疗法的一个吸引人的特点,但众多挑战使候选药物的成功开发变得更加复杂。
在用于临床试验之前,临床前研究对于证明安全性和有效性至关重要,但在可转化性等方面存在各种复杂因素。
在进行吸入研究时,个别项目需要采用适合目的的方法来评估动物模型的生物相关剂量。基因疗法的方法(在有效载荷设计和载体配置(如有)方面)差异很大,因此无法对所有计划使用单一的标准化方法。
为了使研究中的测量结果具有生物相关性,分析方法应确定气溶胶中以所需配置存在的疗法比例,以及由于气溶胶压力等原因可变性或受损的数量。
0
引言
过去几十年来,随着对治疗疾病应用的探索和完善,人们对基因治疗方式的兴趣激增。2019 年,美国食品和药品监督管理局(FDA)生物制品评估和研究中心(CBER)预测,到 2025 年,每年将批准 10 到 20 种细胞和基因治疗产品。在 2023 年 4 月撰写本文时,美国已有 28 种 FDA 批准的细胞和基因治疗产品,FDA 最近修改了组织架构,以更好地处理与细胞和基因治疗兴趣扩大相关的越来越多的产品审查。FDA 专门针对基因疗法的指南的制定和定稿可能会进一步加快赞助商、研究人员和监管机构的努力,成功地将基因疗法从概念推向临床。
美国食品药品监督管理局认为,基因疗法是 “通过转录或翻译转入的遗传物质或改变宿主(人类)遗传序列而产生效果的所有产品”,这一宽泛的定义涵盖了方法和技术的巨大多样性。基因疗法的目的通常是向靶细胞传递有效的遗传信息,以纠正失常的细胞机制(如纠正缺陷蛋白质的产生)或表达治疗基因(如通过基因添加产生缺失的原蛋白)。根据作用机制的不同,基因有效载荷可采用多种方式,包括质粒 DNA、信使 RNA(mRNA)、反义寡核苷酸(ASO)、小干扰 RNA(siRNA)、microRNA(miRNA)或适配体。这种有效载荷通常装入适当的平台或载体中,以促进靶细胞的吸收,为此已开发出病毒和非病毒载体。病毒载体利用进化适应性高效进入靶细胞,各种病毒平台主要基于腺病毒、慢病毒和腺相关病毒。病毒载体能非常有效地将基因载荷送入靶细胞,为一些成功的临床基因疗法提供了基础,但也存在一些缺点,包括病毒诱导免疫原性的可能性。作为一种替代方法,人们提出了由天然或合成材料(包括合成和生物聚合物、脂质以及基于脂质或聚合物的纳米颗粒和纳米载体)组成的非病毒载体,其优点和挑战已在文献中讨论。也有可能 “裸体”(不含载体)递送基因疗法,但通常需要对基因载荷进行修改,以提高稳定性并改善靶细胞的吸收。
在美国,基因疗法的产品开发框架与传统药物相同。通过基础研究确定候选疗法后,必须进行临床前研究,以证明概念验证、确定安全性/毒理学,并支持新药研究(IND)申请。如果 IND 申请成功,就可以进行 I、II 和 III 期临床试验,以支持生物制剂许可申请(BLA;基本上等同于新药申请,专门针对涉及生物制剂的疗法)。基因疗法开发框架中每一步的细节都很复杂,而且因产品而异,在使用吸入等非标准给药方式时还会产生更多问题。基因疗法的吸入给药是一个相对小众的领域,因为大多数基因疗法在设计时都考虑了其他给药途径(如静脉注射、皮下注射、玻璃体内注射等)。但也有一些值得注意的例外情况,例如治疗囊性纤维化(CF)的吸入给药基因疗法。在过去的三十年里,人们已经尝试了多种吸入给药的基因疗法,但迄今为止,这些方法尚未产生成功上市的疗法(最近的一种候选疗法 MRT5005 在 I/Il 期临床试验中未能显示出疗效,随后停止了开发)。CF几乎被认为是吸入给药基因疗法的理想靶点,它所面临的挑战表明,即使临床前数据很有希望,也很难开发出成功的吸入给药基因疗法候选药物。
在本研究中,我们将重点放在吸入给药基因疗法的体内临床前研究上。支持安全性和有效性的临床前数据对基因疗法至关重要,而临床前工作中需要确定的一个重要参数是递送到动物模型的治疗材料的剂量。然而,”为药物开发和装置测试而开发的传统和标准化临床前测试方法,往往不适合评估(细胞和基因治疗)产品的安全性”(FDA )。换句话说,在进行基因疗法的临床前工作时,人们往往不清楚什么取样方法或检测方法是合适的,而且过去在小分子药物方面行之有效的方法可能不足以让研究人员、赞助商和监管机构相信某种产品是安全、有效的,值得冒风险进入人体临床研究。因此,本文旨在强调在体内临床前药物开发中对基因治疗进行目的适用性测试的重要性,同时指出该领域目前面临的挑战。
我们首先回顾了吸入给药的一般特点,然后讨论了影响呼吸道吸入给药基因疗法的各种因素和生物障碍。我们还回顾了动物模型的重要考虑因素,以及在临床前环境中确定基因疗法剂量的取样方法和检测方法。然后,我们回顾了洛夫莱斯生物医学研究所(Lovelace BiomedicalResearch Institute)开展的吸入给药基因疗法临床前项目的实例,总结了在这一不断发展的治疗领域开展临床前工作的经验和教训。本综述的重点是吸入给药基因疗法的体内临床前动物模型–临床前工作的其他内容,包括体外细胞和肺芯片模型,已在其他地方进行了综述。
02
吸入给药
用吸入气雾剂治疗疾病的历史悠久。包括支气管舒张剂和抗炎药在内的药用气雾剂被公认为治疗哮喘、慢性阻塞性肺病(COPD)和 CF 等肺部疾病的有效工具。在这些情况下,药用气雾剂可将药物直接递送到预定的作用部位,有助于减少脱靶剂量和相关副作用,同时为患者提供方便、无创的给药方法。药用气雾剂还可以为全身治疗提供途径,因为肺部的气体交换区(即肺泡区)提供了较大的表面积和丰富的血流,可以促进全身循环的快速吸收。气溶胶给药的优势经常被概括为:(i) 直接给药到作用部位,减少治疗肺部疾病时的脱靶剂量/系统毒性;(ii) 吸收迅速;(iii) 由于吸入是一种非侵入性给药途径,因此对患者安全、方便。这些优势使吸入给药基因疗法在治疗 CF 和 alpha-1 抗胰蛋白酶缺乏症等遗传性疾病以及包括哮喘和某些肺癌在内的后天性疾病方面具有吸引力。
吸入给药的优势必须与一系列相关挑战相权衡。首先,对肺部的给药量会因装置和制剂组合的特殊性而变化很大,通常会表现出相当大的受试者之间的差异以及不同患者群体之间的巨大差异(如儿童与成人、健康与疾病等)。呼吸道沉积取决于许多因素,包括解剖结构、疾病状态、气溶胶特性(如粒度、吸湿性)和患者使用特征(吸入情况、与给药装置的配合等)。沉积气溶胶粒子的后续处置受多种因素影响,包括材料特性和气道中自然防御机制的作用。基因疗法制剂的稳定性尤其令人担忧,因为基因疗法有效载荷(和载体,如果有的话)必须在制造和气溶胶化过程中保持完整性,才能在到达靶组织后发挥预期功能–基因疗法和载体的设计和制造方法不在本文研究范围之内,但在其他地方有综述。
2.1.影响吸入给药的气溶胶特性
药用吸入气溶胶是分布在固体颗粒或液滴中的一种(或多种)治疗剂的气载悬浮液。影响药用吸入气溶胶行为的最重要参数之一是固体颗粒或液滴的空气动力学直径 da。空气动力学直径在很大程度上影响气溶胶的物理行为以及呼吸道中各种沉积机制的相对重要性,其中最重要的机制通常是惯性撞击、重力沉降和布朗运动。对于将药物气溶胶递送到人的肺部,一般认为质量空气动力学直径在 1 到 5 微米之间的气溶胶是最佳的,因为这种大小在以下两个方面达到了合理的平衡:(a) 小到足以通过胸外气道并到达肺部;(b) 大到足以在呼气前沉积在呼吸道中。肺内的区域沉积通常在体内被描述为中心沉积和外周沉积(大致相当于导气管和肺泡区域),这也受到颗粒大小的影响,较小的颗粒倾向于更深地渗入外周空隙(尽管考虑到影响沉积的众多因素,也存在例外情况)。由于呼吸道的生理结构和细胞构成会随着从传导气道到外周气道的过渡而发生变化,沉积位置会导致重要的处置差异。人类呼吸道沉积物的特征十分明确,文献中提出了各种沉积模型。
2.2.吸入给药基因疗法的障碍
通过吸入气溶胶进行基因治疗存在许多物理和生物障碍。对候选囊性纤维化基因疗法的临床试验就说明了其中的困难–许多有希望的候选疗法未能显示出临床疗效,这主要是由于向靶细胞转移基因的效率低下。因此,适当考虑可能干扰基因疗法的变异因子至关重要。在此,我们将重点讨论以下方面所带来的挑战:(i) 空气溶解;(ii) 呼吸道解剖学和生理学;(iii) 影响沉积物在呼吸道中的处置(如吸收)的过程。基因疗法的其他重要 “障碍”,包括潜在的免疫原性、插入突变和脱靶效应,已在其他地方讨论过。
2.2.1.气溶胶化
治疗用吸入气雾剂的常见给药装置包括雾化器、干粉吸入器和压力定量吸入器。在探索性研究中,雾化器可能是最容易获得的给药装置,因为它们可以直接将含有治疗剂的水溶液配制成气雾–一般来说,如果可以用治疗剂配制成水溶液或悬浮液,就可以通过雾化产生可吸入的气雾。这种简便性与干粉吸入器(如喷雾干燥、喷雾冷冻干燥、微粉化等)和压力定量吸入器(抛射剂的稳定性)所需的非复杂配方工艺形成了鲜明对比,成功应用这些工艺需要特别考虑遗传物质相对于更传统的非生物治疗剂的脆弱性–参见 Gomes dos Reis 等人关于挑战和方法的讨论。因此,雾化器是临床前基因治疗气溶胶化的合理起点。
有几类雾化器的工作原理各不相同。压缩式喷射雾化器使用高压空气破坏液体制剂流,从而在液体流破裂时产生初级液滴。通常情况下,这些初级液滴太大,无法吸入,因此喷射雾化器通常设计有内部挡板,有助于通过撞击将初级液滴分解成更小的次级液滴。在一个给定的雾化 “周期 “中,只有少量的二次液滴从雾化器中喷出,大量的液体被回收到储液器中–制剂成分在流出装置之前要经过多个雾化周期。撞击喷射雾化器通过两股液体喷射流的碰撞产生液滴,形成不稳定的液体片,随后破裂成液滴。超声波雾化器利用声波振动在配方的气液界面产生表面波,通过波的放大和破裂产生液滴。影响每种类型的基本流体力学过程在文献中都有描述。其中,压缩式喷射雾化器和振动网式雾化器是临床前研究和临床治疗中最常用的雾化器,这些类别的示意图如图 1 所示。
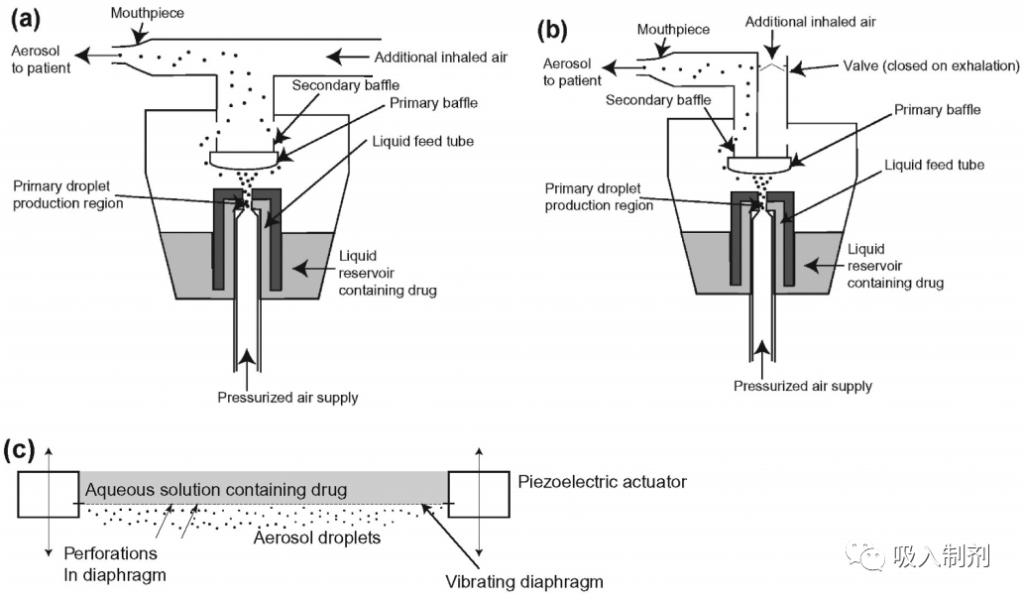
图 1. (a) 传统的无排气喷射式雾化器,通常是一次性雾化器的基础(如Hudson RCI® micro Mist® and Hudson RCI® up-draft II®opti-Neb®; Teleflex Medical,U S.A),(b) 排气喷射式雾化器,所有吸入空气都通过雾滴产生区域(如 AeroEedipse l BAN; TrudellMedical, Canada, and PARI LC® Plus; PARI respiratory equipment, Inc, U.S.A.),以及 (c) 传统的无排气喷射式雾化器。例如 AeroE cdipse l BAN;TrudellMedical,加拿大和 PARI LC® Plus;PARI respiratory equipment,Inc,美国),以及 (c) 网式雾化器,其中快速振动隔膜上的数千个穿孔起到雾化液滴的作用(例如 Aerogen® Solo; Aerogen Ltd., Ireland, and PARl eFlow®; PARlI Pharma GmbH, Germany)。示意图经出版商 Elsevier 许可转载自 Finlay。
从根本上说,每一类雾化器都采用某种方法在液体配方中产生应力,以克服气液界面上的表面张力,从而产生表面自由能大幅增加的液滴(与气溶胶液滴的表面积比本体溶液增加几个数量级有关)。因此,进行雾化的配方会受到应力的影响,从而影响或降低配方成分,而这些应力的大小会随着雾化器的设计而变化。
从历史上看,雾化引起的降解一直是基因疗法的一个主要问题。最初对一些基因治疗产品使用雾化器的研究表明,雾化过程本身可能会造成遗传物质的严重降解。Deshpande 等人发现,在使用 AERx 肺部给药系统进行雾化后,裸质粒 DNA 出现明显降解(通过对从级联撞击器中回收的样本进行琼脂糖凝胶电泳定量),然后证明,改变配方加入阳离子脂质体可保持 DNA 的完整性。Arulmuthu 等人结合使用原子力显微镜、琼脂糖电泳和 PicoGreen 分析法对气溶胶冷凝物样品进行雾化处理,观察到 20kb 裸质粒 DNA 降解严重,但也观察到较小的 5.7 kb 质粒也能保持稳定。Arulmuthu 进一步表明,20 kb 质粒与聚乙烯亚胺(PEI)的复合使气溶胶化成功而不会损坏 DNA。Gomes dos Reis 等人,Lentz 等人最近使用类似的分析方法研究了多聚体和辅料在体外细胞模型中气溶胶递送质粒 DNA 中的作用,发现在部分优化配方的情况下,雾化后的损失程度很小,但可以接受。Lentz 等人观察到 5 kb 和 9.8 kb 质粒在喷射雾化器中的降解情况,最终得出结论:流体动力剪切力是导致降解的机制,并进一步表明,DNA 阳离子剂的复合物可提高气溶胶化过程中的稳定性。同一研究小组后来的一项研究评估了裸质粒和柯斯载体DNA 通过多种雾化器气溶胶化过程中的稳定性,发现非复合 DNA 在气溶胶化过程中的降解程度在不同装置和不同大小的 DNA 上有很大差异。Cataneseet等人研究了0.3 kb至5.3 kb的各种DNA载体在Aerotech II喷射雾化器储液器中的稳定性,发现DNA长度与存活率之间几乎存在临界关系–小于2 kb的载体相对稳定,而长于3 kb的载体在几分钟内就会出现相当程度的降解。Catanese等人的这项研究有一个局限性,即评估降解时使用的是雾化器储液器中的等分样品,而不是雾化器产生的气溶胶样品–因此这项研究的结果可能不能完全代表雾化后DNA的稳定性。
Lengsfeld 和 Anchordoquy 回顾了质粒 DNA 降解的机理。从根本上说,剪切力诱导降解模型的结论是:剪切力场产生的张力会随着质粒分子量的增加而增加,张力的增加会增加降解的可能性(具体情况因假定的 DNA 链机械行为而异)。根据单位长度摩擦力 f、DNA 链长度 L、DNA 链相对于流线 θ 的取向以及应变率 G,可以建立一个简单的模型,将 DNA 链视为一根杆,从而得到施加在 DNA 链上的最大力 Fmax 的如下关系式:

对于给定的流体场,这种关系表明,DNA 链受到的力随其长度的平方而增加–较大的 DNA 分子越来越容易受到破碎的影响,这一点在文献中也得到了证实。实际上,质粒 DNA 的结构要比棒状 DNA 复杂得多,据认为,质粒 DNA 的破碎过程首先是单链断裂,导致构象变化,从原生超卷曲形式变为开放圆环,然后是双链断裂,导致从开放圆环变为线性结构,再从线性结构变为越来越小的片段。实际上,等式(1)并不容易应用于雾化过程中产生的作用力。Arulmuthu 等人描述了对这一模型的修改,可以根据局部应变率估算 DNA 在给定流体场中受到的作用力、其中 μ 是流体粘度,γ 是伸长应变率(由局部速度梯度决定),k 是无量纲常数,其值取决于 DNA 的浓度和固有粘度。这个模型在应用于 DNA 时也很复杂,要考虑未知的和不断变化的构型,但它可以用来估算 DNA 可能承受的最大力(基于原子力显微镜等测量到的长度尺度或理论上的超卷曲长度),这似乎与实验数据基本吻合。
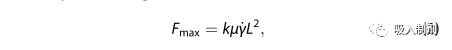
无论具体情况如何,所观察到的 DNA 尺寸增大与碎片化趋势增大之间的关系导致了通过与阳离子剂络合等方式 “浓缩 “质粒 DNA 的方法,从而降低了质粒的有效长度尺度(流体力学直径),减少了特定流体场中的流体力学应力。Arulmuthu 等人发现,将 20 kb 质粒与 PEl 结合可将其特征分子尺寸从 1250 nm 减小到 400 nm,如上所述,这使得雾化器成功实现了气溶胶化。其他研究也证明了这种复合方法在长质粒 DNA 气溶胶化方面的可行性(见上文),Gomes dos Reis 等人对这一领域的其他研究进行了综述。Lentz 等人指出,与阳离子剂复配以提高稳定性的一个潜在缺点是,在细胞核中转染需要去除阳离子剂,如果 DNA 复合物过于稳定,则可能无法在细胞内环境中有效表达基因。重要的是,由于裸 DNA 在进入细胞膜和核膜时的尺寸和电荷相关效率低下,以及在转运到细胞核的过程中会被细胞内的核酶降解,裸质粒 DNA 的转染被认为具有挑战性。一些在临床前模型中评估 DNA 转染的研究发现,与 DNA 复合物或使用非病毒载体相比,裸质粒 DNA 的基因表达较低。总的来说,用裸质粒 DNA 转染虽然并非不可能,但相对于更有针对性的方法来说,效率较低。考虑到 RNA 和 DNA 在机械特性上的差异,在没有实验验证的情况下,直接引申上述框架(即认为许多 RNA 与 DNA 相比体积普遍较小,必然会提高气雾化过程中的稳定性)是不明智的。有人推测可能需要载体来保护 RNA 免受雾化过程中剪切力引起的降解,并提高其在液态储备液中的稳定性,但使用多种雾化器在体外成功雾化裸 siRNA表明情况并非总是如此。虽然还没有发表过通过雾化对 RNA 稳定性进行深入研究的文章,但我们认为在雾化过程中,长 RNA 对降解更敏感是一个普遍趋势,这也是未来工作的一个主题。Chow 等人指出,虽然裸 RNA 经肺部递送后可在肺部转染,但其发生的确切机制尚不清楚,与气道中的裸 RNA 相比,递送载体可能会显著改善 RNA 的转染。
考虑气溶胶压力对病毒和非病毒载体的影响也很重要,这些载体通常用作基因治疗有效载荷的载体。病毒载体在剪切应力和空气-液体界面暴露下会变性、展开、聚集和沉淀(见 Srivastavaet 等人的讨论),从而导致抑制作用,可能会阻碍靶细胞的有效吸收。我们不知道是否有已发表的数据直接评估了雾化对用于基因治疗的病毒载体的影响,其方式允许对类似于质粒 DNA 的损失进行生物学相关的表征(例如,有多少病毒在雾化过程中失活,以及如何减少这些损失?)非病毒载体也会在气溶胶压力下降解,导致脂质纳米颗粒等受损或断裂,在基因疗法中,这相当于在进入靶细胞之前过早释放基因配体。
归根结底,基因治疗有效载荷和病毒/非病毒载体的方法多种多样,这使得先验地确定合适的气溶胶技术变得更加复杂。理想的气溶胶技术是:(a) 使制剂成分降解最小,因为这样可以最大限度地增加递送剂量,使其在给药过程中发挥预期的作用;(b) 患者可以有效使用,同时最大限度地增加给靶组织的剂量。第一个因素的最佳表征可能是在体外进行适合目的的测试(第 4 节将讨论),也有可能结合使用分析和计算技术来估计不同气溶胶技术产生的应力大小。不过,分析和数值方法在这一课题上的应用并非易事,这些方法需要逐一进行实验验证。
2.2.2.呼吸道解剖学和生理学
呼吸道通常根据结构和功能分为三个区域:(i) 由鼻、口腔和喉咙组成的胸腔外区域;(ii) 包含从气管到末端支气管的气管、支气管气道的传导区域;以及 (iii) 包含从呼吸支气管到单个肺泡的肺泡气道的气体交换区域。胸腔气道包括传导区和气体交换区,可以看作是一个树状分支结构,包含大约二十几级气道。影响气溶胶行为和在呼吸道沉积的因素已经有了很好的描述,因此在此仅作简要回顾。
胸腔外气道(口咽或鼻咽喉)是吸入气溶胶的部分过滤器,同时也对吸入空气进行加热和加湿。鼻腔气道中的沉积量高于口腔气道中的沉积量,因此经口吸入是人类肺部给药的首选途径。许多药用吸入气溶胶的胸腔外沉积在受试者之间和受试者内部都存在显著差异,这直接导致肺部总剂量的巨大差异。胸腔外沉积可能是高效肺部给药的主要障碍–体内成像研究显示,根据装置、配方和患者人群的不同,吸入药物气溶胶在口腔-咽喉沉积的平均损失从 20% 到 80%(甚至更高)不等。过去几十年来,人们对影响人体胸腔外沉积的因素的认识有了很大提高,对新制剂和装置的研究也很有前景,这些制剂和装置可以在很大程度上降低了胸腔外沉积量,从而改善肺部给药。
传导气道从气管开始,一直延伸到末端支气管。传导气道有一定的硬度,由平滑肌和软骨以及纤毛上皮提供,纤毛上皮由相对较厚(约 10 微米)的水性气道流体(纤毛周围溶胶)和凝胶状黏液衬里覆盖。沉积的热点可能出现在连续气道级别之间的分叉处,原因是阻塞。根据典型药用吸入气溶胶的体外数据建立的数学沉积模型表明,经口吸入药用吸入气溶胶在传导气道中的沉积量可占到达肺部剂量的 5%至 50%(即未损失的胸外沉积量),这取决于包括呼吸模式和气溶胶特性在内的多种因素。
气体交换区从呼吸性细支气管开始,延伸到肺泡导管和肺泡囊,最后到达单个肺泡。这一区域的功能单元由单个末端支气管的所有子级组成,被称为 “腺泡”。这些外围气腔在呼吸过程中会显著扩张和收缩,成人的功能残余容量约为 3 升,总肺活量约为 6 升。成人肺泡约有 3 到 6 亿个,每个肺泡展开时直径约为 250 微米,为高效呼吸提供了巨大的表面积。肺泡的大小和数量在从出生到成年的发育过程中都会增加,但增加的方式不同:肺泡的数量在出生后的头 2 年显著增加,然后与气道的大小成比例增加。与传导气道相比,气道表面液体形成的肺表面活性物质层要薄得多(约 0.1 um),沉积的物质部分通过肺泡巨噬细胞的作用被清除。
对于吸入疗法,理想的做法是尽可能直接针对预期作用部位进行沉积,因为脱靶剂量会浪费治疗药物,并可能产生有害的副作用。在基因疗法中,靶细胞可能存在于整个肺部,也可能根据疾病的不同,在特定区域分布较多。例如,CF 是由编码 CF 跨膜传导调节器(CFTR)蛋白的基因突变引起的。CF 在多个器官系统中都有表现,但其对肺部的影响尤其令人担忧,因为肺部气道表层的脱水会阻碍黏膜纤毛的通畅,阻塞气道,并使病原体感染得以建立。人体气道内壁的各类细胞表达不同水平的 CFTR,在人体浅层气道上皮细胞中,CFTR 表达的一般顺序分别是分泌细胞、基底细胞、离子细胞和纤毛细胞。虽然成功的 CF 基因疗法可能需要恢复多种细胞类型的 CFTR 功能,但主要靶点似乎是位于后支气管区域的气道分泌细胞(杯状细胞和棒状细胞)。我们可以假设,向气管支气管气道靶向给药(即最大限度地增加该区域的沉积剂量)可能会有利于 CF 的治疗,但很难获得靶向区域沉积的直接证据。
2.2.3.处置
沉积后,吸入给药基因疗法必须穿透自然防御机制才能进入靶细胞。如图 2 所示,这些机制的性质随着进入肺部的深度而变化,并取决于局部组织学和生理学。
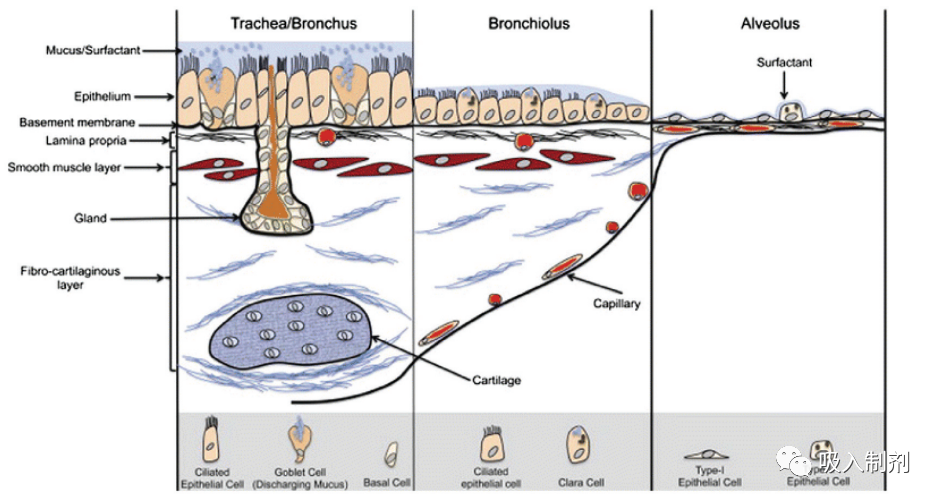
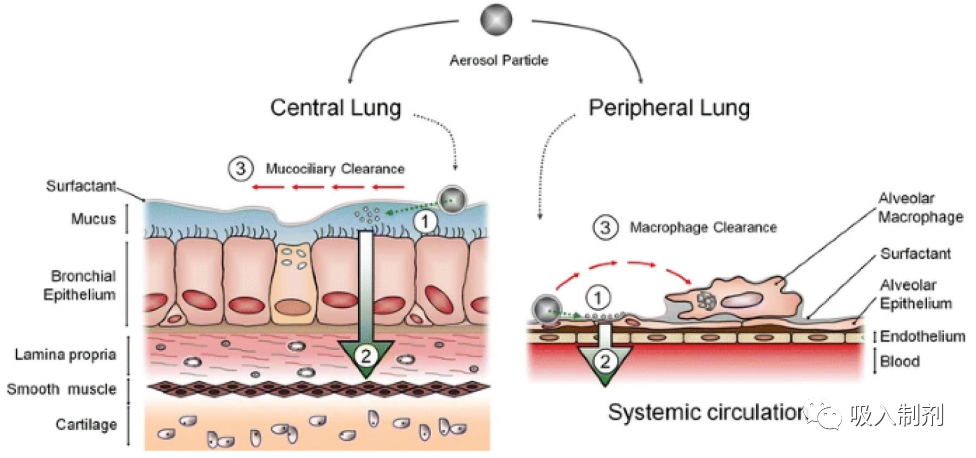
图 2. 人体呼吸道组织学和结构(上图)以及沉积物的清除机制(下图)。下图中,数字表示一般处置过程:(1) 初始沉积,(2) 穿过肺上皮,(3) 清除。图根据开放存取许可协议从 Hastedt 等人处复制,由出版商施普林格提供。
传导性气道的一个主要障碍是黏液循环和黏液层本身。Schürch 等人的研究表明,沉积在黏液层顶部的颗粒可能会通过表面张力被自然地吸入黏液层本身。在传导性气道中,被吸入黏液层的沉积物会渗透到下层的纤毛溶胶中,与纤毛和多种活跃的免疫防御系统密切接触。通过黏液层的渗透可能会受到疾病的影响(考虑到 CF 和慢性阻塞性肺病会导致黏液层增厚和粘度增加),这是针对气道上皮细胞的基因疗法的必要条件,可以通过各种策略促进这种渗透,包括使用黏液溶解剂或黏液渗透纳米颗粒。在肺泡区域,沉积物似乎会被表面活性物质薄膜完全润湿,同样有效的先天防御系统,尤其是肺泡巨噬细胞,可保护肺部免受异物侵袭。表面活性物质与沉积物的相互作用(如在纳米颗粒上形成 “蛋白质冠”)可进一步影响处置。
在上述细胞外屏障之后,基因疗法的下一个障碍是气道上皮细胞本身。相邻细胞之间的紧密连接复合体调节着气道上皮细胞顶层和基底层之间的物质转移。基因疗法必须进入上皮细胞才能传递基因载荷,而许多常用的病毒载体的靶受体只存在于紧密连接下面的基外侧表面。在这种情况下,紧密连接会阻止病毒载体进入靶受体,导致转导效率降低。有人提出,脂质纳米粒子等的被动靶向作用是由于纳米粒子表面被内源性生物大分子包覆,从而改变了纳米粒子与免疫系统和靶组织的相互作用。这种被动效应可能是一些研究中观察到的裸 RNA 在肺组织中成功转导的原因,但这一过程的确切机制仍不清楚。主动靶向可通过在基因治疗平台中加入受体特异性配体、抗体或肽来实现。
03
动物模型
大多数吸入给药装置都是专门为人类成年患者的经口吸入而设计的。动物显然无法按预期使用这些装置,因此在修改给药方法以适应动物气雾给药时必须采取一些自由措施。动物模型本身也会影响适当吸入暴露系统的选择,啮齿类动物通常使用纯鼻或全身暴露室,而大型哺乳动物则使用头罩或面罩。用于各种动物模型的吸入暴露系统在文献中有详细描述,几十年来一直用于吸入毒理学研究和药物开发。因此,这里的讨论仅限于与基因治疗产品相关的几个要点。
3.1.装置、给药效率和肺部剂量
第 2.2.1 节指出,雾化器是基因治疗产品临床前评估的典型起点,因为与干粉吸入器等产生气溶胶的方法相比,雾化需要的配制步骤更少。雾化器在临床前工作中还有一个优势,那就是在许多吸入暴露保证系统中,可直接使用与人体患者相同的装置来产生气溶胶,而不像干粉吸入器那样,临床前研究中的气溶胶产生通常需要使用旋转喷射发生器等装置。使用相同的雾化器-制剂组合进行临床前和临床研究,可以对雾化后的活性进行临床量化,这是基因疗法的一个主要关注因素。
实验人员必须认识到,对于标准的临床前暴露系统而言,给药效率或动物可吸入的药物量(给药剂量)相对于气溶胶发生装置的装载量通常很低。这是由多种因素造成的,包括系统组件内表面的沉积损失,以及必须保持足够的气流以满足系统中所有动物的每分钟呼吸容量(RMV)。不同动物物种和人类呼吸道沉积的差异加剧了这种低递送效率。在必须用鼻子呼吸的动物物种中,胸腔外沉积量通常大大高于人类经口递送时的沉积量,而到达肺部的相应剂量要低得多。目前在动物模型中预测肺部剂量的做法是对给药剂量应用物种特异性 “沉积因子”。肺部剂量(DD,单位为[毫克/千克])的计算公式为
![]()
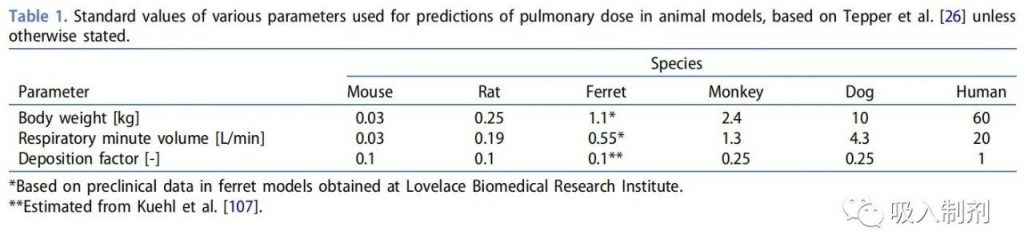
其中,C 是吸入空气中的药物浓度,单位为[mg/L];RMV 是每分钟呼吸容量,单位为[L/min],可通过体积描记法或通过与体重的异速生长关系来估计;D 是暴露持续时间,单位为[min];DF 是沉积因子[无单位];BWT 是体重,单位为[kg]。表 1 列出了部分动物模型的标准沉积因子和体重。所报告的沉积分数应被视为不同物种之间肺剂量估计值定量比例的近似值,而不是严格的定量值。
对于基因疗法来说,重要的是以生物相关的方式对浓度进行量化(见第 4 节的讨论)– 例如,仅靠重量测量无法提供关于试验系统中可能失活或变性的治疗药物比例的信息。基因疗法的剂量最好用 DNA 或 RNA 拷贝数、病毒拷贝数或斑块形成单位等单位来表示,而不是用试验品的毫克数来表示,并对等式 2 中的浓度单位进行适当调整。此外,虽然体重是用于计算动物特定人剂量的典型归一化因子,但其他归一化因子–包括肺重量、与身体、传导气道、肺气腔或鼻腔相对应的表面积以及气道表面液体体积–可能与某些疗法更为相关。当需要测量 “局部剂量”以量化某些组织的毒性时,这一点尤为重要(例如,在仅用鼻吸入时,通过鼻腔表面积来确定沉积在鼻腔内的剂量比通过体重或肺重量来确定更好)。确定适当的剂量表达式是一个针对具体项目的过程,可能需要对剂量进行多重量化,以评估安全性和毒性。
吸入暴露系统达到特定剂量所需的测试物用量比其他给药途径所需的用量要多(通常是 10 倍或更多):例如,Nadithe 等人的研究表明,小鼠仅在鼻腔暴露室中获得的平均剂量是加入雾化器中剂量的 0.108%,只有 0.0087% 沉积在肺部(相当于小鼠体内剂量的 8.19%)。与其他暴露途径相比,一般需要大量的试验品,这在体内临床前吸入研究中是一个基本未解决的问题,特别是在基因疗法中,因为基因疗法的制造并不简单。
3.2.可转化性
用于基因疗法临床前研究的动物物种应 “显示出对研究(细胞和基因疗法)产品的生物反应类似于人类预期的反应,以便产生数据指导临床试验设计”(FDA)。这可能是一个挑战,因为许多基因治疗靶点在传统动物模型中可能没有类似的基因型或表型。在某些情况下,包括 CF,可以开发特定疾病的动物模型,以便在临床前试验中更好地模拟人类疾病。CF 雪貂模型在最近的研究中受到越来越多的关注,我们在表 1 中列出了对临床前数据可转化性有用的雪貂特异性参数估计,以解决文献中缺乏此类数据的问题。
已发表的有关基因疗法肺部给药研究的动物模型包括小鼠、大鼠、兔、猪、非人灵长类动物、羊和马。许多模型都采用了气管内给药技术,包括灌注(通过移液管)或喷雾(通过宾夕法尼亚世纪公司生产的微型喷雾器等)。这两种技术都不被认为是与吸入相同的暴露途径,因为当一种物质以液体形式(通过灌注)或以大液滴喷雾形式直接进入肺部时,肺部沉积和处置会出现相当大的差异。一些数据表明,与吸入相比,这种气管内栓塞给药系统可能需要给药更大的剂量,才能使某些疗法达到类似的肺部基因释放效果–Bush 等人的初步研究表明了这一点。
在 CF 大鼠模型中发现,只用鼻子吸入一种基于 RNA 的新型上皮钠通道(ENaC)抑制剂所需的剂量是气管内给药剂量的十分之一,才能达到等效的全肺 ENaC 表达阻断效果,这可能是由于药栓给药所获得的肺沉积物具有高度异质性。气管内给药方法通常用于早期概念验证研究,但应注意其与吸入给药的内在差异。基因疗法临床前研究结果的转化和解释并非一蹴而就–文献对这方面的挑战进行了很好的讨论。Cheever 及其同事强调了适合目的的研究设计的重要性:动物模型的其他要素,包括通过病理学对生物分布进行深入分析,可以描述人体试验中无法复制的非靶向给药效应。然而,生物分布必须仔细考虑其趋向性。正如 Ramamurthy 等人所评论的,病媒的趋向性受血清型特异性相互作用的制约,不同物种之间可能存在很大差异。因此,尽管临床前研究对于评估基因疗法的安全性仍然至关重要,但在解释结果时必须非常谨慎。
脱落数据也可帮助评估临床前计划中的风险,特别是对于尚未在人体中使用过的新型疗法,但由于上述类似原因,动物模型中的脱落不能替代对人体脱落的研究。归根结底,仍然需要更好地理解和描述基因治疗产品非临床数据的可转化性,特别是在新开发的动物模型中,吸入气溶胶的沉积和处置仍有待评估。
04
分析方法
传统的气溶胶疗法受益于《美国药典》(USP)等文献中描述的成熟的采样和化验分析方法。另一方面,基因治疗气溶胶通常需要开发适用的收集和分析方法。然后,根据等式 2 可以估算出递送到模型中的剂量,如前所述。由于每个基因治疗项目都是独一无二的,因此下文将详细介绍过去曾使用过的方法,以及该领域专家为支持基因治疗气溶胶表征而调整过的方法。
4.1. 气溶胶浓度和粒径分布
收集标准气溶胶的方法已有详细描述。对于气溶胶浓度,通常使用过滤介质从动物模型呼吸区的暴露系统中收集一部分气溶胶。然后,可通过非特异性方法(即重量差异分析)或特异性方法(例如,用适当溶剂萃取,然后用高效液相色谱法分析特定化合物)对过滤器进行分析–此类方法类似于药典中描述的化学和制造控制(CMC)测试方法。理想的过滤器可以在取样过程中 100% 捕获颗粒,便于回收材料进行化学/生物化验,并在合理的取样时间内(大约几分钟)避免产生大的压降。实际上,不同材料的过滤介质(例如由硼硅玻璃、石英、纤维素或其他材料制成的纤维过滤器;由聚醚砜(PES)、聚四氟乙烯(PTFE)、聚四氟乙烯或其他材料制成的膜过滤器)会在这些因素之间取得平衡。有时,液体收集系统(如玻璃熔块撞击器、生物采样器等)也用于收集具有生物活性的气溶胶,包括细菌、病毒和孢子,因为直接在液体介质中收集可避免生物材料干燥以及过滤器可能导致的活力丧失。不过,在考虑通过在液体介质中收集而减少干燥的同时,还应该考虑到通过诸如撞击射流效应、收集介质中的湍流运动或长时间反复暴露于动态空气-水界面(“气泡”)等方式引入的额外剪切力,这些影响可通过尖峰回收试验进行评估。在其他情况下,某些分析终点可能需要使用冷凝水。类似于 Cipolla 等人之前发表的方法可适用于非临床递送系统,以确保不会对分析造成假象。
就粒度分布而言,级联撞击器测量是监管方面的标准,在文献中有详细描述,便于定期进行性能验证和确认。药典中明确规定了雾化气溶胶级联撞击器测量的标准方法。这些方法涉及口罩出口处雾滴大小的测量,并建议在 15 升/分钟的恒定流速下使用下一代撞击器,并将其冷却至约 5°C,以减少通过撞击器本身时因蒸发而对测量雾滴大小造成的人为偏差。在临床前暴露系统中对雾化气溶胶进行级联撞击器测定的适当方法可能会有所不同,这取决于适当的流速和动物呼吸区气溶胶的性质。其他粒度测定技术(飞行时间、光散射等)的设计通常无法满足非临床研究的监管需求,因此只能用于补充分析而非主要分析。在临床前工作中,粒径的典型目标是 1 到 5 微米之间的 MMAD–这是一个宽容度较高的粒径范围,在使用现代雾化器的暴露系统的呼吸区比较容易获得(不过,一个项目的粒径范围应根据项目的需要进行细化)。大部分挑战在于以生物相关的方式定义和测量气溶胶浓度。
4.2. 样品分析
在任何气溶胶递送计划中,气溶胶浓度的表征都是一个关键的终点,但具体到生物气溶胶递送(包括基因治疗),气溶胶还必须考虑到材料的总量和材料的活性。如果基因治疗是在载体(病毒、非病毒或其他)中进行的,则还应在气溶胶产生后对气溶胶的封装或完整性进行鉴定,以评估用于气溶胶化的技术是否会导致不可接受的高损失。
遗传物质的定量方法多种多样,常见的有紫外法(HPLC/UPLC)、聚合酶链反应(PCR;其变体包括实时定量 PCR 和液滴数字 PCR)、荧光检测法(如 PicoGreen 和 RiboGreen)以及凝胶电泳法。选择最合适的方法受到所需的范围、特异性要求以及设施所能获得的装置的影响。
对于病毒载体,病毒定量方法(如 TCIDso、斑块检测法)可对功能性病毒进行定量,而辅助的 PCR 方法则可估算样本中病毒基因组的总拷贝数。这些定量的比率可用于评估气溶胶等对载体活性的影响。
对于非病毒载体,应测定封装效率,以评估载体颗粒的完整性和基因载荷的过早释放。对于 LNP-mRNA 疗法,荧光检测法可与表面活性剂(如 Triton-X100 )结合使用,通过比较表面活性剂处理过的样本和未处理样本中的 RNA 含量(或适当的示踪剂)来评估封装效率。在这种方法中,假定在未处理样品中测量的 RNA 含量代表游离(未包被)RNA,而在经表面活性剂处理的样品(未包被样品)中的 RNA 含量代表总 RNA 和包被 RNA。
4.3. 吸入给药基因治疗药物开发的项目实例
在本节中,我们将重点介绍乐福里斯生物医学公司(Lovelace Biomedical)为支持吸入给药基因疗法而实施的部分临床前项目的高层次细节,这些项目尚未在文献中全面发表。由于这一不断发展的领域中的许多工作基本上都是专有的,因此我们对每个项目的讨论都很有限。在此,我们旨在确定在表征临床前吸入给药基因疗法方面有前景的技术,以鼓励继续开发和公开讨论最佳实践。此外,这些细节还强调了确保每个系统都有适当的气溶胶产生、气溶胶特征描述和基于方法开发数据的定量方法的重要性。
4.3.1. 使用新型病毒载体的小鼠模型
为评估安全性,对小鼠模型进行了一项吸入递送复制缺陷 HSV-1 载体的研究,载体的有效载荷是针对 CFTR 缺陷的。在吸入暴露中,使用 Aerogen Solo 振动网状雾化器将试验品雾化到鼻腔暴露室中。暴露系统呼吸区的气溶胶采样使用了两种类型的过滤器:(a)玻璃纤维过滤器和(b)聚醚砜(PES)膜过滤器。玻璃纤维过滤器通过重力测量法测量气溶胶的总浓度,但由于提取效果不佳,不适合对测试物进行进一步化验。PES 膜过滤器对测试物的回收率令人满意,可通过 qPCR 和病毒滴度斑块化验进一步鉴定其活力。这种组合可以定量确定,通过气溶胶化、在暴露系统中的转运以及从 PES 膜过滤器中的回收,病毒的活力损失约为 30%。
4.3.2. 使用 AAV 载体的雪貂模型
对雪貂进行了一项研究,以评估一种新型 AAV 载体的药理学和安全性,该载体的有效载荷通过仅鼻子吸入的方式靶向 CFTR 表达。对于 AAV 载体,使用 Aerogen Solo 振动网雾化器在标准的非临床纯鼻吸入暴露系统中产生试验品气溶胶。在方法开发过程中,这种雾化过程对载体的影响(即 在方法开发过程中,通过将气溶胶直接雾化到浸入冰中冷却的 15 毫升 Falcon 型试管中,量化了雾化过程对载体的影响(即载体滴度、完整性、聚集性和感染性),从而得到液体样品(通常称为冷凝液、 由独立的第三方实验室通过基于细胞的效价测定法检测存活率,通过 ddPCR 检测基因组滴度,通过大小排阻色谱法检测聚集度。其他直接检测雾化后样本的方法,包括铜质和玻璃凝结器以及过滤器收集,都显示分析方法的回收率不足。在研究中,我们使用玻璃纤维过滤器测量了气溶胶的质量浓度,同时通过对从呼吸区采集的玻璃纤维撞击器样本进行 ddPCR 分析,确定了气溶胶中 AAV 的基因组滴度,如图 3 所示。
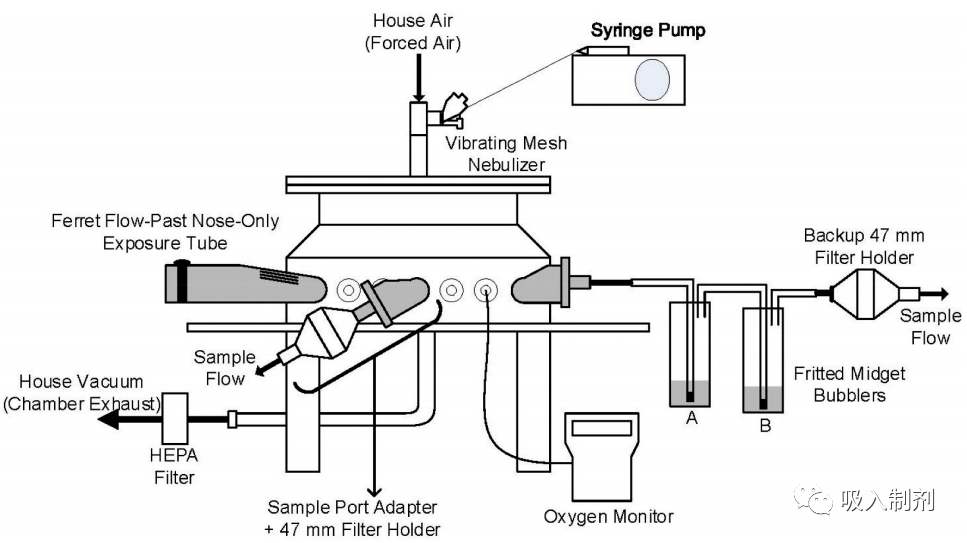
图 3. 雪貂纯鼻吸入暴露室的详细示意图。暴露室包含多个相同的端口,其中大部分用于直接连接动物暴露管。其余的端口用于测量气溶胶的特性,这些气溶胶代表了系统中提供给每只动物呼吸区的气溶胶。使用两个串联的玻璃熔块撞击器可以量化试验品的捕获效率。
在一系列非 GLP 和 GLP 药理学和毒理学研究中使用了这种适用的暴露系统和分析方法。这些方法在方法开发确定的范围内进行了可行的验证。
4.3.3. 使用 AAV 病毒载体的非人灵长类动物模型
在非人灵长类动物中进行了一项研究,以评估基于 AAV 病毒载体和 CFTR 转基因有效载荷的安全性和转基因表达。该计划的一个关键因素是试验品的可获得性有限,这就需要使用一种设计用于直接递送到非人灵长类肺部的系统。为此,我们使用了颊内管通气系统,并结合市场上销售的喷射雾化器,将试验品递送到麻醉动物体内。一项小型试验研究证明了使用该系统进行肺部给药的可行性,该研究使用伊文思蓝染料作为替代气溶胶示踪剂,结果表明染料广泛分布于每个肺叶的传导气道和外周气腔。这种装置的独特性排除了同时进行气溶胶采样和暴露的可能性。相反,我们对给药系统所有组件的冲洗液进行了测试前和测试后的重量测量和 qPCR 分析,以通过质量守恒估算暴露期间给动物的剂量。与典型的临床前吸入暴露系统相比,这种方法可使约 45% 的名义剂量进入动物肺部。该系统和方法已通过验证,可支持 GLP 毒理学研究,为监管部门的申报提供支持。
05
结论
本综述侧重于基因疗法的吸入给药,尤其关注临床前研究。综述了吸入给药的一般特点,以确定与其他接触途径相比的优势和挑战:吸入给药可改善针对肺部疾病的治疗药物的靶向剂量,但在剂量方面存在相当大的不稳定性,在配方方面也存在挑战。吸入给药基因疗法(生物和非生物性质)的障碍包括呼吸道本身的解剖结构、可能影响载体和基因有效载荷完整性的气溶胶应力,以及呼吸道的自然防御机制,包括黏膜纤毛清除和肺泡巨噬细胞。吸入动物模型的临床前研究是在人体使用前确定安全性和有效性的一个重要组成部分,它得益于吸入毒理学和药物学方面的长期研究,在这些研究中描述了特性良好的暴露系统。此类系统的一个缺点是,与其他暴露途径相比,递送效率通常较低,因此需要比通常假设的更多的试验粒子。
尽管界定基因疗法的 “剂量 “需要仔细考虑生物相关性,但目前已有估算动物模型剂量的标准化方法。可转化性仍然是基因治疗计划的一个重要讨论领域,目前,我们怎么强调适合目的的研究设计的重要性都不为过。临床前研究的一个重要方面在于建立适当的分析方法,以确定不同动物模型的生物学相关剂量。在确定可能出现损失的部位以及是否可以通过以下方法解决这些问题时,DNA 或 RNA 纯度、病毒载体感染性和非病毒载体完整性的鉴定方法非常重要,例如使用不同的气雾剂。基因有效载荷设计和载体特征(如果存在)方面的方法多种多样,这意味着没有一种放之四海而皆准的分析方法能满足每项基因治疗计划的要求。相反,先期针对特定研究进行仔细的方法开发,可以提高临床前研究获得的数据质量,降低 I、II 或 III 期试验失败的风险。
06
专家意见
基因治疗方法具有令人兴奋的潜力,可以极大地改善我们对疾病的理解和治疗。过去几年来,基因治疗项目的数量不断增加,最近监管机构专门针对基因治疗的指导意见的最终确定可能有助于加快基因治疗项目的进程,从而成功地将产品推向市场。监管机构鼓励申办者通过 INTERACT(CBER 产品监管建议的初始目标参与)和 Pre-IND(或 Pre-BLA)会议等项目及早参与定期对话,研究人员、申办者和监管机构都非常希望基因治疗项目(吸入或其他方式)取得成功。在治疗呼吸道疾病时,吸入给药气溶胶可以直接给药到预定的作用部位,减少脱靶剂量和相关的有害副作用。基因疗法的潜在疾病靶点包括囊性纤维化(CF)、α-1 抗胰蛋白酶缺乏症、哮喘和某些肺癌。尤其是 CF,在过去几十年中,已成为众多吸入基因治疗计划的目标。遗憾的是,与其他暴露途径相比,以吸入给药为目标的基因疗法的开发更为复杂。尽管效果显著,但迄今为止,治疗 CF 的候选吸入给药基因疗法仍未能进入市场,原因往往是尽管临床前工作很有希望,但人体试验结果却令人失望。
CF 所遇到的挑战表明,通过基因治疗气溶胶治疗疾病存在许多生物和其他方面的障碍。主要的考虑因素包括:气溶胶应力会使治疗成分降解;呼吸道结构对气溶胶沉积的影响会限制到达特定相关区域的剂量;呼吸道的自然防御机制(包括传导气道的黏膜纤毛清除和外周气道的肺泡巨噬细胞)会清除或分解滞留在肺部的异物。使问题更加复杂的是基因有效载荷设计的各种方法和(如果存在)载体特性。
许多体外方法都可以量化雾化过程中发生的降解程度。许多项目已经成功地对基因治疗产品进行了雾化处理,损失极小,早期的方法开发工作可以确定特定配方-装置组合是否能保持基因治疗所需的完整性。对于特别敏感的配方,吸入疗法将受益于未来对雾化器和其他给药装置的优化,以减少气溶胶应力。
关于呼吸道解剖和气溶胶沉积,区域沉积在人类身上有很好的特征,但在许多动物模型中却没有。目前,最佳做法是使用依赖于物种的沉积分数来估算肺沉积,而不考虑颗粒大小的细微影响,因为这是一种略显粗糙但透明且可重复的方法。通过将数值沉积模型与研究中的粒径测量值以及特定动物的测量值(如每分钟呼吸容量和体重)结合起来,也许可以改进动物模型中的肺沉积估算,这仍是未来工作的一个主题。同样重要的是,要认识到通过气管内栓塞法(即气管内液体注射或气管内大液滴喷雾)与传统的吸入可吸入气溶胶法进行肺部给药的基因疗法之间的差异–这些不同的给药方法在区域沉积和分布上可能会影响临床前研究的观察结果。继续改进克服呼吸道生物障碍的措施(如通过黏液溶解剂、黏液穿透纳米颗粒、被动和主动细胞靶向等)将是许多候选疗法的重要步骤。考虑到动物模型的临床前观察结果与人类患者的预期行为之间的可转化性,这仍然是一项极具挑战性的任务,而替代方法(如芯片肺、体外细胞模型)可以提供宝贵的补充信息。针对特定疾病的动物模型,如 CF 雪貂和猪,也有助于提高各种基因疗法临床前研究的可转化性。
临床前研究可以对接触过程中的气溶胶特性进行深入分析,主要考虑对动物呼吸区的治疗剂浓度进行生物学相关测量。因此,分析方法应旨在评估处于理想状态的基因治疗量与因气溶胶等应力而变性的基因治疗量。文献中已介绍了各种表征 DNA 或 RNA 纯度、病毒载体感染性和非病毒载体完整性或包封效率的方法。目前,吸入给药基因疗法作为药物开发领域的新生事物,意味着各个基因疗法项目都受益于适用方法的开发,以建立适当的气溶胶、取样和样本分析技术。根据我们的经验,为特定平台开发的成功方法往往适用于后来在同一载体上迭代的类似疗法研究,这表明未来至少在某些基因治疗产品子类别(如确定 LNP 平台的封装效率)上,标准化药理学类型方法具有一定的潜力。
遗憾的是,吸入给药基因疗法的临床前研究在文献中的描述仍然略显不足,这可能是由于该领域刚刚起步。我们鼓励研究人员和赞助商发表吸入基因治疗产品临床前评估中使用的方法和技术,以帮助完善未来吸入基因治疗项目的实验设置和分析。我们预计,未来几年人们对以吸入给药为目标的基因治疗产品的兴趣会越来越大,更多地识别有前景的方法或不幸的死胡同可能会大大增加将成功的疗法推向市场的机会,同时避免代价高昂的陷阱和冗长的研究。
资料来源
1.公众号吸入制剂
https://mp.weixin.qq.com/s/NO43eWS9M9c0AmT23-Ro0w
