目前,利用基于核酸酶的同源定向修复途径(例如,CRISPR-Cas9)可以精确校正基因突变,从而达到治疗疾病的目的。利用CRISPR/Cas技术能够进行细胞水平和动物水平的单基因或多基因的组成型/条件性/组织特异性敲除,敲入或定点突变。其原理是Cas蛋白通过导向性RNA (guide RNA,sgRNA) 识别特定基因组位点并进行剪切。
来自麻省大学医学院的Sukanya Iyer研究团队发现了一种基于核酸酶诱导双链断裂(DSB)的治疗方法来精确校正基因突变,该方法利用微同源末端连接(MMEJ)途径精确校正由微复制产生的移码突变(串联重复)。作者推断基于MMEJ途径,在致病微生物复制的中心附近,核酸酶诱导的双链断裂(DSB)损伤修复将实现对野生型基因组序列的精确校正。该策略可能是同源定向修复基因校正方法的有效替代方案,并且不需要共同递送供体DNA。此外,恢复的野生型序列将不再与靶向微复制的导向RNA(sgRNA)互补,即使在Cas9核酸酶存在下也能稳定地校正。
这项重要的工作发表在2019年4月3号的Nature Letter上面。

结果
微同源末端连接(MMEJ)是易出错的双链断裂(DSB)DNA修复途径。这种突变过程由于产生缺失基因,导致一个重复序列和中间区域的丢失(图1a)。
作者通过肢带型肌营养不良症2G(LGMD2G)和 Hermansky–Pudlak综合征(HPS1)这两种常染色体隐性遗传疾病的基因修复来评估基于MMEJ校正策略的功效。这两种疾病影响着人体的不同组织,其原因涉及不同长度的病原微生物。这两种疾病都是常染色体隐性遗传,在不同的人类亚群中表现不同,目前没有治疗方法。在LGMD2G患者中发现一种疾病等位基因在TCAP的外显子1中具有8bp的重复,这种突变在东亚人群中被发现,频率约为千分之一。TCAP编码视松蛋白,是一种19kDa心脏和横纹肌特异性结构蛋白。TCAP中的纯合子或复合杂合子失活突变,可以表现为严重的肌肉萎缩和心肌病,通常好发于青春期后期到成年早期。
作者为SpCas9设计并测试了一种sgRNA,从而产生一个远离TCAP 8bp微复制中心的DSB碱基对(图1b)。观察到基因编辑约80%的插入率,表明SpCas9(RNP)可以在该位点有效地产生DSB。对序列突变的检查发现,平均约57%的等位基因有对应于野生型等位基因精确的8bp缺失(图1c)。当引入含有功能性TCAP的野生型细胞时,SpCas9 RNPs不会编辑TCAP的等位基因,表明在突变细胞中校正后的等位基因不会受到MMEJ介导修复的损伤(图1c)。由核酸酶处理的LGMD2G IPS细胞产生的22个克隆基因分型显示,至少77%含有一个野生型等位基因,表明大多数核酸酶处理的细胞都会被校正(图1d)。
为了证明在肌肉类型的细胞里的可译性,作者将LGMD2G IPS细胞诱导分化成增殖的骨骼肌成肌细胞,诱导其分化成肌管。IPS细胞衍生的成肌细胞可以与肌原性卫星细胞相似的方式修复受损肌肉(肌病基因治疗的主要焦点之一)。将SpCas9 RNPs电转进成肌细胞,编程靶向8bp微复制。编辑后,约45%的等位基因被精确修复回野生型序列(图1e)。
总的来说,这些数据表明,引入接近微复制中心的DSB,可以实现IPS细胞和成肌细胞与LGMD2G相关的8bp等位基因的精确校正,证明成肌细胞可以在体内进行靶向治疗。
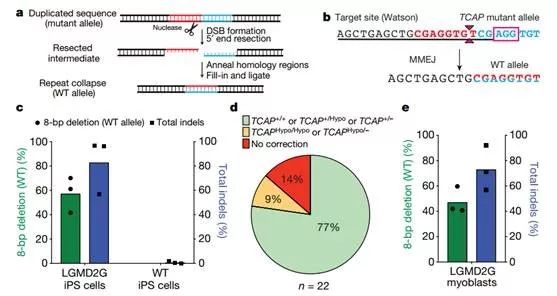
图2. MMEJ的修复途径有效且精确地校正含有16-bp微复制HPS1的等位基因
为了研究DNA修复因子(PARP-1)是否可以影响MMEJ修复效率,作者使用了卢卡帕尼来抑制DSB通量的DNA修复因子(PARP-1)活性。在SpCas9 RNP处理前后,用10μM或20μM卢卡帕尼处理源自患者的HPS1 B-LCL细胞发现,可以显著抑制MMEJ介导的DSB修复(图3a)。在卢卡帕尼处理后,HPS1基因的编辑率总体降低(图3b)。16bp缺失产物的减少导致了较低的编辑率,在未用卢卡帕尼处理的细胞中约50%降低,分别用10μM和20μM卢卡帕尼处理细胞后约降低至15%和6%(图 3b-d)。因此,MMEJ通路是LGMD2G和HPS1微复制,在靶向DSB存在下进行稳健校正的基础。
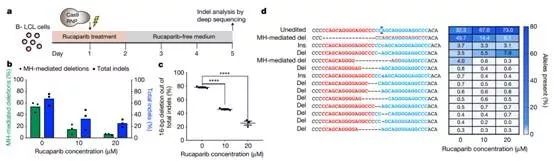
图3. 对PARP-1的抑制能够降低MMEJ修复效率
为了测试MMEJ修复途径的重复折叠有效序列的长度范围,作者进行生物信息学分析,以鉴定人类基因组中长度为4bp至36bp的非致病性,独特的内源性微复制(图4a)。检测了HEK293T细胞中,由SpCas9产生的DSB,在这些位点微复制中心产生的微生物折叠的效率。尽管这些目标位点的编辑率不同,但发现,无论微复制长度如何,重复折叠都是编辑等位基因中的主要终产物(范围从45%到93%)(图4b)。与HPS1位点的分析一致,切割位点在远离中心时发现微复制重复折叠效率被降低,其长度为24和27bp。
作者通过比较SpCas9和LbCas12a核酸酶在三个内源性位点产生的微复制折叠效率,分析了LbCas12a产生的断裂是否可以通过切除依赖性途径(例如MMEJ)进行优先修复。LbCas12a可以在这三个内源性位点实现有效的重复校正(50-90%编辑的等位基因),效率与SpCas9类似(图4c)。总的来说,这些数据表明,使用Cas9或Cas12a可编程核酸酶的MMEJ编辑方法可以折叠长度不少于36bp。
为了评估种基于MMEJ治疗策略在纠正人类遗传疾病方面的潜力,作者进行了生物信息学分析,评估人群中引起疾病的微复制。作者专注于长度范围为2到40bp的重复序列,数据表明,通过MMEJ途径可以预先修复该范围内的微观同源性(图4)。分析产生了143个可能引起疾病的微复制,长度为2-40bp。基于MMEJ的方法可以更有效地纠正导致疾病的微复制。
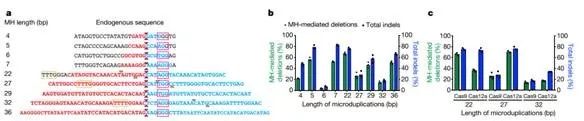
图4. 基于MMEJ的方法有效地实现了不同重复长度内源微生物的精确折叠
大多数基因组位点的DSB主要通过NHEJ途径进行修复,这可能在不精确修复期间产生小的插入或缺失。作者的数据跨越12个序列中的DSB,表明通过MMEJ途径可以优先修复微复制。对于这类致病突变基因,通过MMEJ途径精确修复,为同源定向修复提供了有效的替代方案。MMEJ介导的修复最近被用于有效地纠正与HPS130相关的病原微复制。
随着人群基因组和表型数据的不断增加,我们会发现可以使用这种基于MMEJ的方法纠正新的病原微复制。虽然MMEJ途径的分子机制和细胞类型特异性仍有待完全阐明,但作者研究结果为寻求基于MMEJ的LGMD2G,HPS1治疗方法和更广泛的基于微复制的疾病奠定了基础。这种基于MMEJ的治疗策略的简单性,可靠性和有效性有利于开发基于核酸酶的基因校正疗法,从而达到治疗与微复制相关疾病的目的。
