图片来源:CDE官网
nAMD是一种严重影响视力甚至会导致失明的不可逆转的眼科疾病,以黄斑区脉络膜新生血管(CNV)或视网膜新生血管为主要病理特征,同时可能伴有视网膜水肿以及视网膜渗出、出血、瘢痕等改变,血管内皮生长因子(VEGF)已被证实在nAMD新生血管形成中具有重要作用。目前,湿性年龄相关黄斑病变已成为继青光眼、白内障之后全球第三大致盲因素,全球患病人数不断攀升。
JWK001注射液是首个采用“两质粒包装系统”的AAV基因治疗新药。金唯科自主研发的两质粒悬浮HEK293细胞包装技术,比三质粒包装效率提升10倍,大幅降低了生产成本。金唯科的CMC工艺稳定且成本低,在临床阶段以及商业化阶段将具有非常明显的优势,极大提升患者可及性。
基于自主开发的“两质粒包装系统”技术平台,金唯科研发的6款AAV基因治疗新药已取得伦理批件,正在四川大学华西医院开展IIT研究,适应症包括眼科、遗传代谢和神经肌肉疾病。
JWK001注射液设计了自主创新的多靶点基因表达框,增加覆盖单一靶点不敏感患者,提升药物疗效。JWK001注射液具有起效剂量低、安全性好等优势,并已获得国家发明专利授权。
JWK001注射液通过将携带全新自主设计的抗VEGF蛋白表达框的AAV载体,在视网膜细胞中持续高效表达抗VEGF蛋白。该基因治疗手段可以避免传统nAMD治疗中存在的风险,如反复玻璃体腔注射对眼组织的伤害、患者依从性差等,可实现一次治疗、长期有效的目的。
首例患者在接受JWK001用药之前,年化抗VEGF注射次数为10.18次。在JWK001用药后,20周内不再需要进行补充抗VEGF治疗。
给药后20周后,首例受试者的最佳矫正视力(BCVA)由49个字母上升至61个字母,提高了12个字母(EDTRS矫正视力表检查)。
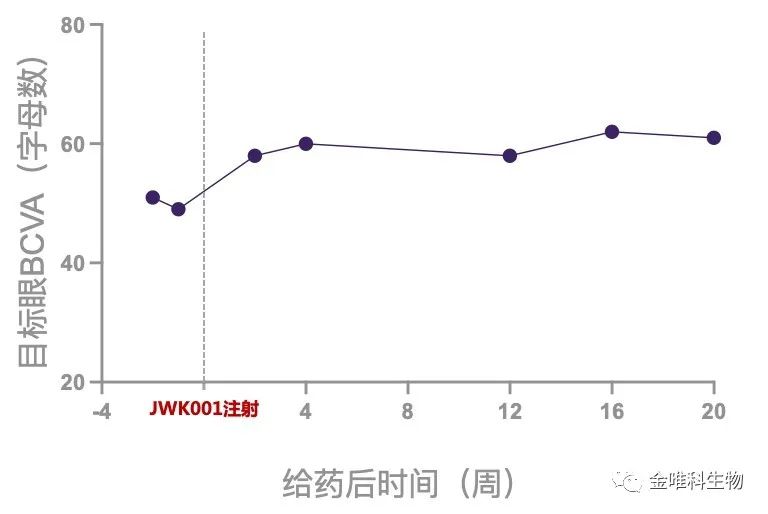
图:JWK001治疗后患者CRT稳定
给药后20周,首例受试者的中央视网膜厚度维持稳定。
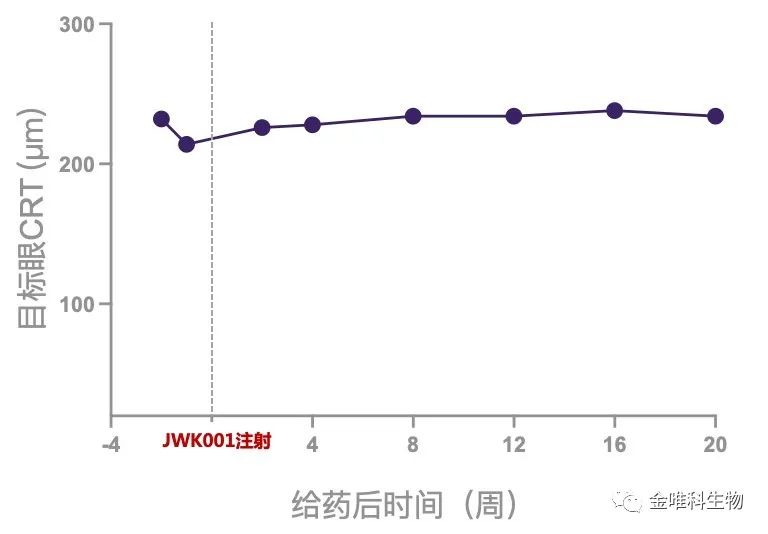
图:JWK001治疗后患者CRT稳定
金唯科生物联合创始人、CEO杨阳研究员表示:“JWK001注射液低剂量组首例受试者的持续跟踪结果来看,JWK001注射液的安全性和耐受性良好、起效剂量低,患者只需要一次给药,无需辅助治疗,给患者带来了极大的便利性。IIT临床结果将为我们推进临床一期奠定坚实基础,我们将在IND获批后,加速推进临床进度,以使更多患者受益。”
派真生物倍感荣幸能够助力金唯科生物的AAV基因治疗药物进展,为其IND管线提供了一站式的分析检测服务,包括方法开发及验证、放行检测、稳定性测试及表征研究,对从小试到中试生产的产品提供了整体的检测放行,加速推动基因治疗新药JWK001注射液临床试验申报!未来,派真生物也将继续秉承“让老百姓用得起基因治疗”的使命,不断深耕载体工艺与技术的开发,为药物创新提供一站式CMC解决方案,助推基因治疗药物申报!
资料来源
1.公众号金唯科生物
https://mp.weixin.qq.com/s/CS08302q93k6THGO-YYWBg
